2.1: Agua
- Page ID
- 53129
No hay vida sin agua. En este capítulo, se utilizará el agua para revisar algunas ideas muy básicas en química, particularmente en lo que se refiere a la biología celular y molecular. ¿Qué es el agua? H 2 O. Dos átomos de hidrógeno y un átomo de oxígeno (Figura\(\PageIndex{1}\)). Juntos forman una molécula de agua. Se definen como una molécula por la presencia de fuertes enlaces químicos que conectan cada átomo.
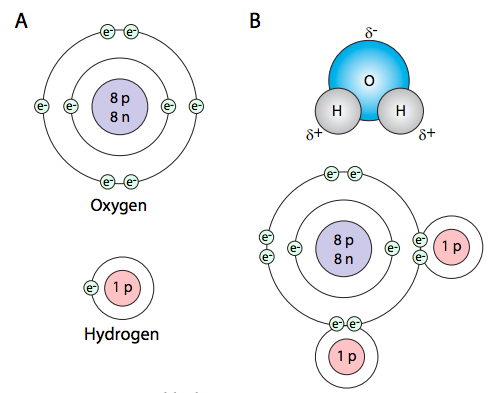
En este caso, cada átomo está conectado a otro por un enlace covalente. Estos son el tipo de enlaces químicos más fuertes, y se forman cuando dos átomos comparten electrones con el fin de llenar su capa de electrones más externa (valencia) y aumentar la estabilidad.
El volumen de un átomo está definido por electrones en un óbit muy rápido y energético alrededor de un núcleo. Los electrones son partículas muy pequeñas cargadas negativamente, y el núcleo está compuesto por neutrones (eléctricamente neutros) y protones (cargados positivamente), ambos relativamente masivos en comparación con los electrones. Las órbitas de los electrones alrededor del núcleo pueden ser aproximadas por “conchas” o niveles. Estas conchas tienen característicamente limitaciones en el número de electrones que pueden caber dentro de ellas: la primera capa (más cercana al núcleo) contiene solo 2 electrones, mientras que la segunda capa contiene 8, y la tercera capa contiene 18. El átomo es más estable cuando se llena su capa externa (y por extensión, todas las internas también). La energía de los electrones también varía según el nivel: los electrones más internos tienen la menor energía mientras que los electrones más externos tienen la mayor cantidad.
En el caso aquí mostrado, el hidrógeno (H) tiene solo un electrón, y para la máxima estabilidad de esa capa de electrones, debería tener dos. El oxígeno, por otro lado, tiene seis electrones en su capa exterior, y una capa llena tendría ocho. Por lo tanto, le “gustaría” tirar de dos electrones más para una estabilidad máxima. Como se muestra en la Figura\(\PageIndex{1}\) B, ambos requisitos se cumplen cuando cada uno de los átomos de hidrógeno comparte un electrón con el oxígeno, que también comparte un electrón cada uno con el hidrógeno. La molécula de agua también se puede escribir como H-O-H, en la que la línea continua simple indica un par de electrones compartidos, es decir, un enlace covalente sencillo. La energía de un enlace covalente simple promedio es de aproximadamente 80 kcal/mol. Sin embargo, como se muestra a continuación, son posibles enlaces covalentes dobles e incluso triples. La fuerza de esos tipos de enlaces es ligeramente menor que el doble (~150 kcal/mol) o triple (~200 kcal/mol) la energía de los enlaces simples.
La energía de enlace es una medida de la fuerza del enlace entre dos átomos unidos covalentemente, y es proporcional a la distancia del enlace, que está determinada por los radios atómicos. No es lo mismo que la energía de disociación del enlace, que es la energía liberada en una reacción homolítica (el enlace se divide con electrones distribuidos equitativamente) que tiene lugar en cero absoluto, pero son similares en ser medidas de fuerza de enlace.
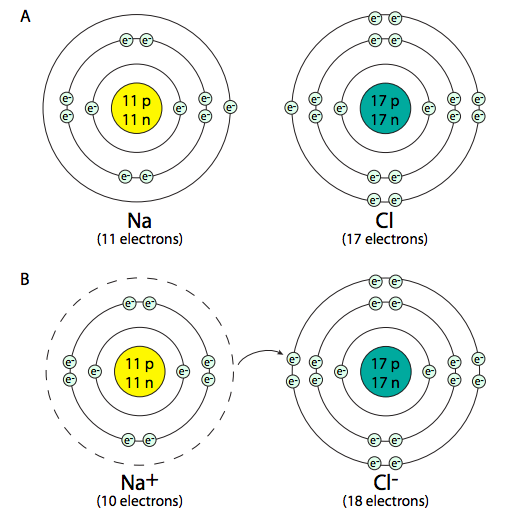
Compartir electrones no es la única manera de crear enlaces entre átomos. Los enlaces iónicos se crean cuando un átomo dona o recibe un electrón, en lugar de compartirlo. Cuando un átomo cede un electrón, el equilibrio eléctrico entre los números de protones cargados positivamente en su núcleo y electrones cargados negativamente se altera, y el átomo general ahora tiene una carga eléctrica positiva. De manera similar, cuando un átomo recibe un electrón extra, el saldo en un átomo neutro se altera, y el átomo se carga negativamente. Se forma un enlace iónico cuando un átomo dona un electrón a un átomo adyacente, creando un par iónico, uno positivamente y otro cargado negativamente. La atracción eléctrica entre los átomos cargados opuestamente los mantiene unidos.
Aunque las sales (como el NaCl) son compuestos iónicos, no todos los compuestos iónicos son sales. La definición química de una sal requiere que el compuesto se forme mediante la sustitución de un ion hidrógeno (H+) en el compuesto original. Esto suele ocurrir en reacciones de neutralización, como la neutralización de ácido clorhídrico, HCl (o H + Cl -) con hidróxido de sodio (Na + (OH) -), que produce la sal NaCl, y agua (HOH = H 2 O).
Los enlaces iónicos son más débiles que los enlaces covalentes, con una energía de enlace promedio de ~5.5 kcal/mol. Tanto los enlaces covalentes como los iónicos son termodinámicamente estables en condiciones secas a temperatura ambiente (25°C, 298 K, 77°F). La energía promedio impartida cuando las moléculas chocan a esta temperatura es de solo ~0.6 kcal/mol, mucho menor que la energía necesaria para romper un enlace covalente o iónico.
Los enlaces covalentes e iónicos entre los átomos son la única forma de hacer moléculas, que son colecciones estables de átomos unidos químicamente. Sin embargo, existen otras interacciones atractivas entre átomos y moléculas, pero son significativamente más débiles, y pueden alterarse con cambios relativamente pequeños en la temperatura o las condiciones ambientales. Estas son las fuerzas de van der Waal. Son interacciones de muy corto alcance, requiriendo una estrecha aposición de los dos átomos. Como se mencionó, un enlace de hidrógeno individual (un tipo específico de fuerza de van der Waal que se describe a continuación) u otra interacción de van der Waal puede interrumpirse fácilmente, pero este tipo de interacciones generalmente ocurren en masa. En cierto sentido, son como Velcro ® molecular: cada pequeño gancho de plástico individual y cada lazo individual de nylon apenas podían sujetar dos pelos juntos, pero un traje de velcro puede sostener a una persona en una pared vertical (a la Late Night with David Letterman, 1984).
En el caso de los enlaces de hidrógeno, estos ocurren cuando existe un intercambio de electrones asimétrico permanente dentro de una molécula unida covalentemente de manera que los electrones compartidos pasan más tiempo alrededor de un núcleo (impartiendo así un carácter negativo), que del otro (que por lo tanto es de carácter algo positivo) para crear un dipolo eléctrico permanente. Estos momentos dipolares pueden interactuar con momentos cargados opuestamente en otras moléculas o en la misma molécula. Las fuerzas de Van der Waals también incluyen interacciones dipolo-dipolo inducidas (no permanentes) en las que un cambio temporal en la densidad de electrones a medida que orbitan el núcleo forma un diferencial de carga minuto, que puede inducir un diferencial de carga opuesto y atractivo en un átomo vecino muy cercano. De hecho, algunos textos definen a las fuerzas de van der Waals exclusivamente como tales, dejando los enlaces de hidrógeno como una categoría separada por completo. Uno de los argumentos para esa idea es que la longitud del enlace del enlace H promedio es menor que la suma de los radios de van der Waal de los dos átomos.
Como se señaló anteriormente, los enlaces de hidrógeno son el resultado de una distribución severamente desigual de electrones que generan dipolos permanentes. En los sistemas biológicos, esto generalmente significa que un hidrógeno está unido covalentemente a un átomo de oxígeno o a un átomo de nitrógeno, que son ambos átomos altamente electronegativos, atrayendo fuertemente a los electrones compartidos lejos del hidrógeno. Los pares de enlaces de hidrógeno comunes son OH:O, OH:N, NH:N, y NH:O. Las líneas punteadas son un método común para representar enlaces de hidrógeno en texto impreso y diagramas.
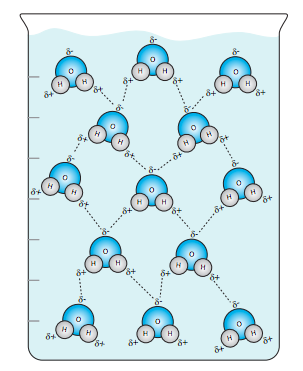
El agua es una molécula que tiene un dipolo permanente (es decir, es una molécula polar), con el núcleo de oxígeno altamente electronegativo tomando la mayor parte del tiempo de los electrones compartidos, dejando los núcleos de hidrógeno desnudos a sus protones. La geometría de la molécula de agua (Figura\(\PageIndex{1}\) B) hace que un lado de la molécula sea algo negativo con dos pares de electrones libres, y el lado opuesto positivo, porque los electrones compartidos rara vez están cerca de los núcleos de hidrógeno. Esto le da al agua la capacidad de formar enlaces de hidrógeno, y es la base de varias de las cualidades más importantes del agua. La capacidad de formar muchos enlaces de hidrógeno conduce a un alto calor específico de agua y le permite actuar como un generoso amortiguador de calor. Para que suficientes moléculas de agua se muevan más rápido y aumenten la temperatura del agua, primero se debe utilizar la energía que se pone en el agua para romper los enlaces de hidrógeno sin generar calor. Esto es diferente a la mayoría de los otros líquidos, que no se enlazan internamente con la unión H. Por lo que el agua es capaz de absorber más calor (energía) sin un cambio de fase que muchos otros líquidos.
Otra característica importante y única del agua es que la fase sólida (hielo) es menos densa que la fase líquida. Con la mayoría de los otros líquidos, a medida que baja la temperatura, las moléculas tienen menos energía, por lo que se mueven menos, y se mantienen más juntas, aumentando la densidad. Sólo una parte de eso es cierto con el agua. Nuevamente, la capacidad de formar enlaces de hidrógeno está directamente relacionada con esto: a medida que baja la temperatura, las moléculas se mueven menos, brindándoles más oportunidades para formar enlaces de hidrógeno. Sin embargo, a pesar de que son atractivos, los enlaces H también actúan como espaciadores que separan las moléculas de agua más que si se les permitiera voltear juntas en un líquido sin formar enlaces H.
Este aspecto de la química del agua es en realidad más importante para la vida en un sentido geológico que a nivel celular. A nivel celular, la consecuencia es que la congelación de las células hace que el agua en ellas se expanda y estalle, matándolas a bajas temperaturas a menos que la célula tenga sustancias químicas que actúen como anticongelantes y bajen la temperatura de congelación del citoplasma. Por otro lado, a nivel geológico, cuando un estanque o lago se congela en invierno, el hielo es menos denso que el agua, permaneciendo así en lo alto del estanque, aislando capas más profundas, y ayudándolos a mantenerse líquidos y capaces de soportar la vida (muchos organismos migran más abajo en el invierno). Si el agua se volvía más densa a medida que se congelaba, como muchas otras moléculas, el hielo se hundiría, y eventualmente todo el estanque estaría completamente sólido, ¡matando la mayor parte de la vida en él una vez al año!
Desde un punto de vista químico, la naturaleza polar del agua la convierte en un excelente solvente para moléculas iónicas y polares. Como se puede ver en la Figura, el lado hidrógeno del agua interactúa con el ion cloruro cargado negativamente, mientras que el lado oxígeno del agua interactúa con el ion sodio cargado positivamente, disolviendo así fácilmente la sal. Sin embargo, la polaridad del agua también la hace repeler moléculas no polares o por regiones no polares de moléculas. Esta propiedad, conocida como hidrofobicidad, es crucial para la vida, ya que es la base para la formación de las membranas biológicas que definen a una célula. En términos generales, el enlace H entre las moléculas de agua es muy estable. Las moléculas no polares no pueden participar en la unión H y, por lo tanto, crean áreas de inestabilidad dondequiera que estén tocando soluciones acuosas (a base de agua). La resolución de este problema es que las moléculas hidrofóbicas se agreguen, disminuyendo así la superficie total en contacto con el agua. En los organismos vivos, muchas moléculas de proteínas y lípidos son anfipáticas, con algunas porciones hidrófobas, mientras que otras partes de la molécula son hidrófilas.


