4.4: El potencial de acción en las neuronas
- Page ID
- 53449
El transporte de solutos dentro y fuera de las células es crítico para la vida. Sin embargo, en las neuronas, el movimiento de iones tiene otra función crucial en los animales metazoos: la producción de potenciales de acción utilizados para la neurotransmisión. Esta especialización permite una transmisión extremadamente rápida de la información a través de largas distancias. Un ejemplo que mi mentor usaría cuando enseñaba neurociencia básica a escolares era una neurona bipolar que se extiende desde el dedo del pie hasta el cerebro. Para que la información del dedo del pie sea útil, debe llegar al cerebro para procesarla muy rápidamente. Esta señal puede tener que recorrer varios metros en una jirafa, mucho más en ballenas. Ninguna señal química puede moverse tan rápido, y a pesar de la simplificación popular y representaciones dramáticas en la televisión, la electricidad no fluye a través de las neuronas como si fueran cables de cobre.
En el estudio del AChR se han utilizado diversas toxinas potentes, entre ellas la histrionicatoxina, un veneno de flecha extraído de una rana arbórea sudamericana, Dendrobates histrionicus, curare (d-tubocurarina) aislada de ciertas plantas, y a-bungarotoxina, que se aísla de la serpiente taiwanesa, el krait bandeado. Los tres actúan por inhibición competitiva, bloqueando la apertura del canal AChR.
La acetilcolina se disocia espontáneamente de AChR en aproximadamente un milisegundo, cerrando el canal. Entonces podría ser reactivada por la acetilcolina, pero esta está fuertemente regulada por la enzima acetilcolinesterasa (AChE), que es una proteína anclada a GPI en la membrana de la célula diana, y evita la sobreestimulación por la rápida degradación de la acetilcolina. El sarín de gas nervioso militar, que ganó notoriedad en un ataque de 1995 al sistema del metro de Tokio, funciona inactivando la AChE, provocando así una sobreestimulación de AChR.
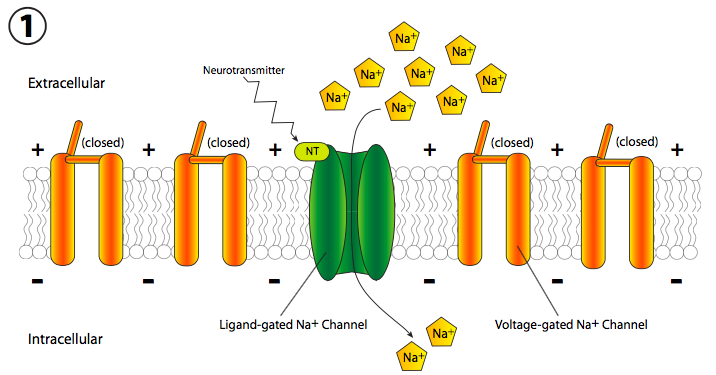
La realidad implica cambios rápidos en el potencial de membrana. Dado que eso se mide en voltios y es una diferencia en la carga eléctrica a través de la membrana, a veces se piensa coloquialmente como transmisión eléctrica, pero el mecanismo es completamente diferente de los electrones que fluyen a través de un cable. En cambio, hay un cambio móvil en el potencial de membrana debido a la apertura secuencial de los canales iónicos a lo largo de la longitud del axón (la parte larga y delgada de la célula nerviosa). Generalmente, la señal comienza con una señal química excitadora, o neurotransmisor (Figura\(\PageIndex{18}\)), que se une a un receptor en la neurona. Este receptor puede estar unido a un canal iónico o puede ser él mismo un canal iónico activado por ligando. En cualquier caso, el canal se abre y Na + entra en la celda.
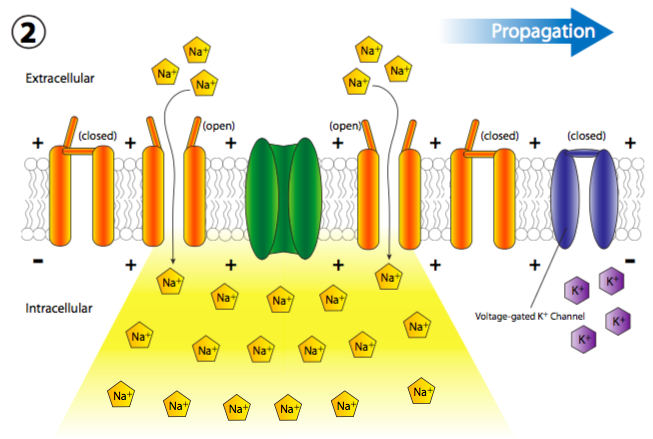
La afluencia repentina de cargas positivas despolariza transitoria y localmente la membrana (más + cargas a lo largo del interior de la membrana que en el exterior). La despolarización de la membrana cerca del canal hace que todos los canales cercanos de Na + regulados por voltaje se abran transitoriamente (Figura\(\PageIndex{19}\)), permitiendo así una nueva descarga de iones Na + en la célula que luego puede despolarizar otra pequeña sección de membrana. Aunque técnicamente, los canales se abren a ambos lados del receptor, normalmente, el receptor se localiza en el cuerpo celular principal, o soma, mientras que la mayoría de los canales iónicos están alineados a lo largo del axón. Por lo tanto, existe una direccionalidad de facto a la propagación de la despolarización.
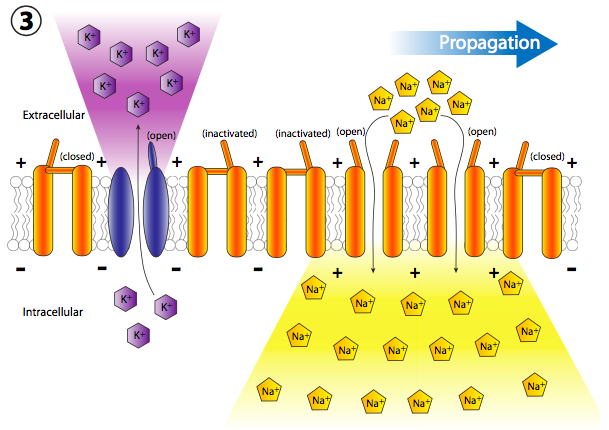
Más canales de Na + con compuerta de voltaje se abren rápidamente después de que sus canales vecinos se han abierto y despolarizado su sección de la membrana, lo que lleva a una larga reacción en cadena de despolarizaciones reguladas por voltaje hasta el axón (Figura\(\PageIndex{20}\)). Una vez que la señal se propaga por el axón, hay dos preguntas que deberían venir a tu cabeza. Primero, las neuronas no son células desechables, entonces, ¿cómo se restablecen todos estos canales abiertos y la membrana se repolariza para el siguiente potencial de acción? Y segundo, ¿por qué la onda de despolarización no se volvería bidireccional ya que cada pequeña área de despolarización se extiende en ambas direcciones desde la puerta Na + abierta?
De hecho, las respuestas a ambas preguntas están estrechamente relacionadas, y tiene que ver con el mecanismo de activación de los canales iónicos regulados por voltaje (Figura\(\PageIndex{21}\)). Los canales iónicos controlados por voltaje tienen dos puertas: una que se abre en respuesta a un aumento en el potencial de membrana y otra que cierra el canal después de un corto período de tiempo. Esto significa que hay tres estados de potencial para la mayoría de los canales iónicos regulados por voltaje: cerrado, abierto e inactivado.
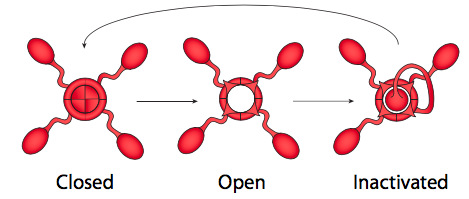
El estado inactivado ocurre cuando la segunda puerta (más como un enchufe, realmente) se cierra, porque esta es insensible al voltaje. El enchufe finalmente sale del poro y la puerta sensible al voltaje se coloca de nuevo en su lugar al estado cerrado. Los canales K + sensibles al voltaje son tetrámeros, como se muestra aquí, y cada subunidad porta un dominio de inactivación potencial. La elección de qué dominio parece ser aleatoria. Los canales Na + sensibles al voltaje, por otro lado, también tienen cuatro regiones transmembrana, pero todos son parte de una sola proteína, y el canal solo tiene una puerta/dominio de inactivación. Sin embargo, el mecanismo de activación de tres estados sigue siendo el mismo.
Volver al potencial de acción: cada nueva despolarización abre el siguiente conjunto adyacente de canales Na + con compuerta de voltaje, y así sucesivamente. En un axón neuronal, que es donde ocurren los potenciales de acción, el movimiento de las despolarizaciones ocurre muy rápido y unidireccionalmente. Sucede rápidamente porque el axón es una proyección delgada muy larga de la célula, por lo que el volumen es pequeño y por lo tanto la afluencia de Na + puede despolarizar rápidamente una sección larga de membrana. Ocurre unidireccionalmente porque los canales Na + sensibles al voltaje previamente abiertos pasan a un estado refractario inactivado que no se puede reabrir de inmediato.
Así, cuando la onda adyacente de despolarización golpea, los canales previamente abiertos no se vuelven a abrir, y la apertura de más canales regulados por voltaje continúa unidireccionalmente lejos del inicio.
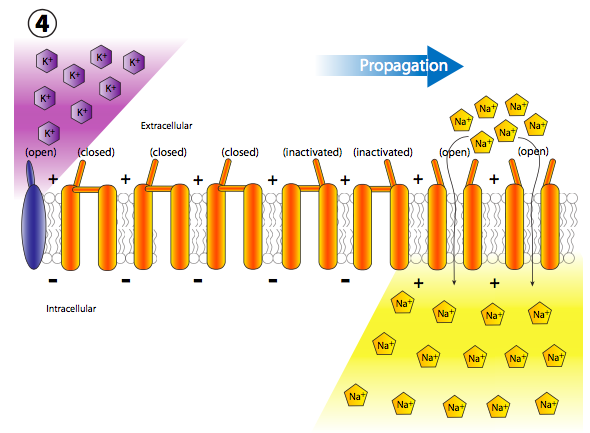
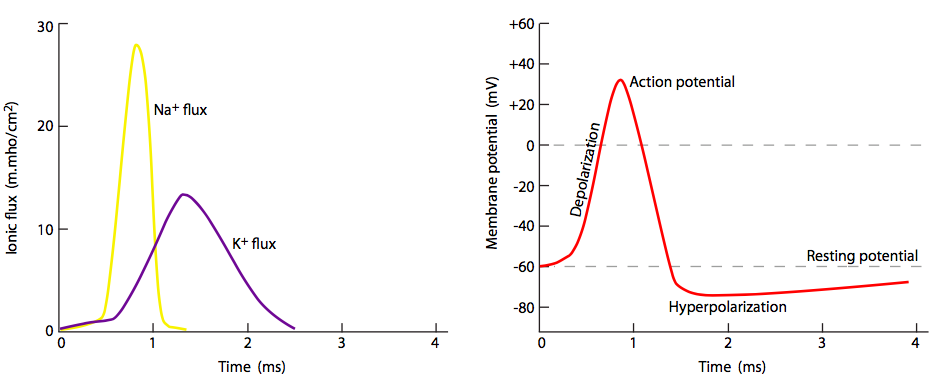
Pero espera, ¡hay más! El hecho de que los canales de Na + estén bloqueados y cerrados no significa que la membrana vuelva a la normalidad. ¿Qué repolariza la membrana detrás del potencial de acción? Los canales de potasio regulados por voltaje, los cuales se intercalan entre los canales de Na + (nótese iones y canales púrpuras en las figuras 20, 22). Se abren más lentamente que los canales de sodio (Figura\(\PageIndex{23}\)) y así alcanzan el flujo pico poco después del flujo pico de Na +. Así, la fase de recuperación, o repolarización hacia el potencial de reposo, es ayudada tanto por el cese del movimiento interno de Na + como del movimiento continuo hacia el exterior K +.
Dado que todos los potenciales de acción se comportan de la misma manera desde el punto de vista de los cambios en el potencial de membrana, la diferencia entre las señales nerviosas más fuertes y débiles está en la frecuencia/tasa de disparo del potencial de acción, no en la magnitud del flujo iónico.
Dado que la transmisión neuronal de información es crítica para muchos sistemas, no es de extrañar que una variedad de organismos hayan evolucionado toxinas que pueden paralizar o matar a un atacante o presa. Curiosamente, el objetivo principal de las toxinas es el canal Na + activado por voltaje, y no el canal K +.
La toxina más utilizada en la investigación es la tetrodotoxina (TTX), la cual se deriva de la piel y ciertos órganos del pez globo (Fugu rubripes). Este pescado es considerado un manjar (principalmente en Japón), e incluso cuando es preparado por chefs expertos y especialmente entrenados, la pequeña cantidad de TTX residual en la carne provoca un hormigueo adormecimiento de la lengua a medida que se bloquea la excitación neural. Curiosamente (pero no relacionado con los canales iónicos) fugu tiene un genoma altamente comprimido, donde la mayoría de los otros eucariotas tienen grandes franjas de regiones no codificantes, fugu tiene poco y sus genes están muy cerca entre sí. De hecho, ¡tiene casi tantos genes predichos como el genoma humano en solo 1/8 el ADN!
La saxitoxina (STX) es otro veneno que actúa sobre el canal Na + activado por voltaje. Es producido por el plancton que causa “marea roja” (dino agelados del género Alexandrium, Gymnodium y Pyrodinium) y es concentrado por filtro-alimentadores como mejillones, ostras y otros peces con concha. Curiosamente, STX alguna vez fue investigado por los militares estadounidenses como agente nervioso para la guerra química, bajo la designación TZ. Tanto STX como TTX se unen a la superficie externa del canal cerrado de Na + regulado por voltaje cerca de la boca del poro, evitando la apertura y bloqueando así el flujo de Na +.
La batracotoxina, por otro lado, se une a los canales Na + regulados por voltaje cuando están abiertos en lugar de cerrados, por lo que hay una afluencia masiva continua de Na +. Producto de otra rana arbórea sudamericana, Phyllobates aurotaenia, esta toxina es utilizada como veneno de caza por tribus aborígenes de la zona, y es el veneno más potente actualmente conocido. Con una dosis letal de menos de 2 mg/kg, la batracotoxina es aproximadamente diez veces más mortal que la TTX. Sin embargo, para poner esto en perspectiva, la toxina botulínica, utilizada farmacológicamente como Botox ® y causa del botulismo, es mucho más de cien veces más potente (aunque actúa a través de un mecanismo completamente diferente, la prevención de la liberación de neurotransmisores).


