13.2: Colágeno
- Page ID
- 53445
Las proteínas de la matriz extracelular más grande y prominente, que constituyen una cuarta parte de la masa seca del cuerpo humano, son los miembros de la familia del colágeno. Los colágenos son polímeros que pueden clasificarse en tipos fibrilares (por ejemplo, colágenos I, II, III) y no fibrilares (por ejemplo, colágeno IV). Los colágenos fibrilares están formados por monómeros triples helicoidales de subunidades idénticas (homotrímeros) o diferentes (heterotrímeros). Estos monómeros se asocian luego en una interacción paralela compensada con otros monómeros de colágeno, lo que lleva a la formación de fibras largas. El examen microscópico electrónico de estas fibras largas muestra un patrón de bandas, el cual es indicativo del ligero espacio entre los monómeros a lo largo del mismo paralelo.
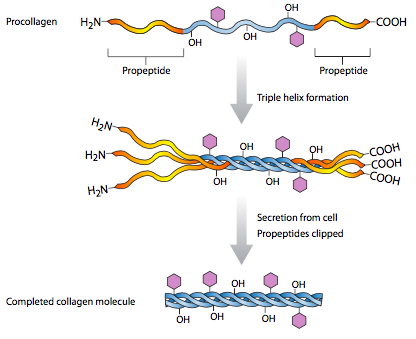
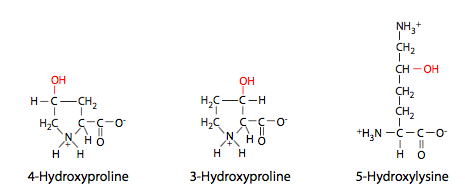
Al igual que todas las proteínas secretadas, el colágeno I se procesa en la sala de urgencias (Figura\(\PageIndex{2}\)), pero allí no se ensambla completamente: las tres cadenas pro-α se ensamblan en una triple hélice de procolágeno, que se secreta. Extracelularmente, entonces deben ser escindidos en ambos extremos para formar la proteína activa de colágeno, que es completamente fibrilar. Otros tipos de colágeno no tienen la misma escisión, y pueden tener dominios globulares en los extremos de las fibrillas. Los colágenos también son interesantes por su inusual composición de aminoácidos. Contienen una alta proporción de aminoácidos hidroxilados, principalmente prolinas y lisinas (Figura\(\PageIndex{3}\)). Esta hidroxilación es necesaria para el extenso enlace de hidrógeno que se produce entre subunidades y entre monómeros. Las fibrillas están asociadas con una alta resistencia a la tracción. Un ejemplo de ello serían las largas fibras de colágeno que corren paralelas al eje largo de tendones y ligamentos. Estas estructuras portadoras de alto estrés (que conectan hueso con músculo y hueso con hueso, respectivamente) requieren la resiliencia que las fibras de colágeno pueden proporcionar.
Por el contrario, las afecciones que afectan negativamente la formación de colágeno pueden conducir a afecciones graves de enfermedad. De hecho, una forma de epidermólisis ampollosa (la enfermedad hereditaria ampollosa de la piel introducida en el capítulo anterior) es causada por la mutación en el colágeno VII que es producido principalmente por queratinocitos epidérmicos y secretado en la capa de la membrana basal dérmico-epidérmica. Una variedad de condrodisplasias así como malformaciones óseas como la osteogénesis imperfecta (que puede ser perinatalmente letal) se han relacionado con mutaciones en diversos genes de colágeno. Finalmente, varios síntomas de escorbuto se deben a malformación de colágeno en la ECM: paredes débiles de los vasos sanguíneos, sangrado de encías y dientes sueltos, y huesos frágiles. El escorbuto es una enfermedad de deficiencia de ácido ascórbico (vitamina C), y el efecto sobre la MEC se debe a la necesidad de ácido ascórbico como cofactor de enzimas que hidroxilan las prolinas y lisinas del colágeno.
El colágeno es un componente importante de la membrana basal y la lámina basal. La lámina basal es fuerte y flexible, capaz de servir como soporte estructural para las láminas epiteliales adheridas a la misma, además de proporcionar una matriz/ filtro semipermeable que permite el paso de agua y moléculas más pequeñas, pero excluye macromoléculas más grandes. Los dos principales componentes proteicos de la lámina basal son el colágeno IV y la laminina. El colágeno IV tiene tanto dominios fibrilares largos como alfa-helicoidales, así como dominios globulares que pueden interactuar en diferentes orientaciones para formar la malla que establece la membrana basal. La red de laminina está conectada a la red de colágeno a través de proteínas enlazadoras de entactina (nidógeno).
Una interesante aplicación de fibrillas de colágeno es en la córnea, la cubierta transparente protectora del ojo. La córnea es la principal protección contra lesiones oculares, y debe ser dura. La capa central (estroma, o sustancia propia) está compuesta por aproximadamente 200 capas de fibrillas de colágeno paralelas estrechamente empaquetadas y regularmente espaciadas, con capas adyacentes dispuestas de manera que las fibrillas de colágeno se encuentran perpendicularmente de una capa a la siguiente. Este tipo de estructura laminar se utiliza en una variedad de materiales de construcción artificiales (incluido el material de construcción ubicuo, la madera contrachapada) y proporciona una gran resistencia en una masa relativamente pequeña. Algo asombrosamente, y bastante a diferencia de la madera contrachapada, la córnea es transparente. Se cree que esa propiedad proviene de la regularidad de la red de colágeno, lo que permite la cancelación de la luz dispersada de una fibrilla por interferencia destructiva de la luz dispersada de otra fibrilla. De manera algo contraintuitiva, en realidad se vuelve turbia (debido a la refracción) cuando absorbe líquido del humor acuoso, y tiene mecanismos activos para bombear dicho fluido de vuelta fuera de la córnea. Es por ello que la córnea se espesa y se vuelve translúcida después de la muerte: el mecanismo de bombeo ya no tiene energía para funcionar y el humor acuoso se difunde hacia la córnea.
El razonamiento detrás del uso de suplementos de glucosamina y sulfato de condroitina por personas con problemas articulares es que son dos de los azúcares que se encuentran en los proteoglicanos del tejido cartilaginoso como el menisco de la rodilla, y en otras articulaciones. El sulfato de condroitina en particular es el principal azúcar en los proteoglicanos del cartílago articular. Se cree que ambos estimulan la síntesis de GAG, y se ha observado una documentación limitada de los efectos inhibidores de proteasas y síntesis de colágeno. Datos de modelos de conejos (pero potencial conflicto de intereses, Lippiello et al, 2000) sugieren un beneficio terapéutico de dichos suplementos. Sin embargo, los estudios en humanos hasta el momento no han mostrado mejoría significativa en pacientes que ya padecen artritis moderada a grave y otras dolencias relacionadas con las articulaciones (Clegg et al, 2006). Un análisis de encuesta secundaria sugirió que había algo prometedor con respecto a los efectos en casos leves a moderados, pero los datos no fueron significativos.


