13.6: Integrinas
- Page ID
- 53425
Las integrinas se han introducido hasta ahora como receptores para fibronectina y laminina, pero es una gran familia con una amplia variedad de sustratos. Por ejemplo, la adhesión focal (Figura\(\PageIndex{8}\)) muestra un receptor de integrina unido al colágeno. Como ya se discutió en el capítulo anterior, las adherencias focales suelen ser transitorias, y se ven como puntos de contacto a medida que los fibroblastos u otras células migratorias se arrastran sobre una placa de cultivo o portaobjetos recubiertos con proteínas ECM.
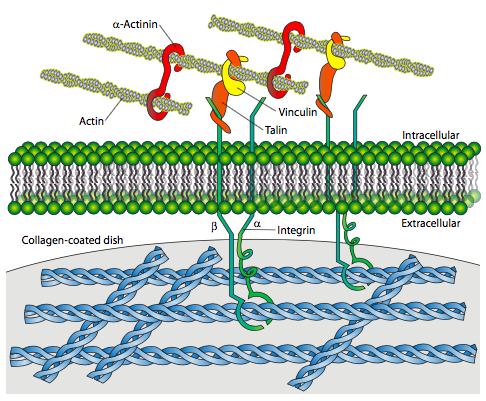
Además del colágeno, las fibronectinas y las lamininas también son posibles parejas de unión para las integrinas. Como muestra el cuadro 1, la diversidad de subunidades y combinaciones significa que las integrinas están involucradas en una amplia gama de procesos celulares, y pueden unirse a proteínas de la superficie celular así como ECM.
| Subunidades | Ligando | Distribución |
|---|---|---|
| α1β1 | principalmente colágenos, también laminina | generalizado |
| α2β1 | principalmente colágenos, también laminina | generalizado |
| α4β1 | fibronectina, VCAM-1 | células hematopoyéticas |
| α5β1 | fibronectina | fibroblastos |
| α6β1 | laminina | generalizado |
| α6β4 | laminina | células epiteliales |
| αLβ2 | ICAM-1, ICAM-2 | Linfocitos T |
| αllbβ3 | fibronectina, fibrinógeno | plaquetas |
Con esta variedad, no es sorprendente que no todas las integrinas se unan a secuencias RGD, aunque la mayoría lo hace. Por ejemplo, las integrinas α2β1 prefieren secuencias YYGDLR o FYFDLR, y αIIbβ3 se une fuertemente tanto a la secuencia RGD como a una secuencia KQAGDV. Se ha demostrado que la activación de integrinas inicia vías de señalización, iniciando la quinasa de adhesión focal (FAK) o algunas otras quinasas centrales, que controlan las actividades desde el reordenamiento citoesquelético hasta la supervivencia celular.
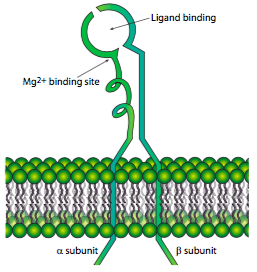
Ambas subunidades α y β son proteínas transmembranales que pasan a través de la membrana una sola vez. Evolutivamente, se encuentran sólo en especies metazoicas, pero también se encuentran en todas las especies metazoicas. Todas las integrinas menos una, α6β4, se conectan al citoesqueleto del microfilamento de actina a través del dominio citoplásmico de la subunidad b. La integrina α6β4 se une al citoesqueleto de filamento intermedio, en parte porque el dominio citoplásmico β4 es muy grande y se extiende más hacia el citoplasma. En el lado extracelular, existe un sitio de coordinación de iones metálicos usualmente ocupado por Mg 2+, que es necesario para la unión del ligando. También hay varios otros sitios de unión a iones divalentes, El receptor se puede encontrar en un estado inactivo (algo doblado hacia la membrana) o en un estado activo (enderezado). En el estado inactivo, la subunidad a se une a la subunidad β impidiendo de cerca la interacción con el citoesqueleto. Sin embargo, una vez un dominio citoplasmático de subunidad, desplaza la subunidad a, provocando una ligera separación de las dos subunidades y conduciendo a la activación del receptor. De hecho, las integrinas demuestran lo que se conoce como señalización “de adentro hacia afuera”, en la que una señal celular (por ejemplo, de la cascada de señalización de un factor de crecimiento) conduce a alteraciones en el dominio citoplásmico y que desplaza la conformación del dominio extracelular a un estado activo enderezado en el que puede unirse más fácilmente a ligandos. Es por ello que las integrinas son tan adecuadas para las adherencias focales y otras adherencias “en movimiento” que deben adherirse y liberarse rápidamente. Aunque el reciclaje de los receptores también ocurre, encenderlos o apagarlos mediante señalización de adentro hacia afuera es un mecanismo efectivo para un movimiento rápido.
Como cabría esperar de una estructura ligada a actina, las adherencias focales y sus equivalentes in vivo son puntos de contacto transitorios y dinámicos entre la célula y el sustrato sobre el que se arrastra. Sin embargo, hay muchas situaciones en las que una célula no solo es estacionaria, necesita estar firmemente unida a su sustrato para ceñirse por lo que los estresores puedan llegar a probar su resolución. En estos casos, el citoesqueleto de actina es demasiado efímero para la tarea.


