3.2: Transporte en Membranas
- Page ID
- 53107
Fuente: BiochemFFA_3_2.pdf. Todo el libro de texto está disponible de forma gratuita de los autores en http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
Movimiento de materiales a través de membranas
Como se señaló anteriormente, es esencial que las células puedan absorber nutrientes. Esta función junto con el movimiento de iones y otras sustancias es proporcionada por complejos proteínas/proteínas que son altamente específicos para los compuestos que mueven.
El movimiento selectivo de iones por las proteínas de membrana y la permeabilidad extremadamente baja de los iones a través de la bicapa lipídica son importantes para ayudar a mantener el equilibrio osmótico de la célula y también para proporcionar el mecanismo más importante para que ésta produzca ATP, el proceso de fosforilación oxidativa.
Terminología
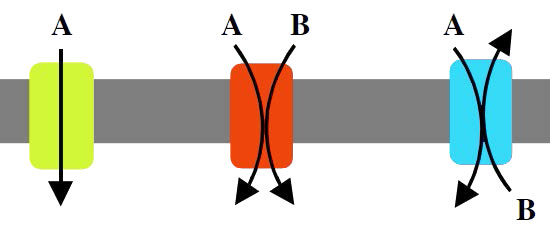
Una proteína involucrada en mover solo una molécula a través de una membrana se llama unipuerto (Figura 3.25). Las proteínas que mueven dos moléculas en la misma dirección a través de la membrana se llaman simports (también llamados synporters, synports, o symporters). Si dos moléculas se mueven en direcciones opuestas a través de la bicapa, la proteína se llama antipuerto. Las proteínas involucradas en el movimiento de iones se llaman ionóforos.
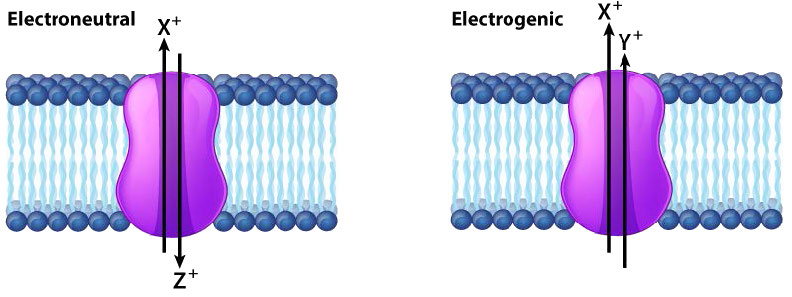
Si la acción de una proteína en el movimiento de iones a través de una membrana da como resultado un cambio neto en la carga, la proteína se describe como electrogénica y si no hay cambio en la carga la proteína se describe como electroneutral (Figura 3.26). Cuando la fuerza impulsora para el movimiento a través de la proteína de membrana es simplemente difusión, el proceso se denomina difusión facilitada o transporte pasivo y cuando el proceso requiere otra entrada de energía, el proceso se denomina transporte activo.
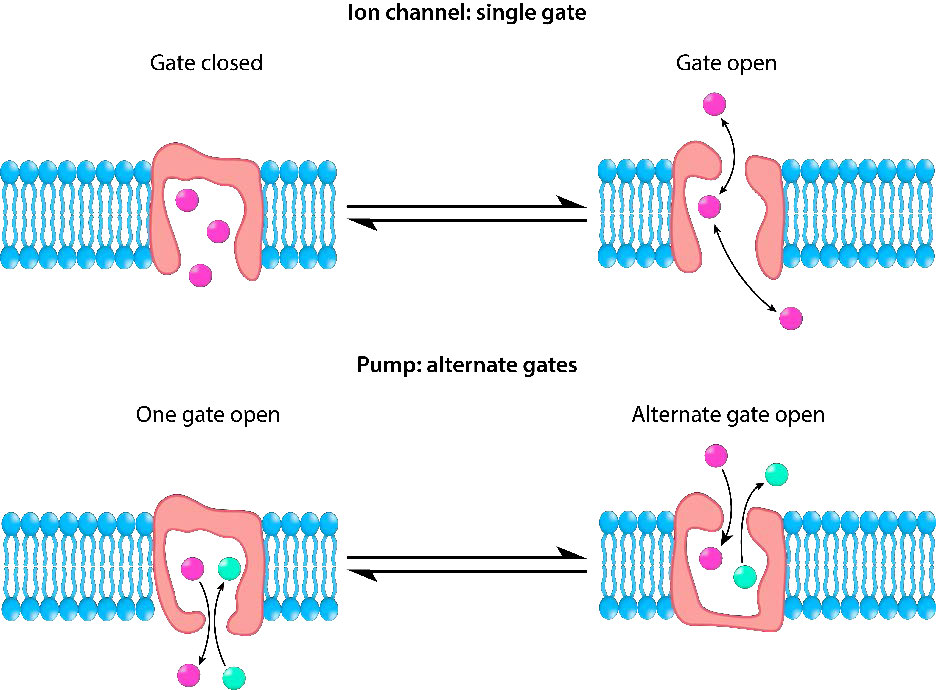
Canales y transportadores
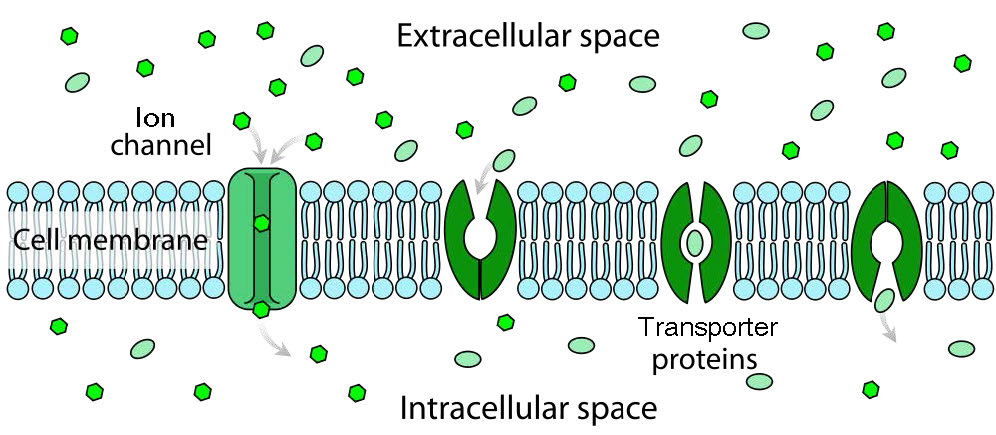
Con respecto al movimiento de materiales a través de proteínas de membrana, existe una diferencia entre canales (a veces llamados poros) y transportadores. Los canales proporcionan en gran medida aberturas con cierta especificidad y las moléculas pasan a través de ellos cerca de la velocidad de difusión. Suelen implicar movimiento de agua o iones. Ejemplos serían los canales de sodio o potasio de las células nerviosas. Los transportadores tienen alta especificidad y tasas de transferencia que son órdenes de magnitud más lentas. Las proteínas de transporte incluyen la bomba de sodio-potasio, el intercambiador de sodio-calcio y la permeasa de lactosa, entre muchas otras).
Difusión facilitada
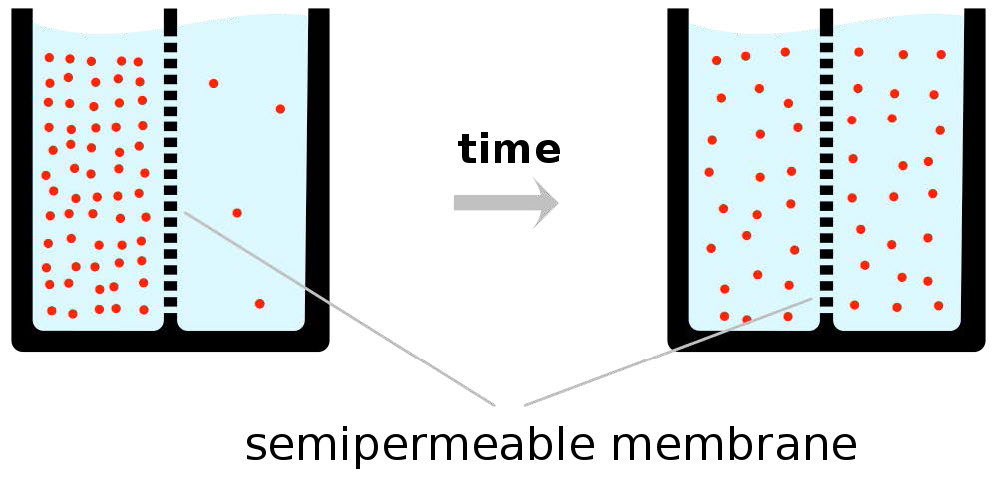
Como se señaló, la fuerza impulsora para la difusión facilitada es la concentración, lo que significa que en la difusión facilitada, los materiales solo pasarán de una concentración mayor a una concentración menor y que al final del proceso, la concentración de materiales en cada lado de una bicapa será igual (Figura 3.28). Esto puede funcionar bien en muchos casos.
Por ejemplo, la concentración de glucosa en sangre es lo suficientemente alta como para que los glóbulos rojos puedan utilizar la difusión facilitada como medio para adquirir glucosa. Otras células, más retiradas del suministro de sangre donde la concentración de glucosa es menor, deben utilizar mecanismos de transporte activos porque no hay una concentración suficiente de glucosa para proporcionar a las células la glucosa que necesitan.
Canales de iones
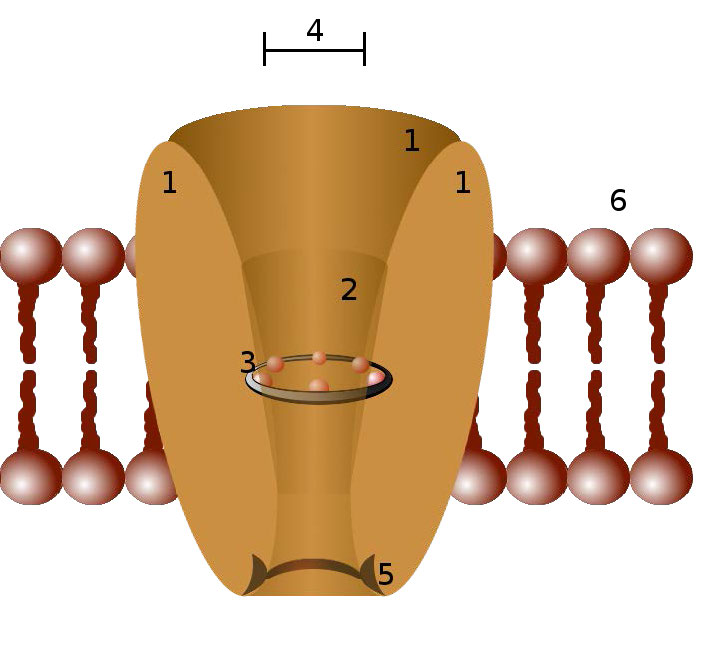
Los canales iónicos son proteínas de membrana formadoras de poros en las membranas de todas las células que regulan el movimiento de iones seleccionados a través de una membrana (Figuras 3.29 y 3.30). Ayudan a establecer el potencial de la membrana en reposo y a afectar los potenciales de acción y otras señales eléctricas. Son muy importantes en el proceso de transmisión nerviosa. Los canales iónicos controlan el flujo de iones a través de las células secretoras y epiteliales y, en consecuencia, ayudan a regular el volumen celular al afectar la presión osmótica.
Los canales iónicos son características esenciales de casi todas las células, funcionando como “túneles” selectivos que restringen el movimiento a través de ellos a iones con características específicas (típicamente de tamaño). El tamaño de la abertura es muy estrecho (generalmente uno o dos átomos de ancho) y es capaz de seleccionar incluso contra iones que son demasiado pequeños.
Mecanismos de control
Los canales iónicos son controlados por mecanismos que incluyen voltaje, ligandos, luz, temperatura y deformación mecánica (estiramiento activado). Los canales iónicos regulados por ligando (LGIC) son proteínas transmembrana que se abren para permitir selectivamente que iones tales como Na+, K+, Ca++ o Cl- pasen a través de la membrana en respuesta a la unión de un mensajero de ligando.
Las ondas sonoras provocan la deformación mecánica de las células ciliadas en el oído. Esto da como resultado la apertura de canales iónicos y la iniciación de una señal nerviosa al cerebro.
Los canales iónicos de sodio en la lengua para receptores de azúcar se abren en respuesta a la unión de sacarosa, permitiendo que la concentración de sodio en la célula nerviosa aumente e inicie una señal nerviosa al cerebro. En este caso, el valor por defecto para la puerta es cerrar y se abre en respuesta a la unión de un ligando (sacarosa).
En las células detectoras de luz del ojo, las compuertas de calcio están abiertas por defecto, pero la estimulación por la luz hace que se cierren, desencadenando una serie de eventos que dan como resultado que una señal sea enviada al cerebro sobre la percepción de la luz. Así, en este caso, el estímulo (luz) provoca el cierre de un canal abierto.
Al mover la otra dirección, las señales nerviosas que se originan en el cerebro viajan al tejido muscular y a través de un complicado conjunto de intercambios, resultan en la apertura de puertas de calcio de las células musculares, aumentando la concentración de calcio y estimulando la contracción muscular (ver AQUÍ).
Los canales de voltaje son esenciales para la transmisión de señales nerviosas, un proceso discutido con más profundidad AQUÍ.
Movimiento de iones a través de canales
La capacidad de los canales iónicos para seleccionar iones demasiado grandes es intuitiva: el tamaño de la abertura en el canal iónico simplemente no es lo suficientemente grande para que un ion más grande se ajuste a través de la abertura. El potasio, por ejemplo, pasa a través de canales de sodio raramente porque la abertura es demasiado pequeña.
Los canales de potasio que son selectivos para los iones potasio deben ser lo suficientemente grandes como para permitir la entrada del potasio, pero si el tamaño fuera el único medio de selección, entonces los iones sodio también pasarían fácilmente a través de los canales de potasio, ya que los iones de sodio (0.95 Å) son más pequeños que los iones de potasio (1.33 Å). Para que los canales de potasio seleccionen contra los iones de sodio y favorezcan los iones de potasio, entran en juego otras consideraciones.
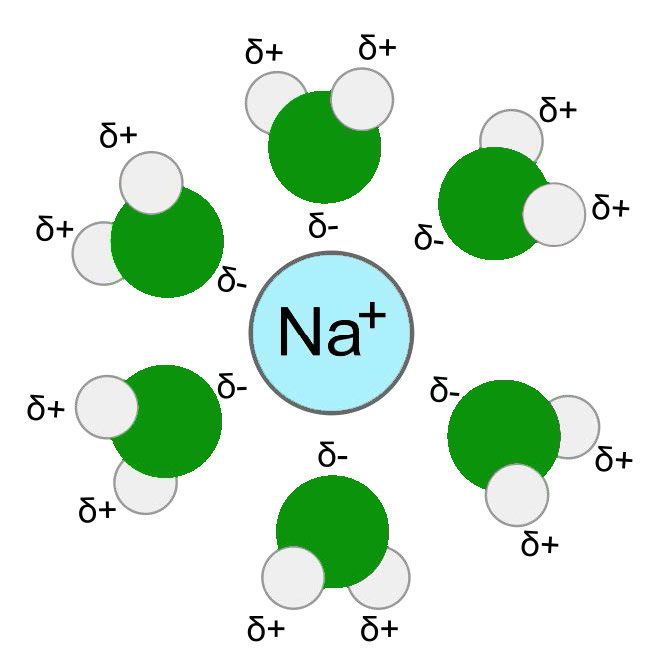
Concha de hidratación
Para entender esta selectividad única, es importante entender cómo los iones se mueven a través de los canales. Antes de que un ion pueda pasar por un canal, primero debe disociarse de (despojarse de) las moléculas de agua en su capa de hidratación, moléculas de agua que rodean los iones en soluciones acuosas (Figura 3.32). Este proceso requiere un aporte de energía. La energía inicial requerida para separar las moléculas de agua de la capa de hidratación se ha comparado con la energía de activación de una reacción enzimática.
Comparable a las enzimas
Así como las enzimas reducen la energía de activación de las reacciones enzimáticas y así permiten que ocurran más fácilmente, también las proteínas de canal disminuyen los requisitos de energía para que una molécula atraviese una bicapa lipídica. En ausencia de la proteína del canal, la energía de deshidratación es en su mayoría prohibitiva para que ocurra la mayoría de las moléculas polares, por lo que muy pocas la hacen a través de la bicapa lipídica sin la proteína del canal. Es por ello que las proteínas de canal iónico/transporte son tan importantes para la célula.
Después de que el agua ha sido despojada, el ion puede pasar por el canal y cuando llega al otro lado del canal, el ion difuso se rehidrata, recuperando así la energía que inicialmente se requería para eliminar las moléculas de agua del ion.
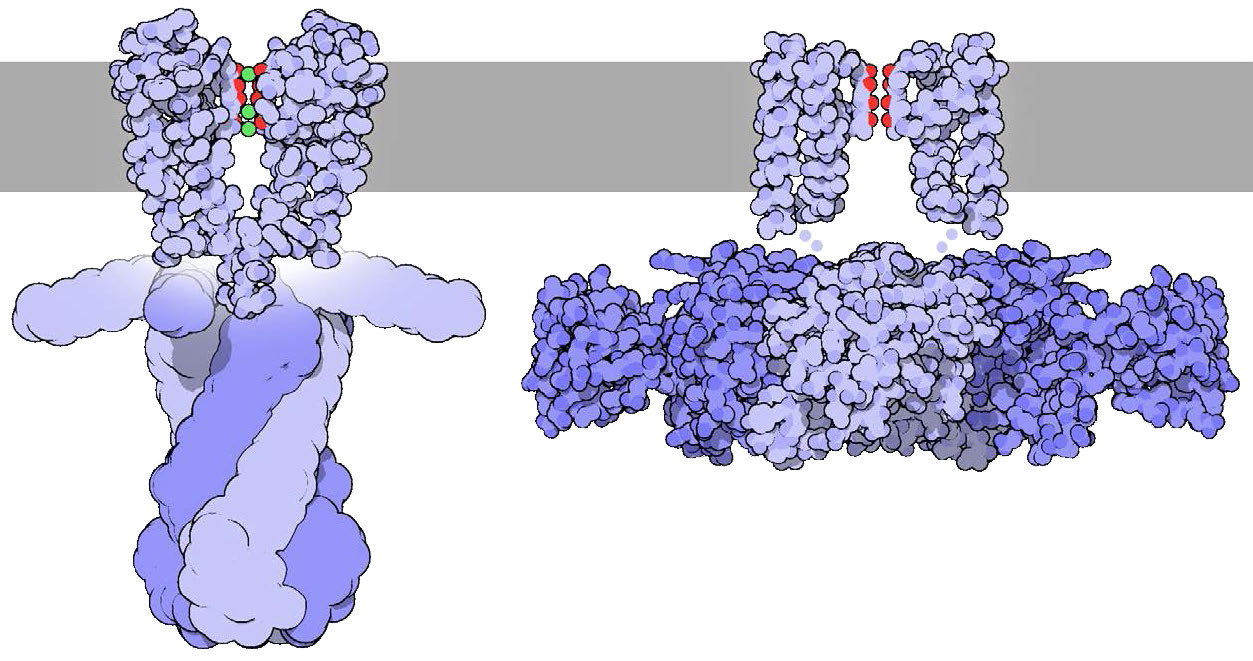
Selectividad del canal de potasio
El canal de potasio (Figura 3.33) utiliza las dimensiones del ion potasio precisamente para pastorearlo a través del canal. El ion sodio, que tiene diferentes dimensiones, tiene un momento más difícil al hacerlo a través del canal a pesar de su menor tamaño. La razón por la que esto está enraizado en la energía requerida para la deshidratación.
Para los iones de potasio, una vez que el agua ha sido eliminada, los grupos carbonilo posicionados con precisión a lo largo del canal ayudan a estabilizar el ion a medida que se mueve. El ion sodio, por otro lado, es demasiado pequeño y no hace conexiones eficientes con grupos carbonilo y por lo tanto tiene un camino más difícil. Debido a esto, la diferencia de energía entre la deshidratación y la rehidratación de un ion sodio en un canal de potasio es energéticamente desfavorable (requiere aporte neto de energía) pero el mismo proceso para un ion potasio es energéticamente favorable (da como resultado una ganancia neta de energía).
Película 3.1 - Gramicidina A Wikipedia (gif animado, descargar para ver)
Factor energético
Así, la selección a favor del potasio y contra los iones de sodio en un canal de potasio se basa en la energía, no en el tamaño físico, mientras que en la selección de iones sodio sobre iones de potasio en un canal de sodio, el tamaño es la consideración principal.
Balance de iones
El movimiento de iones a través de una bicapa lipídica está estrechamente regulado, y con buena razón. Mantener un equilibrio adecuado de iones dentro y fuera de las células es importante para mantener el equilibrio osmótico. También es importante dentro y fuera de orgánulos como las mitocondrias y cloroplastos para la generación de energía. Si el equilibrio iónico de una célula está suficientemente perturbado por un ionóforo incontrolado, una célula puede morir.
Gramicidina
Las gramicidinas (Película 3.1) son polipéptidos antibióticos sintetizados por la bacteria del suelo conocida como Bacillus brevis. Estos pequeños pentadecapéptidos (15 aminoácidos) son sintetizados por la bacteria para matar a otras bacterias.
Cuando son liberadas por el Bacillus brevis, las gramicidinas se insertan en las membranas de bacterias Gram positivas y permiten el movimiento de iones de sodio hacia las células diana, finalmente matándolas. Las gramicidinas también pueden causar hemólisis en humanos por lo que no pueden usarse internamente, sino que se usan tópicamente.
Acuaporinas
Las acuaporinas son proteínas integrales de membrana que contienen poros que permiten selectivamente el paso de moléculas de agua dentro y fuera de la célula, al tiempo que evitan que los iones y otros solutos se muevan (Figuras 3.34 y 3.35). Algunas acuaporinas llamadas acuagliceroporinas, también transportan otras pequeñas entidades sin carga, como glicerol, amoníaco, urea y CO2, a través de la membrana,. Los poros del agua son completamente impermeables a las moléculas cargadas, como los protones, lo cual es importante para preservar la diferencia de potencial electroquímico de la membrana.
Porinos
Las porinas son proteínas que contienen una estructura β-barril que cruza la membrana/pared celular y actúa como un poro/canal a través del cual se difunden moléculas específicas. Las porinas se encuentran en la membrana externa de bacterias Gram-negativas y algunas bacterias Gram-positivas, mitocondrias y cloroplastos.
Las porinas normalmente transportan solo un grupo de moléculas o, en algunos casos, una molécula específica. Los antibióticos, como la β-lactama y la fluoroquinolona, pasan a través de las porinas para alcanzar el citosol de bacterias Gram negativas. Las bacterias pueden desarrollar resistencia a estos antibióticos cuando se produce una mutación en la porina involucrada que resulta en la exclusión de los antibióticos que de otro modo pasarían.
Proteínas transportadoras
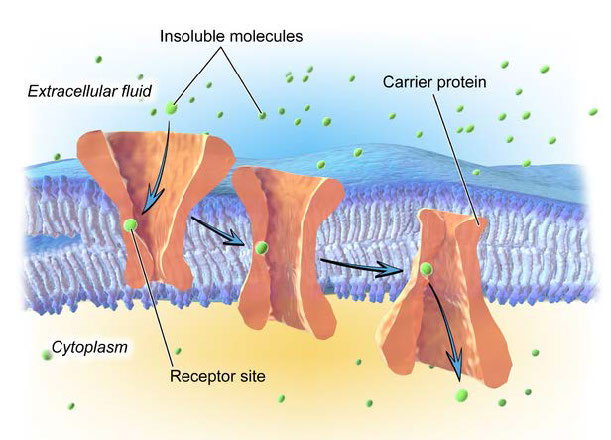
No todo el transporte facilitado ocurre a través de proteínas de canales iónicos. Las proteínas transportadoras, como se señaló anteriormente (HERE y Figura 3.27) facilitan el movimiento de materiales a través de una bicapa lipídica, pero son más lentas que los canales iónicos. La Figura 3.36 ilustra una proteína transportadora en acción. Como puede verse, las proteínas transportadoras se basan en un sitio receptor específico para el reconocimiento adecuado de la molécula a mover.
La unión de la molécula apropiada provoca un cambio conformacional en la forma de la proteína (una eversión) que resulta en un volteo del lado abierto de la proteína al otro lado de la bicapa lipídica. De esta manera, se mueve la molécula. Al igual que los canales iónicos, las proteínas transportadoras facilitan el movimiento de los materiales en cualquier dirección, impulsadas solo por la diferencia de concentración entre un lado y otro.
Transporte activo
Todos los mecanismos de transporte descritos hasta ahora son impulsados únicamente por un gradiente de concentración, moviéndose desde concentraciones más altas en dirección a concentraciones más bajas. Estos movimientos pueden ocurrir en cualquier dirección y, como se señaló, dar como resultado concentraciones iguales a ambos lados de la bicapa, si se permite que vayan a su finalización. Muchas veces, sin embargo, las células deben mover materiales contra un gradiente de concentración y cuando esto ocurre, se requiere otra fuente de energía. Este proceso se conoce como transporte activo.
Una buena definición de transporte activo es que en el transporte activo, al menos una molécula se mueve contra un gradiente de concentración. Una fuente de energía común, pero no exclusiva, es ATP (ver Na+/K+ ATPasa), pero también se emplean otras fuentes de energía. Por ejemplo, el transportador de sodio-glucosa utiliza un gradiente de sodio como fuerza para transportar activamente la glucosa a una célula. Por lo tanto, es importante saber que no todo el transporte activo utiliza energía ATP.
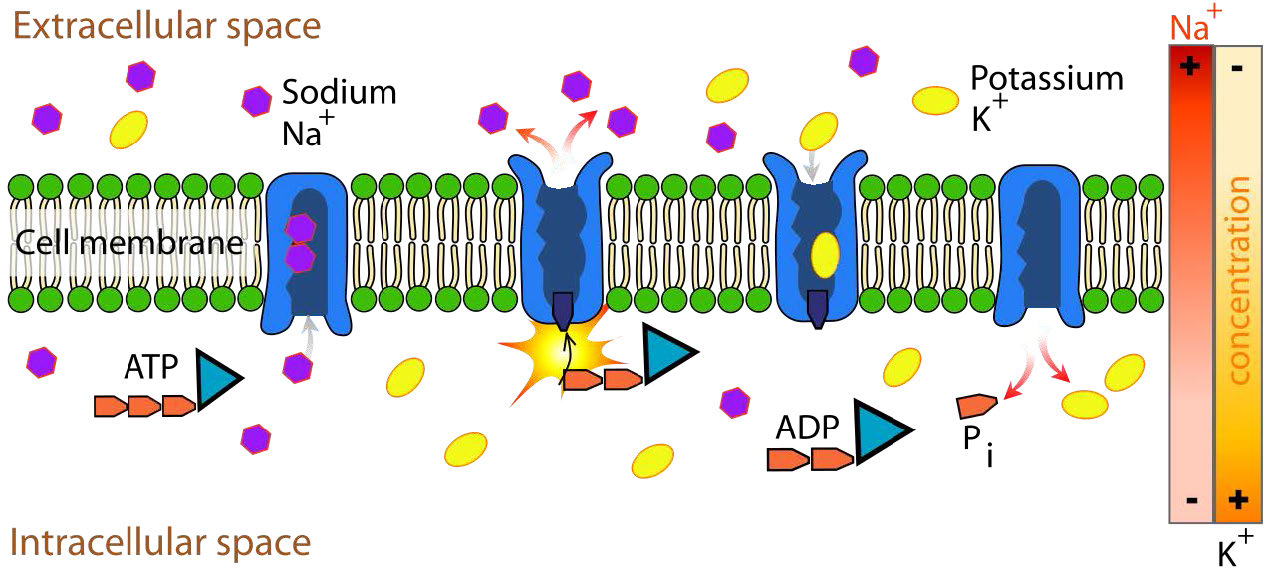
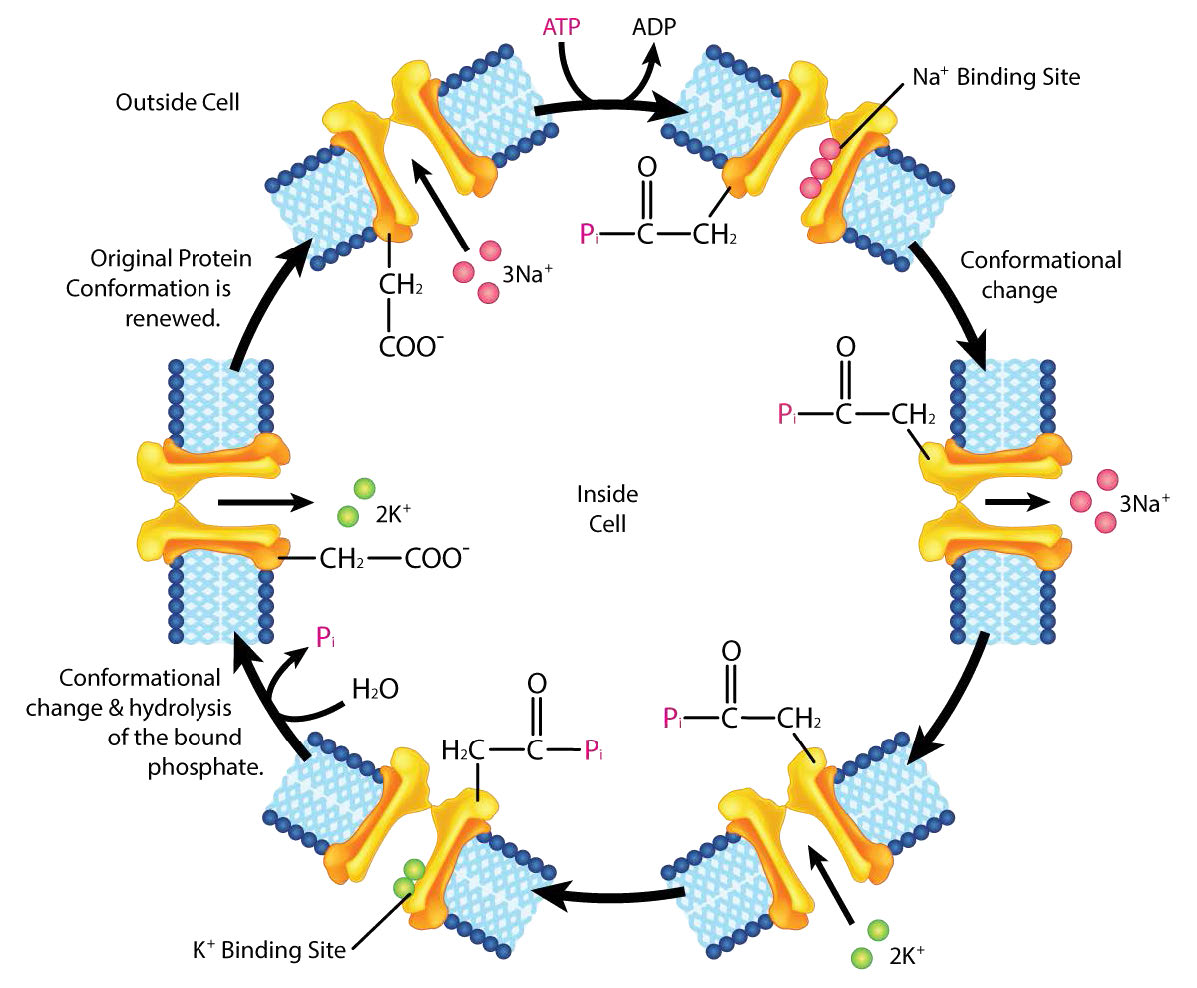
Na+/K+ ATPasa
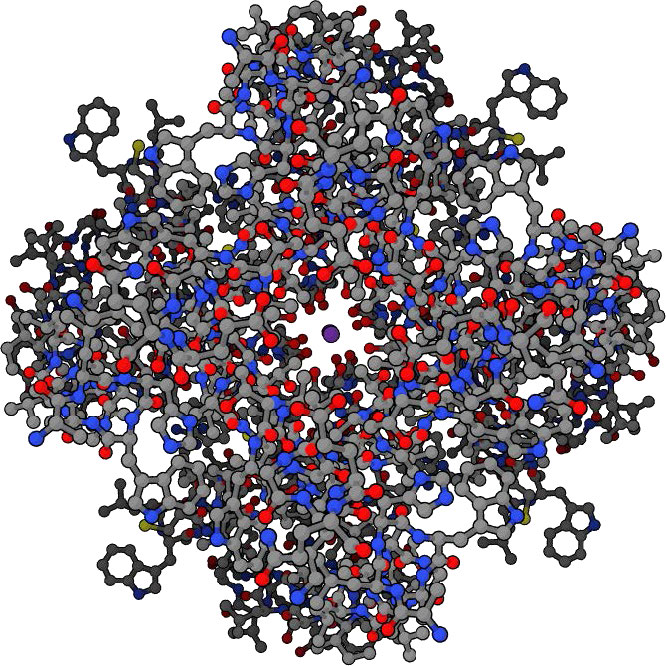
Una importante proteína de transporte de membrana integral es el antipuerto Na+/K+ ATPasa (Figuras 3.37 y 3.38), que mueve tres iones de sodio fuera de la célula y dos iones de potasio a la célula con cada ciclo de acción. En cada caso, el movimiento de los iones es contra el gradiente de concentración. Dado que se mueven tres cargas positivas por cada dos cargas positivas que ingresan, el sistema es electrogénico.
La proteína utiliza la energía del ATP para crear gradientes iónicos que son importantes tanto para mantener la presión osmótica celular como (en las células nerviosas) para crear los gradientes de sodio y potasio necesarios para la transmisión de la señal. La falla del sistema para funcionar da como resultado la hinchazón de la célula debido al movimiento del agua hacia la célula a través de la presión osmótica. El transportador gasta aproximadamente una quinta parte de la energía ATP de las células animales. El ciclo de acción ocurre de la siguiente manera:
- La bomba se une al ATP seguido de la unión de 3 iones Na+ del citoplasma de la célula
- La hidrólisis de ATP da como resultado la fosforilación del residuo de aspartato de la bomba. Se libera ADP
- La bomba fosforilada experimenta un cambio conformacional para exponer los iones Na+ al exterior de la célula. Se liberan iones Na+.
- La bomba une 2 iones extracelulares K+.
- La bomba desfosforila causando que exponga los iones K+ al citoplasma a medida que la bomba vuelve a su forma original.
- La bomba une 3 iones Na+, une ATP y libera 2 iones K+ para reiniciar el proceso
La ATPasa Na+/K+ se clasifica como ATPasa de tipo P. Esta categoría de bomba es notable por tener un intermedio de aspartato fosforilado y está presente en todos los reinos biológicos: bacterias, arqueos y eucariotas.
Tipos de ATPasa
Las ATPasas tienen papeles en la síntesis o hidrólisis de ATP y vienen en varias formas diferentes.
- Las F-ATPasas (F1FO-ATPasas) están presentes en mitocondrias, cloroplastos y membranas plasmáticas bacterianas y son los principales sintetizadores de ATP para estos sistemas. Cada uno utiliza un gradiente de protones como fuente de energía para la producción de ATP. El complejo V de la mitocondria es una ATPasa tipo F.
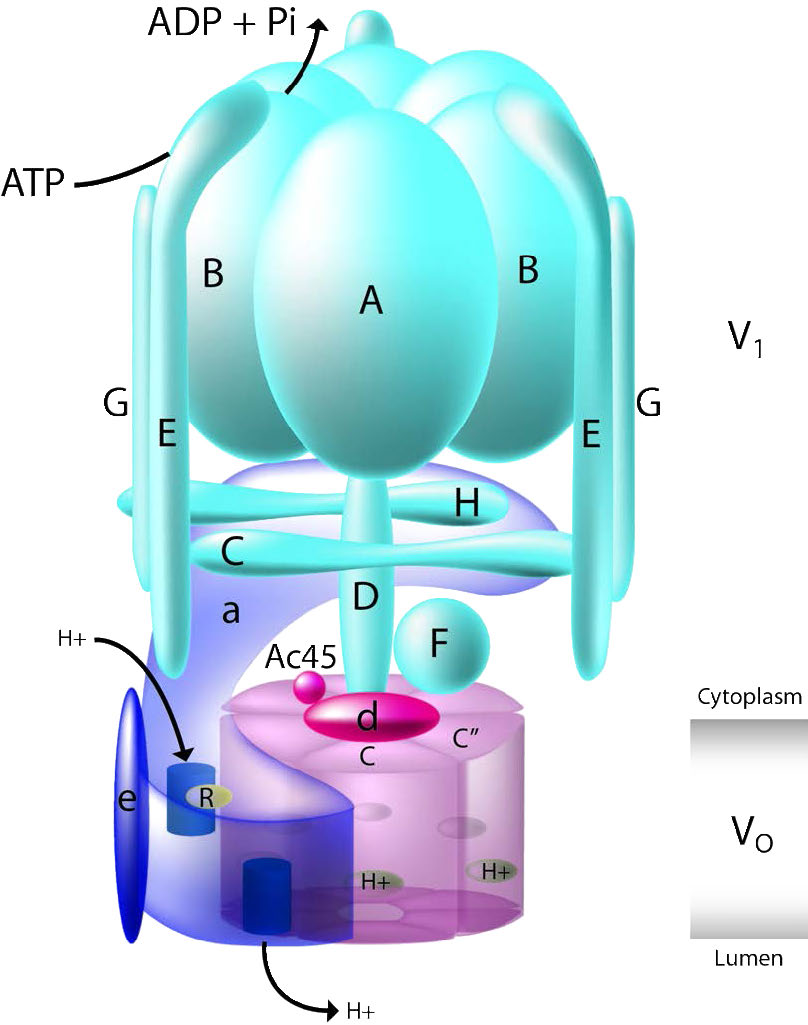
- Las V-ATPasas (V1vo-ATPasas) se encuentran principalmente en vacuolas de eucariotas. Utilizan energía de la hidrólisis de ATP para transportar solutos y protones a vacuolas y lisosomas, disminuyendo así sus valores de pH.
Las ATPasas tipo V y F son muy similares en estructura. El tipo V (Figura 3.39) utiliza ATP para bombear protones en vacuolas y lisosomas, mientras que los tipos F utilizan gradientes de protones de las mitocondrias y cloroplastos para producir ATP.
- Las a-ATPasas (A1AO-ATPasas) se encuentran en los arqueos y son similares a las F-ATPasas en función.
- Las P-ATPasas (E1E2-ATPasas) se encuentran en bacterias, hongos y en membranas plasmáticas eucariotas y orgánulos. Transportan una diversidad de iones a través de membranas. Cada uno tiene un mecanismo de acción común que incluye la autofosforilación de una cadena lateral de ácido aspártico conservada dentro de ella. Los ejemplos de ATPasas de tipo P incluyen la ATPasa Na+/K+ y la bomba de calcio.
- Las E-ATPasas son enzimas que se encuentran en la superficie celular. Hidrolizan una gama de nucleósidos trifosfatos extracelulares, incluyendo ATP.
Transmisión nerviosa
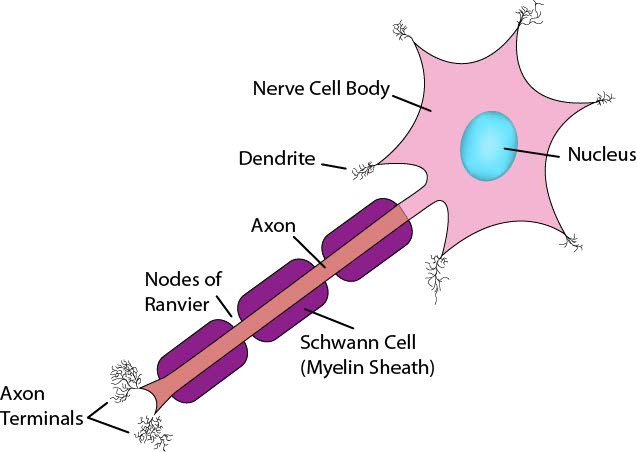
Ahora que ya has visto cómo funciona la Na+/K+ ATPasa, es apropiado discutir cómo las células nerviosas utilizan gradientes iónicos creados con ella para generar y transmitir señales nerviosas. Las neuronas son células del sistema nervioso que utilizan señales químicas y eléctricas para transmitir rápidamente información a través del cuerpo (Figura 3.40). El sistema nervioso sensorial vincula los receptores para la visión, el oído, el tacto, el gusto y el olfato con el cerebro para la percepción. Las neuronas motoras van desde la médula espinal hasta las células musculares. Estas neuronas tienen un cuerpo celular y una extensión muy larga y delgada llamada axón, que se extiende desde el cuerpo celular en la médula espinal hasta los músculos que controlan. Los impulsos nerviosos viajan por el axón para estimular la contracción muscular.
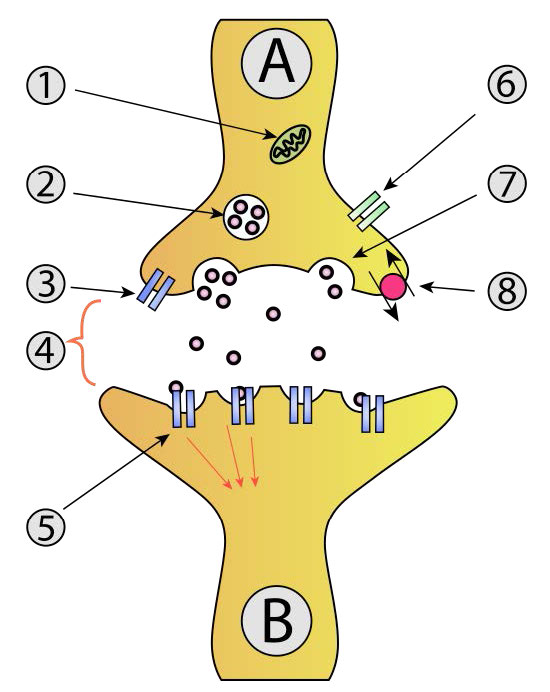
Las señales viajan a través de las neuronas, llegando finalmente a uniones con otras células nerviosas o células diana como las células musculares. Tenga en cuenta que las neuronas no hacen contacto físico entre sí ni con las células musculares. El pequeño espacio entre dos neuronas o entre una neurona y una célula muscular se llama hendidura sináptica. En la hendidura sináptica, la neurona libera neurotransmisores que salen de la célula nerviosa y viajan a través de la unión a una célula receptora donde se genera una respuesta. Esa respuesta puede estar creando otra señal nerviosa, si la célula adyacente es una célula nerviosa o puede ser una contracción muscular si el receptor es una célula muscular (Figura 3.41).
Al considerar el movimiento de información a través de las células nerviosas, entonces, discutiremos dos pasos: 1) creación y propagación de una señal en una célula nerviosa y 2) acción de neurotransmisores que salen de una célula nerviosa y transitan por una unión sináptica.
Fuente de señal
La creación de una señal nerviosa comienza con un estímulo a la célula nerviosa. En el caso de la contracción muscular, la corteza motora del cerebro envía señales a las neuronas motoras apropiadas, estimulándolas para generar un impulso nervioso. ¿Cómo se genera tal impulso?
Potencial de descanso
En el estado no estimulado, todas las células, incluidas las células nerviosas, tienen una pequeña diferencia de voltaje (llamada potencial de reposo) a través de la membrana plasmática, que surge del bombeo desigual de iones a través de la membrana. La Na+/K+ ATPasa, por ejemplo, bombea iones de sodio fuera de la célula e iones de potasio a las células. Dado que tres iones de sodio se bombean por cada dos iones de potasio bombeados, se crea un gradiente de carga y químico. Es el gradiente de carga el que da lugar al potencial de reposo.
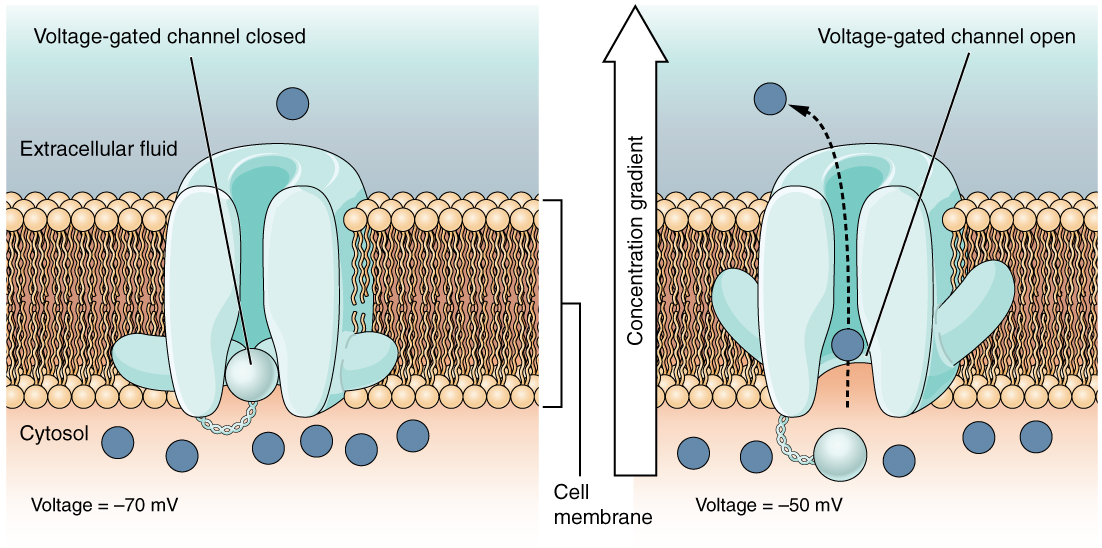
La alteración de los gradientes de iones a través de las membranas proporciona la fuerza impulsora para las señales nerviosas. Esto sucede como resultado de la apertura y cierre de canales iónicos cerrados. La apertura de puertas para permitir que los iones pasen a través de la membrana cambia rápidamente el equilibrio iónico a través de la membrana, lo que resulta en una nueva diferencia de voltaje llamada potencial de acción. Es el potencial de acción el que es el ímpetu de la transmisión nerviosa.
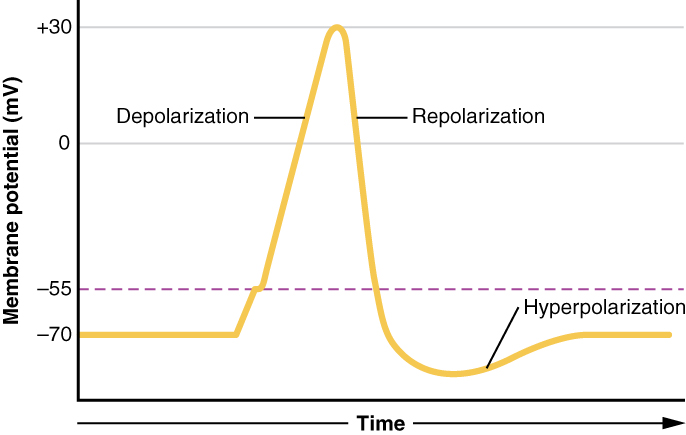
Iniciación de la señal
La señal generada por una neurona motora comienza con la apertura de canales de sodio en la membrana del cuerpo de la célula nerviosa provocando una rápida afluencia de iones de sodio a la célula nerviosa. Este paso, llamado despolarización (Figura 3.42), desencadena una señal electroquímica, el potencial de acción. Recuerde que la Na+/K+ ATPasa ha creado un gran gradiente de sodio, por lo que los iones de sodio se precipitan hacia la célula cuando los canales de sodio se abren. Después de la despolarización inicial, las puertas de los canales de potasio, que responden a la despolarización, se abren, permitiendo que los iones de potasio se difundan rápidamente fuera de la célula (recuerde que los iones K+ son más abundantes dentro de la célula). Esta fase se llama fase de repolarización y durante ella, se cierran las compuertas de sodio.
La rápida salida de iones de potasio hace que la diferencia de voltaje “sobrepase” el potencial de reposo y las puertas de potasio se cierren. Esto seguido por el llamado período refractario, cuando la Na+/K+ ATPasa comienza su trabajo para restablecer las condiciones originales bombeando iones de sodio e iones de potasio hacia la célula nerviosa. Finalmente, el sistema se recupera y se restablecerá el potencial de reposo. El extremo de inicio de la célula nerviosa está entonces listo para otra señal.
Propagación del potencial de acción
Lo que aquí hemos descrito es solo el inicio de la señal nerviosa en una parte de la célula nerviosa. Para que se reciba la señal, el potencial de acción debe recorrer toda la longitud de la célula nerviosa (el axón) y provocar que se libere una señal química en la hendidura sináptica para llegar a su objetivo. La propagación de la señal nerviosa (potencial de acción) en la célula nerviosa original es la función de todos los demás canales iónicos controlados (Figura 3.43) colocados a los lados de la célula nerviosa. Las compuertas de sodio y potasio involucradas en la propagación de la señal actúan en respuesta a los cambios de voltaje creados por el gradiente electroquímico que se mueve hacia abajo por la célula nerviosa (Figura 3.44). Recuerde que la apertura de las compuertas iniciales al inicio de la señal creó una afluencia de iones de sodio y un eflujo de iones de potasio.
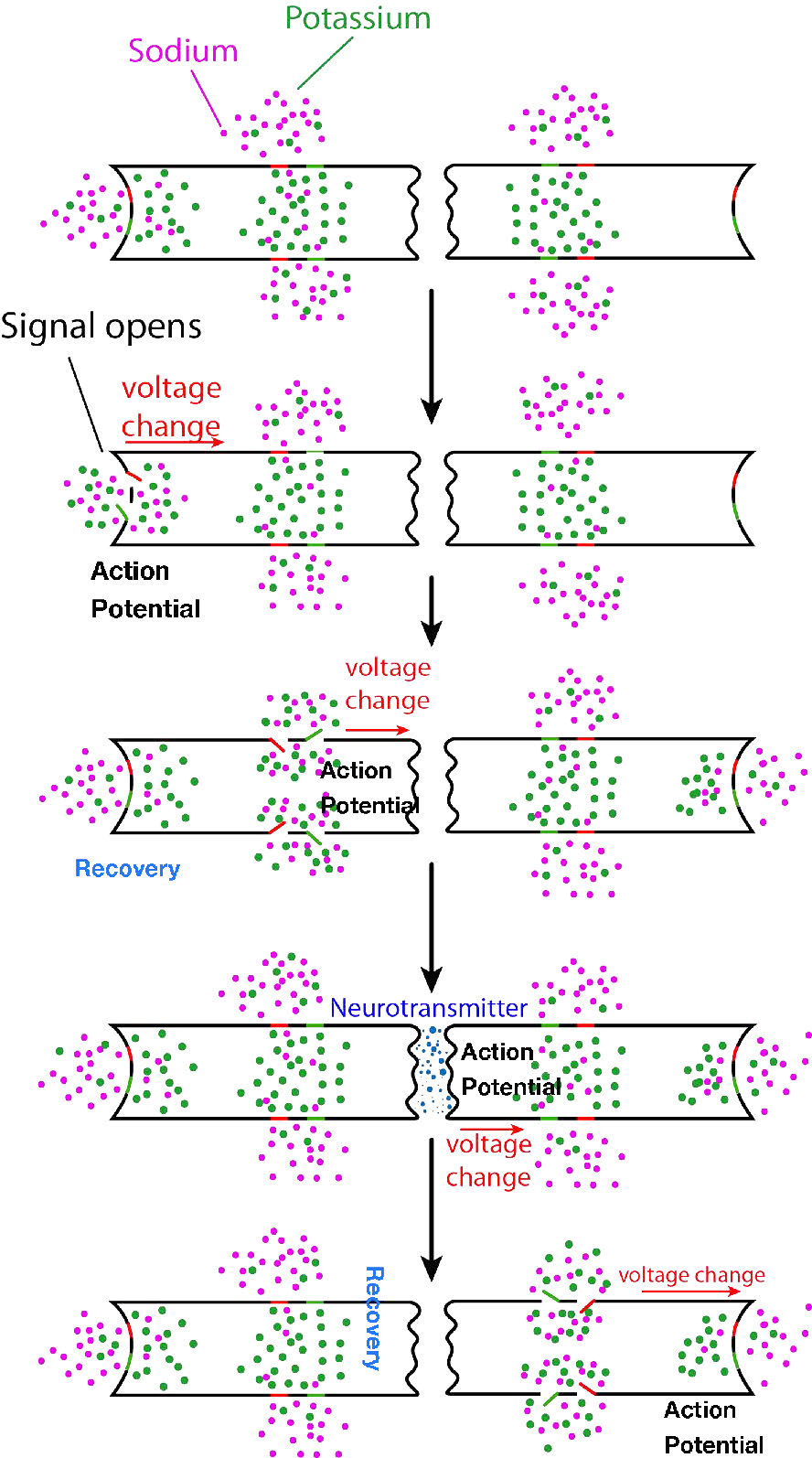
Señal móvil
Este cambio químico y eléctrico que crea el potencial de acción deja el extremo de la célula nerviosa donde comenzó y viaja por el axón hacia el otro extremo de la célula nerviosa. En el camino, encuentra más canales cerrados de sodio y potasio. En cada caso, estos responden simplemente al cambio de voltaje del potencial de acción y se abren y cierran, exactamente de la misma manera que las puertas se abrieron para iniciar la señal. Así, una onda rápida de iones de sodio crecientes e iones de potasio decrecientes se mueve a lo largo de la célula nerviosa, propagada (y amplificada) por puertas que se abren y cierran a medida que los iones y cargas se mueven hacia abajo por la célula nerviosa Finalmente, la onda de marea iónica alcanza el extremo de la célula nerviosa (axón terminal) frente a la hendidura sináptica.
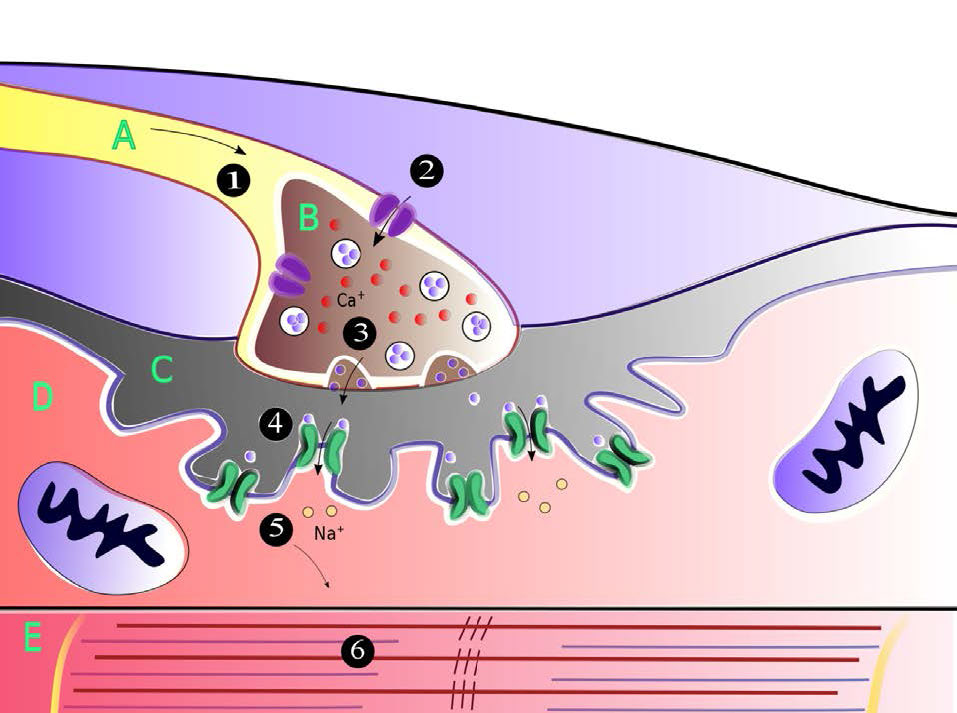
Cruzando la hendidura sináptica
Para que la señal sea recibida por la diana pretendida (célula postsináptica) de la neurona originaria (neurona presináptica), debe cruzar la hendidura sináptica y estimular la célula vecina (Figura 3.45). Comunicar información a través de una hendidura sináptica es el trabajo de los neurotransmisores. Se trata de pequeñas moléculas sintetizadas en células nerviosas que se empaquetan en vesículas de membrana llamadas vesículas sinápticas en la célula nerviosa. Los neurotransmisores vienen en todas las formas y formas químicas, desde pequeños químicos como la acetilcolina hasta péptidos como el neuropéptido Y. El neurotransmisor más abundante es el glutamato, que actúa en más del 90% de las sinapsis en el cerebro humano.
Película 3.2 - Movimiento de un potencial de acción por una célula nerviosa - Wikipedia, la enciclopedia libre
En la hendidura
A medida que el potencial de acción en la neurona presináptica se acerca al extremo axón, las vesículas sinápticas comienzan a fusionarse con la membrana y su contenido de neurotransmisores se derrama en la hendidura sináptica. Una vez en la hendidura, los neurotransmisores se difunden, algunos de ellos alcanzando receptores en la célula postsináptica. La unión del neurotransmisor a los receptores en la membrana de la célula postsináptica estimula una respuesta.
Para las neuronas motoras, la célula postsináptica será una célula muscular, y la respuesta será la contracción/relajación muscular. En este punto, la célula nerviosa originaria ha hecho su trabajo y comunicado su información a su objetivo inmediato. Si la célula postsináptica es una célula nerviosa, el proceso se repite en esa célula hasta llegar a su destino.
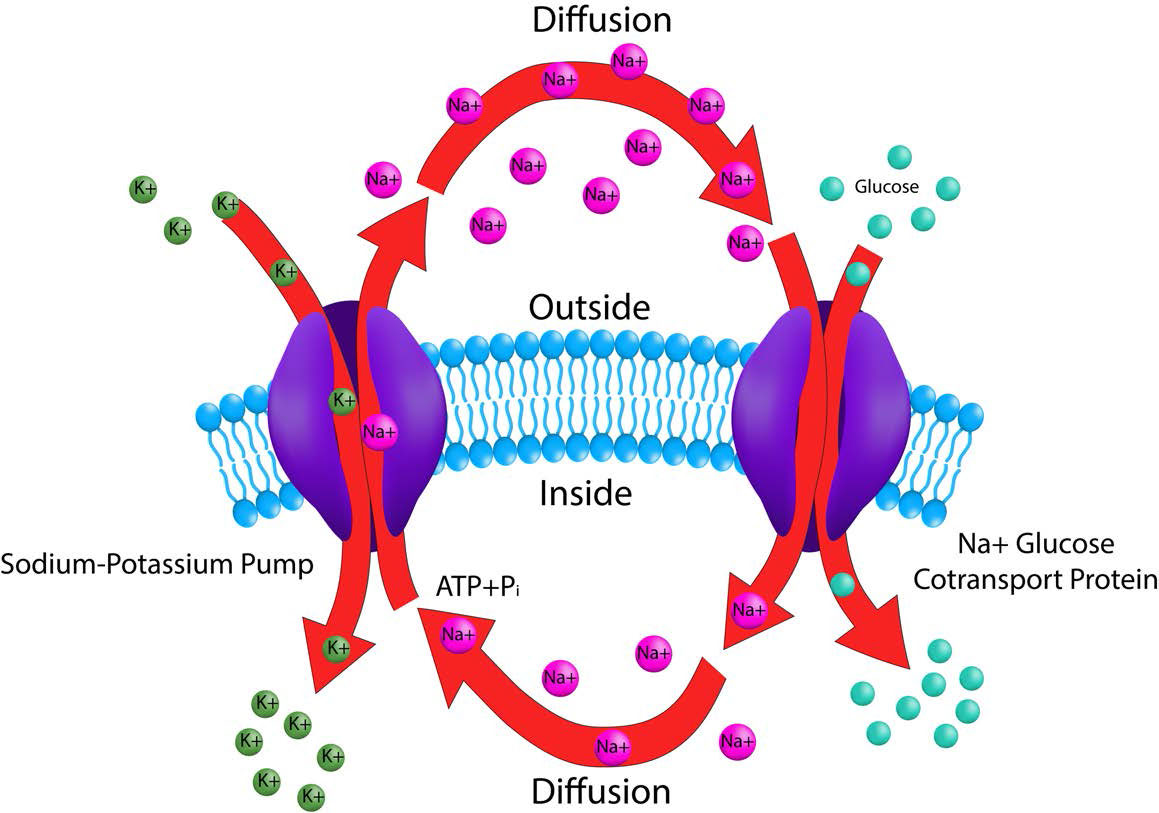
Transportador de Na+/glucosa
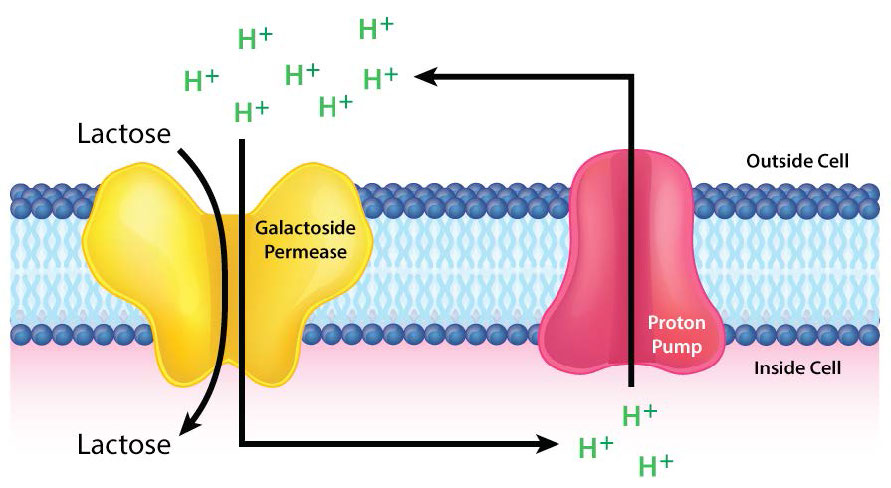
La absorción de nutrientes del sistema digestivo es necesaria para la vida animal. La proteína de transporte de sodio/glucosa es un simportador electrogénico que mueve la glucosa hacia las células intestinales. Se encuentra en la mucosa intestinal y el túbulo proximal de la nefrona del riñón. El sistema de transporte de sodio/glucosa funciona en este último para promover la reabsorción de glucosa.
La bomba funciona en conjunto con el sistema de transporte Na+/K+. El gradiente de iones de sodio acumulado por la bomba de Na+/K+ se utiliza como fuente de energía para impulsar el movimiento de la glucosa hacia las células (ver Figura 3.38). El uso de un gradiente iónico establecido por una bomba separada se conoce como transporte activo secundario. Para la mucosa intestinal, la bomba transporta glucosa fuera del intestino y hacia las células intestinales. Posteriormente, la glucosa se exporta fuera del otro lado de las células intestinales al espacio intersticial para su uso en el cuerpo.
Bombas de calcio
Los iones de calcio son necesarios para la contracción muscular y desempeñan papeles importantes como moléculas de señalización dentro de las células. Además, cuando las concentraciones de calcio suben demasiado altas, el ADN en los cromosomas puede precipitar. Por tanto, la concentración de calcio en las células se maneja cuidadosamente. Se mantiene muy bajo en el citoplasma como resultado de la acción de las bombas, tanto en la membrana plasmática, que bombean calcio hacia afuera desde el citoplasma como en orgánulos, como el retículo endoplásmico (retículo sarcoplásmico de células musculares), que bombean calcio fuera del citoplasma y hacia estos orgánulos.
La apertura de los canales de calcio, entonces, aumenta la concentración de calcio rápidamente en el citoplasma dando como resultado una respuesta rápida, ya sea que la intención sea la señalización o la contracción de un músculo. Después de que se genera la respuesta, el calcio es bombeado de nuevo fuera del citoplasma por las respectivas bombas de calcio.
Algunas bombas de calcio usan ATP como fuente de energía para mover el calcio y otras usan gradientes de iones, como el sodio para el mismo propósito.
Transportador Na+/Ca++
Una bomba de calcio de interés utiliza el gradiente de sodio como fuente de energía. Es la bomba de sodio/calcio. Este sistema antipuerto electrogénico utiliza el movimiento del sodio hacia la celda como una fuerza impulsora para sacar el calcio de la celda, aunque su dirección puede revertirse en algunas circunstancias. La bomba es un sistema de alta capacidad para mover mucho calcio rápidamente, moviendo hasta 5000 iones de calcio por segundo y se encuentra en muchos tejidos con muchas funciones.
Digitalis
Una función importante de la bomba de Na+/Ca++ ocurre en las células cardíacas. El Ca++ es importante para la contracción del músculo cardíaco. El eflujo de calcio de las células es el funcionamiento normal de la bomba, sin embargo, durante la carrera ascendente del ciclo, hay un gran movimiento de iones de sodio hacia la célula cardíaca. Cuando esto ocurre, la bomba se invierte y bombea Na+ hacia fuera y Ca++ brevemente. Dado que el calcio ayuda a estimular la contracción del músculo cardíaco, esto puede ayudar a que el corazón lata más fuerte y es el foco del uso de la digital para tratar la insuficiencia cardíaca congestiva.
Digitalis bloquea la ATPasa sodio-potasio e interfiere con el gradiente de iones sodio. Como se señaló anteriormente, cuando el gradiente de Na+ se orienta en la dirección equivocada, se bombea calcio. Por lo tanto, la digitalis se usa para tratar la insuficiencia cardíaca congestiva porque aumenta la concentración de calcio en las células cardíacas, favoreciendo latidos más contundentes.
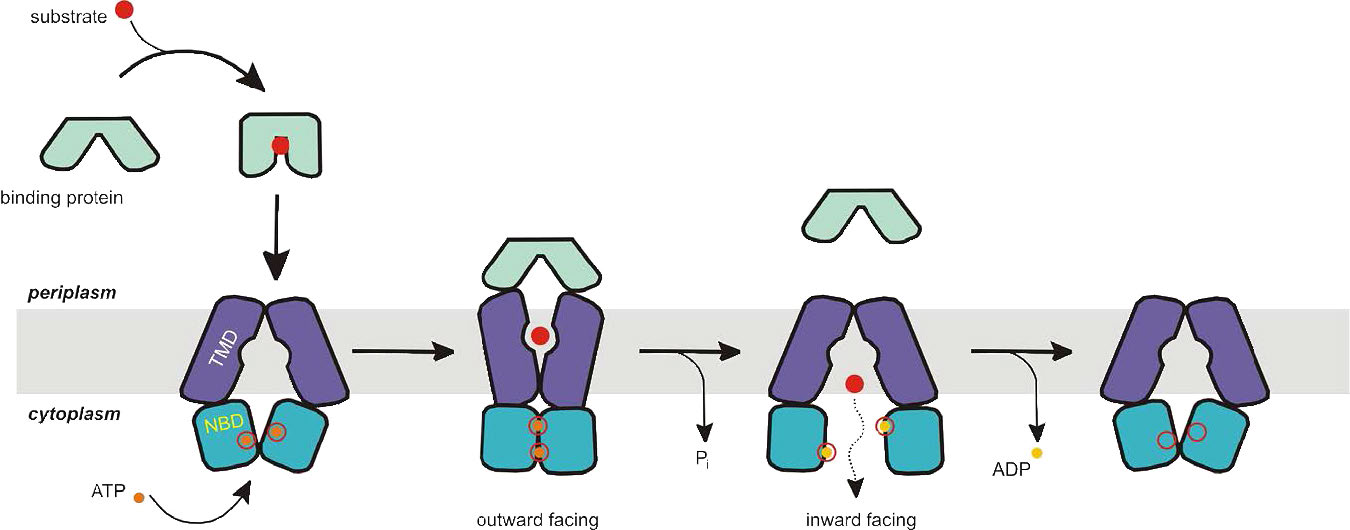
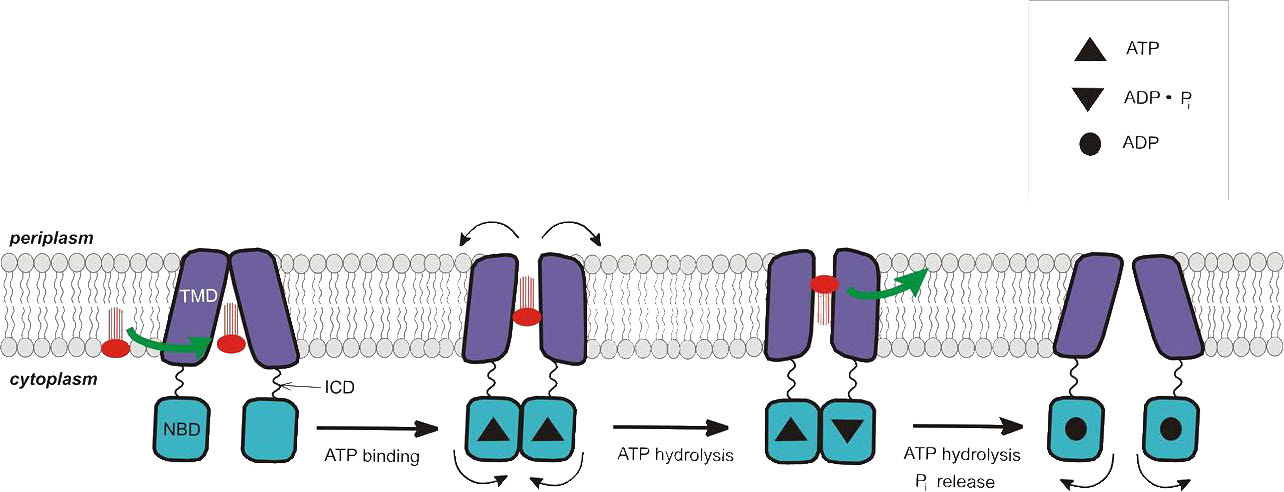
Transportadores ABC
Los transportadores ABC son otra clase de proteínas transmembrana que utilizan energía ATP para transportar cosas contra gradientes de concentración (Figuras 3.47 y 3.48). Esta superfamilia de proteínas incluye cientos de proteínas (48 solo en humanos) y abarca todos los filos existentes desde procariotas hasta humanos. Estas proteínas funcionan no sólo en el transporte de membrana, sino también en procesos que incluyen la reparación del ADN y el proceso de traducción.
Transporte
Las sustancias que los transportadores ABC mueven a través de las membranas incluyen productos metabólicos, lípidos, esteroles y drogas. Los transportadores ABC funcionan en la resistencia a múltiples fármacos de muchas células, y proporcionan resistencia a antibióticos en bacterias así como resistencia a la quimioterapia en células superiores mediante la exportación de medicamentos utilizados para tratar ambos tipos de células.
Los transportadores ABC se dividen en tres grupos principales: 1) importadores (solo procariotas); 2) exportadores (procariotas y eucariotas) y 3) no transportadores con roles en la reparación y traducción del ADN. Todas las proteínas transportadoras ABC tienen cuatro dominios proteicos, dos citoplásmicos y dos unidos a membrana. Están alternativamente abiertos a las regiones citoplásmicas o extracelulares (o periplásmicas) y esto es controlado por hidrólisis de ATP.
Enfermedad
Los transportadores ABC tienen papeles en la fibrosis quística y otras enfermedades humanas heredadas. Están muy involucrados en el desarrollo de resistencia a múltiples fármacos por un grupo diverso de células. Los transportadores ABC proporcionan resistencia a múltiples fármacos al expulsar fármaco (s) de las células. La proteína ABCB1, por ejemplo, bombea medicamentos para la supresión de tumores fuera de la célula. Otro transportador ABC conocido como Pgp transporta compuestos orgánicos catiónicos o neutros.
Fibrosis quística
La fibrosis quística (FQ) es un trastorno genético autosómico recesivo que surge de mutaciones en ambas copias del gen para la proteína reguladora de la conductancia transmembrana de la fibrosis quística (CFTR). Este sistema transportador ABC, que mueve iones cloruro y tiocianato a través de las membranas del tejido epitelial ejerce su efecto principalmente en los pulmones pero el páncreas, el hígado, los riñones y el intestino también se ven afectados por él.
Función
CFTR tiene papeles en la producción de sudor, moco y fluidos digestivos. Las manifestaciones de la enfermedad incluyen dificultad respiratoria y sobreproducción de moco en los pulmones. Cuando CFTR es funcional, estos fluidos son normalmente delgados, pero cuando el gen no es funcional, se vuelven mucho más gruesos y son puntos de infección.
CFTR contiene dos dominios hidrolizantes de ATP y dos dominios de cruce de membrana celular con 6 hélices α cada uno. Se puede activar por fosforilación por una proteína quinasa dependiente de AMPc. El extremo carboxilo del CFTR está unido al citoesqueleto por un dominio PDZ.
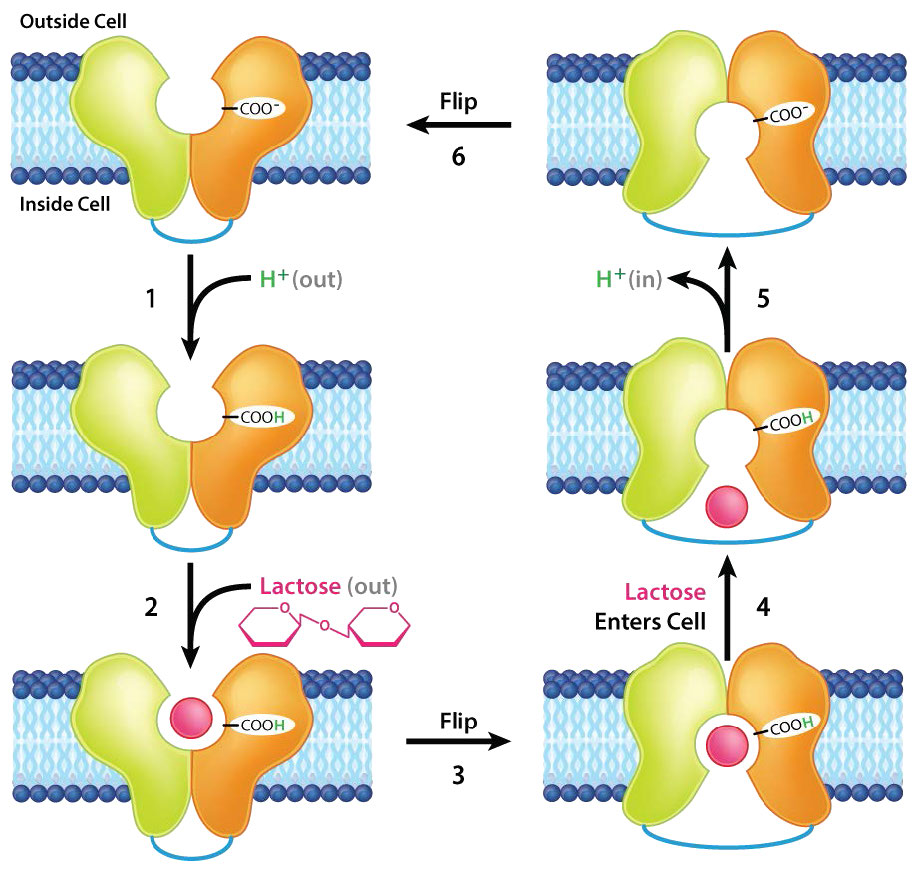
Permeasa de lactosa
Otra proteína integral de membrana que realiza el transporte activo es la lactosa permeasa. Facilita el movimiento de la lactosa de azúcar a través de la bicapa lipídica de la membrana celular (Figuras 3.49- 3.51). El mecanismo de transporte se clasifica como un transporte activo secundario ya que explota el gradiente electroquímico H+ dirigido hacia adentro como fuente de energía. Cuando la lactosa se transporta a las células, se descompone en sus azúcares monosacáridos sustituyentes -glucosa y galactosa- para la creación de energía.
La enzima que cataliza esta reacción se conoce como lactasa y la deficiencia de la misma en humanos conduce a la intolerancia a la lactosa (ver AQUÍ).
GLUTs
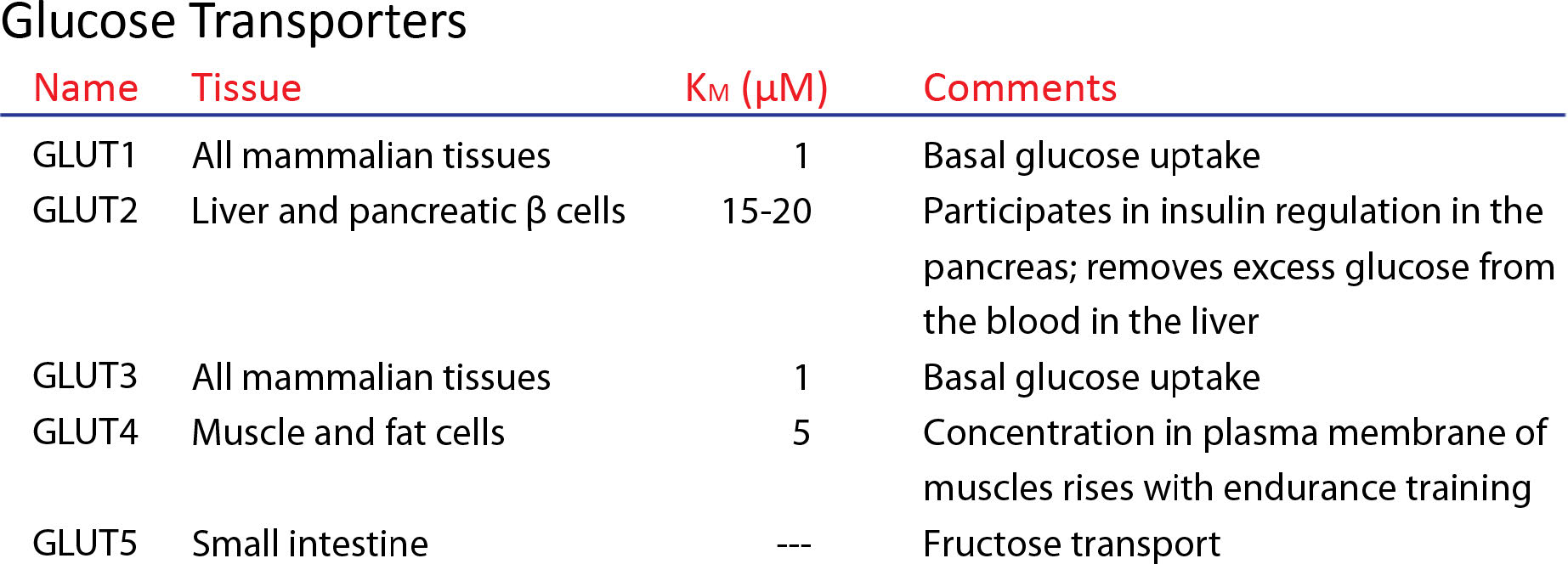
Las GLUTs (proteínas de transporte de glucosa) son proteínas integrales de membrana uniport tipo III que participan en el transporte de glucosa a través de las membranas hacia las células. Los GLUT se encuentran en todos los filos y son abundantes en humanos, con 12 genes GLUT. GLUT1, en eritrocitos está bien estudiado. A través de GLUT 1, la glucosa ingresa y pasa a través de él vía difusión facilitada a una velocidad que es 50,000 mayor que en su ausencia. Los GLUTs de diversos tipos se encuentran en diferentes células del cuerpo. El de los glóbulos rojos se conoce como GLUT 1 y tiene 12 hélices hidrofóbicas que abarcan la membrana.
Aunque no se conoce la estructura del GLUT 1, se especula que las 12 hélices forman una cámara capaz de formar enlaces hidrófilos con la glucosa para facilitar su paso.
Los niveles de GLUT 1 en los eritrocitos aumentan a medida que los niveles de glucosa disminuyen y disminuyen cuando bajan los niveles de glucosa. GLUT 1 también puede transportar ascorbato (vitamina C) además de glucosa en mamíferos (como los humanos) que no producen su propia vitamina C.
Glut 4
GLUT 4 está regulado por la insulina y se encuentra principalmente en el tejido muscular adiposo y estriado. La insulina altera las vías de tráfico intracelular en respuesta a aumentos en el azúcar en la sangre para favorecer el movimiento de diversas proteínas GLUT (incluyendo GLUT 4) desde vesículas intracelulares a la membrana celular, estimulando así la captación de la glucosa. GLUT 4 también se encuentra en el hipocampo donde, si se interrumpe el tráfico, el resultado puede ser comportamiento depresivo y disfunción cognitiva.
Para todas las proteínas GLUT, una clave para mantener la glucosa en la célula es la fosforilación de la misma por la enzima glucólisis, hexoquinasa, en el citoplasma. Las moléculas fosforiladas no pueden entrar en los GLUT y no tienen un medio fácil de salir de la célula.
Distancia Ed
A la melodía de “Mister Ed”
Melodías metabólicas Sitio web AQUÍ
Un curso es una fuente,
por supuesto, por supuesto
De todo el conocimiento que avalamos
Una fuerza importante para mejor/peor es el campus Distancia Ed
Es cierto externalizar un curso universitario
Hay algunos estándares que se deben hacer cumplir
Los largos y cortos reforzamos el campus Distancia Ed
Puente
Una clase presencial se reúne todas las semanas a la misma hora todos los días
Pero Distance Ed es lo más único: su horario flexible está bien
E-course es una fuente, por supuesto, por supuesto
De asistencia en línea para informes de laboratorio
¿No estás inscrito en un curso en línea?
¡Entonces regístrate para esto!
“Te va a encantar Distancia Ed”
Grabación de David Simmons
Letras de Kevin Ahern
Recording por David Simmons Letras por Kevin Ahern
313
Es la una en punto y
Ahern está hablando
Henderson y
Hasselbalch y
PKa y
Tampones que debería saber
Esta canción es para BB tres cinco oh
Espero que tal vez
Él pensará de la manera en que
escribimos nuestras respuestas No
fue una locura Realmente
necesito el crédito
Parcial - así que
Esta canción es para BB tres cinco oh
Es realmente groovy
Que me mejore
Ver conferencias
En películas de Quicktime realmente
necesito
ir y descargar esos
Podcasts para BB three five oh
Esta canción es para BB 3-5-0
A la melodía de “This Land is My Land”
Melodías metabólicas Sitio web AQUÍ
Me siento maníaco
Estoy en pánico
Mejor estudio
Mi viejo orgánico
Tiene reacciones
Que necesito saber
Esta canción es para BB tres cinco oh
Sé
que lo dijo Por eso le temo
porque me salté el crédito
extra del viernes
'twil pro'bly perseguirme
Ese humilde
grado ze-ro en BB tres cinco oh
Podría ser estérico
O esotérico
Que los carbonos se pongan tan
Anoméricos
Estoy demasiado histérico
Mejor déjalo ir
Esta canción es para BB tres cinco oh
Grabación por Tim Karplus
Letras de Kevin Ahern
Recording por Tim Karplus Letras por Kevin Ahern


