8.2: Técnicas de Fraccionamiento y Cromatografía
- Page ID
- 53313
El fraccionamiento de muestras, como su nombre indica, es un proceso de separación de los componentes o fracciones del lisado. El fraccionamiento generalmente comienza con la centrifugación del lisado. Mediante centrifugación a baja velocidad, se pueden eliminar los restos celulares, dejando un sobrenadante que contiene el contenido de la célula. Mediante el uso de velocidades de centrifugación sucesivamente más altas (y las fuerzas g resultantes) es posible separar diferentes componentes celulares, como núcleos, mitocondrias, etc., del citoplasma. Estos pueden entonces ser lisados por separado para liberar moléculas que son específicas del compartimento celular particular. La fracción soluble de cualquier lisado puede, entonces, separarse adicionalmente en sus constituyentes usando diversos métodos.

Cromatografía en Columna
Un método poderoso utilizado para este propósito es la cromatografía. Consideraremos varios enfoques cromatográficos. La cromatografía se emplea para separar los componentes de una mezcla en función de las diferencias en su tamaño, carga u otras características. Durante la cromatografía, la fase móvil (tampón u otro disolvente) se mueve a través de la fase estacionaria (generalmente una matriz sólida) que lleva los componentes de la mezcla. Se logra la separación de los componentes, debido a que los diferentes componentes se mueven a diferentes velocidades, por razones que varían, dependiendo del tipo de cromatografía utilizada. Consideraremos varios tipos diferentes de cromatografía para ilustrar este proceso.
- Cromatografía de intercambio iónico
- Cromatografía de exclusión gel
- Cromatografía de afinidad
- HPLC

Estas variaciones en la cromatografía se realizan con la fase estacionaria mantenida dentro de las llamadas columnas (Figura\(\PageIndex{1}\)). Se trata de tubos que contienen la fase estacionaria (también llamada “soporte” o fase sólida).
Los soportes están compuestos por pequeñas perlas suspendidas en tampón (Figura\(\PageIndex{3}\)) y están diseñados para explotar la química o las diferencias de tamaño de los componentes de las muestras y así proporcionar un medio de separación. Las columnas se “empaquetan” o se rellenan con el soporte, y un tampón o disolvente lleva la mezcla de compuestos a separar a través del soporte. Las moléculas en la muestra interactúan diferencialmente con el soporte y, en consecuencia, viajan a través del mismo a diferentes velocidades, permitiendo así la separación.

Cromatografía de intercambio iónico
En la cromatografía de intercambio iónico, el soporte consiste en diminutas perlas a las que se unen sustancias químicas que poseen una carga. Antes de su uso, las perlas se equilibran en una solución que contiene un contraión apropiado a la molécula cargada en la perla. La figura\(\PageIndex{5}\) muestra la unidad repetitiva de poliestirolsulfonato, un compuesto utilizado como resina de intercambio catiónico. Como puede ver, esta molécula está cargada negativamente, y así las perlas se equilibrarían en un tampón que contiene un ion cargado positivamente, digamos sodio. En la suspensión, el poliestirolsulfonato cargado negativamente es incapaz de salir de las perlas, debido a su unión covalente, pero los contraiones (sodio) pueden ser “intercambiados” por moléculas de la misma carga.
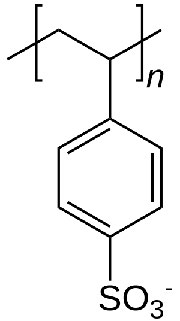
Intercambios
Así, una columna de intercambio catiónico tendrá contraiones cargados positivamente y moléculas cargadas negativamente unidas covalentemente a las perlas. Los compuestos cargados positivamente de un lisado celular pasado a través de la columna se intercambiarán con los contraiones y se “pegarán” a los compuestos cargados negativamente unidos covalentemente a las perlas. Las moléculas en la muestra que son neutras en carga o con carga negativa pasarán rápidamente por la columna. En este punto, solo las moléculas cargadas positivamente de la muestra original se unirían a la columna. Estos se pueden lavar, o eluir, mediante el uso de tampones que contienen altas concentraciones de sal. En estas condiciones, la interacción entre las moléculas cargadas positivamente y el poliestirosulfonato se interrumpiría, permitiendo recuperar las moléculas que estaban unidas a la columna.
Intercambio aniónico
Por otro lado, en la cromatografía de intercambio aniónico, los químicos adheridos a las perlas están cargados positivamente y los contraiones están cargados negativamente (cloruro, por ejemplo). Las moléculas cargadas negativamente en el lisado celular se “pegarán” y otras moléculas pasarán rápidamente. Para eliminar las moléculas “pegadas” a una columna, simplemente se necesita agregar una alta concentración de contraiones para liberarlas.
Usos
Las resinas de intercambio iónico son útiles para separar biomoléculas cargadas de no cargadas o cargadas de forma opuesta en solución. Las resinas tienen una variedad de otras aplicaciones, incluyendo purificación de agua y ablandamiento. La figura\(\PageIndex{5}\) muestra el uso de un polímero de poliestirolsulfonato en la eliminación de calcio para ablandamiento del agua.
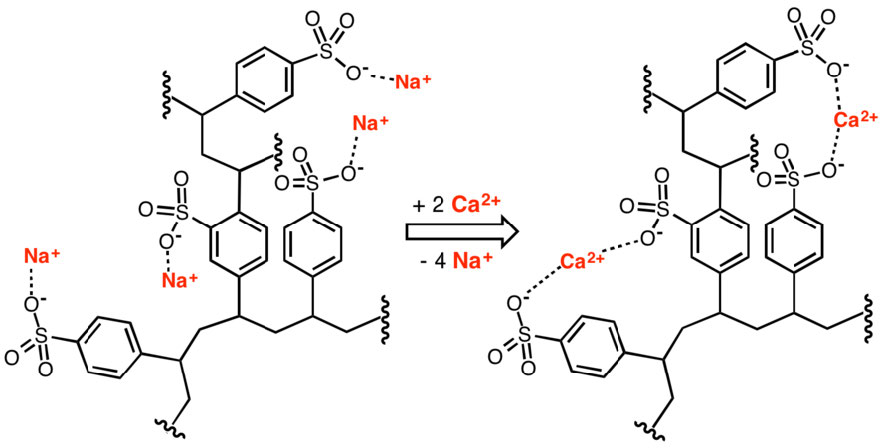
Figura\(\PageIndex{5}\): Eliminación de iones calcio por un intercambiador iónico. Wikipedia
Cromatografía de Exclusión
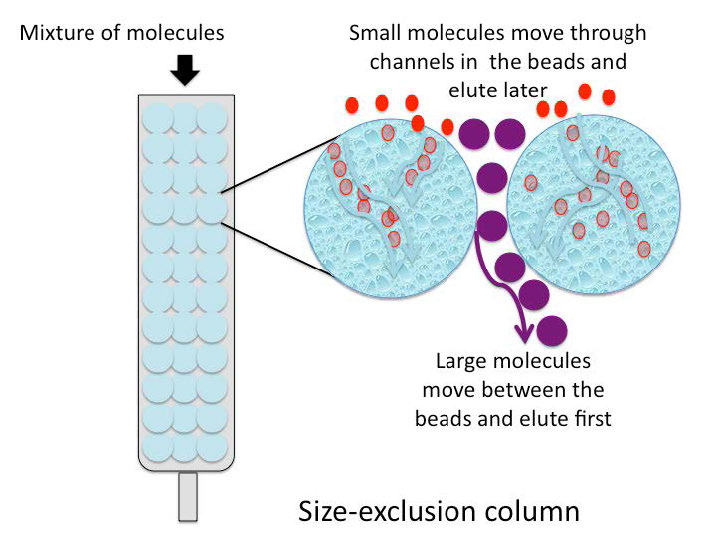
La cromatografía de exclusión por tamaño (también llamada cromatografía de exclusión molecular, cromatografía de exclusión en gel o cromatografía de filtración en gel) es un método de separación de baja resolución que emplea perlas con pequeños “túneles” en ellas que cada una tiene una apertura precisa. El tamaño de la abertura se conoce como un “límite de exclusión”, lo que significa que las moléculas por encima de cierto peso molecular no podrán pasar a través de los túneles. Las moléculas con tamaños físicos mayores que el límite de exclusión no ingresan a los túneles y pasan a través de la columna con relativa rapidez, en los espacios fuera de las perlas. Las moléculas más pequeñas, que pueden ingresar a los túneles, lo hacen, y así, tienen un camino más largo que toman al pasar por la columna y eluyen por último (Figura\(\PageIndex{6}\)).
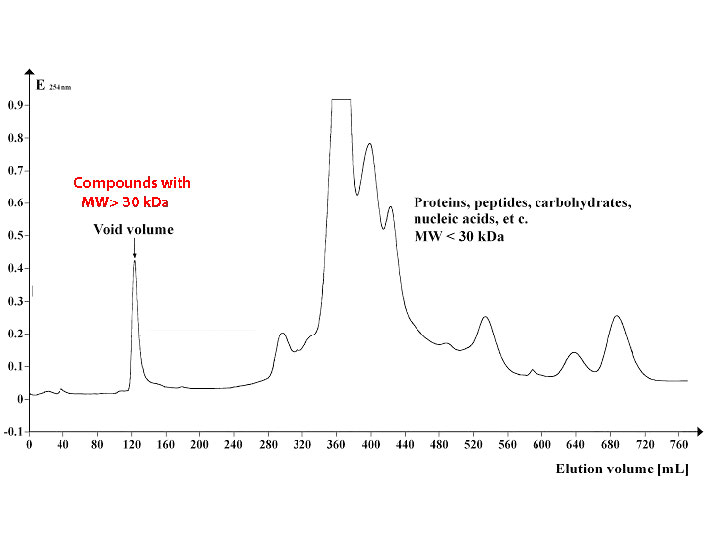
La Figura\(\PageIndex{7}\) muestra un perfil de un grupo de proteínas separadas por cromatografía de exclusión por tamaño usando perlas con un límite de exclusión de aproximadamente 30,000 Daltons. Las proteínas 30,000 en peso molecular o mayores eluyen en el volumen vacío (izquierda) mientras que las proteínas más pequeñas eluyen más tarde (medio y derecho).
Cromatografía de afinidad
La cromatografía de afinidad es una técnica muy potente y selectiva que explota las afinidades de unión de las moléculas de muestra (típicamente proteínas) por moléculas unidas covalentemente a las perlas de soporte. A diferencia de la cromatografía de intercambio iónico, donde todas las moléculas de una carga dada se unirían a la columna, la cromatografía de afinidad explota la unión específica de una proteína o proteínas a un ligando que se inmoviliza sobre las perlas de la columna.
Por ejemplo, si se quisiera separar todas las proteínas en un lisado celular que se unen a ATP de las proteínas que no se unen al ATP, se podría usar una columna que tenga ATP unido a las perlas de soporte y pasar la muestra a través de la columna. Todas las proteínas que se unan al ATP se “pegarán” a la columna, mientras que las que no se unan al ATP pasarán rápidamente a través de ella. Las proteínas unidas pueden entonces liberarse de la columna añadiendo una solución de ATP que desplazará a las proteínas unidas compitiendo, por las proteínas, con el ATP unido a la matriz de la columna.
Etiquetado de histidina
El etiquetado de histidina (His tagging) es un tipo especial de cromatografía de afinidad y es una herramienta poderosa para aislar una proteína recombinante de un lisado celular. El marcaje His se basa en la alteración de la región codificante de ADN para que una proteína agregue una serie de al menos seis residuos de histidina al extremo amino o carboxilo de la proteína codificada. Esta “" His-Tag "” es útil en la purificación de la proteína etiquetada porque las cadenas laterales de histidina pueden unirse a iones de níquel o cobalto.” La separación de las proteínas etiquetadas con His de un lisado celular es relativamente fácil (Figura\(\PageIndex{8}\)) .Pasar el lisado celular crudo a través de una columna con níquel o cobalto unido a perlas permite que las proteínas etiquetadas con His se “peguen”, mientras que las proteínas celulares restantes pasan rápidamente. Las proteínas etiquetadas con His se eluyen luego mediante la adición de imidazol a la columna. El imidazol, que se asemeja a la cadena lateral de la histidina, compite con las proteínas etiquetadas con His y las desplaza de la columna. Aunque las proteínas no etiquetadas en el lisado también pueden contener histidina como parte de su secuencia, no se unirán a la columna tan fuertemente como la proteína marcada con His y, por lo tanto, se desplazarán a concentraciones de imidazol más bajas que las necesarias para eluir la proteína etiquetada con His. Sorprendentemente, muchas proteínas etiquetadas con His parecen funcionar normalmente a pesar de las histidinas añadidas, pero si es necesario, las etiquetas de histidina pueden escindirse de la proteína purificada mediante tratamiento con una proteasa que escinde las histidinas añadidas, permitiendo la recuperación de la proteína deseada con su secuencia nativa.
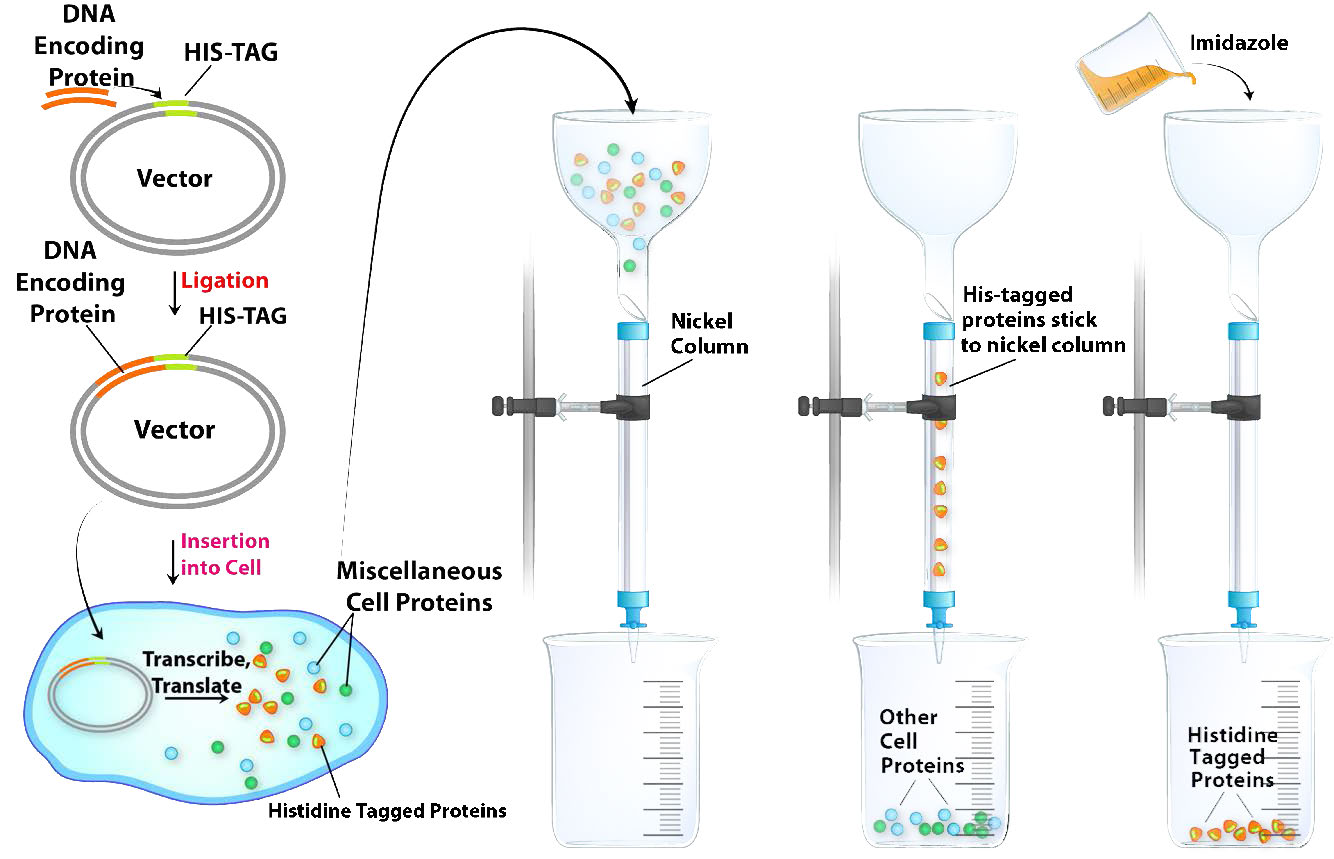
Figura\(\PageIndex{8}\): Purificación cromatográfica por afinidad de una proteína mediante etiquetado de histidina.Imagen de Aleia Kim
HPLC
La cromatografía líquida de alto rendimiento (HPLC) es una poderosa herramienta para separar una variedad de moléculas en función de sus polaridades diferenciales (Figura\(\PageIndex{9}\)). Una forma más eficiente de cromatografía en columna, emplea columnas con soportes fuertemente empaquetados y perlas muy pequeñas de manera que el flujo de solventes/tampones a través de las columnas requiere altas presiones. Los soportes utilizados pueden ser polares (separación de fases normales) o no polares (separación de fase inversa). En las separaciones de fases normales, las moléculas no polares eluyen primero seguidas de los compuestos más polares. Este orden se cambia en cromatografía de fase inversa. De los dos, la fase inversa se emplea mucho más comúnmente debido a los perfiles cromatográficos más reproducibles (separaciones) que normalmente produce.

Figura\(\PageIndex{9}\): HPLC: Bombas a la izquierda/columna en el centro/detector a la derecha. Wikipedia


