2.3: Enlaces químicos
- Page ID
- 53956
Los átomos forman enlaces para formar moléculas. Los enlaces covalentes son fuertes. Pueden implicar un reparto desigual o igual de un par de electrones, lo que lleva a enlaces covalentes polares y enlaces covalentes no polares respectivamente. Los enlaces iónicos son más débiles que los enlaces covalentes, creados por interacciones electrostáticas entre elementos que pueden ganar o perder electrones. ¡Los enlaces de hidrógeno (H-) están en una clase por sí mismos! Estas interacciones electrostáticas explican las propiedades físicas y químicas del agua. También están involucrados en interacciones entre y dentro de otras moléculas. Si bien los átomos pueden compartir, ganar o perder electrones en reacciones químicas, no ganarán ni perderán protones ni neutrones. Veamos más de cerca los enlaces químicos y cómo incluso los enlaces débiles son esenciales para la vida.
A. Enlaces covalentes
Los electrones se comparten en enlaces covalentes. ¡El gas hidrógeno (H2) es una molécula, no un átomo! Los átomos de H en la molécula H2 comparten sus electrones por igual. Asimismo, el átomo de carbono en el metano (CH4) comparte electrones por igual con cuatro átomos de hidrógeno. A continuación se muestra la distribución equitativa de electrones en enlaces covalentes no polares en H2 y CH4.
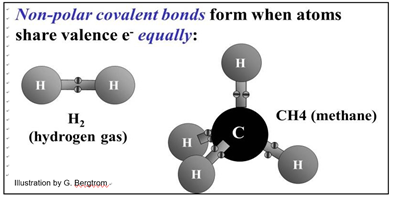
Un solo par de electrones en H2 forma el enlace covalente entre dos átomos de H en la molécula de hidrógeno. En el metano, el átomo de carbono (C) tiene cuatro electrones en su capa externa que puede compartir. Cada átomo de H tiene un solo electrón para compartir. Si el átomo C comparte sus cuatro electrones con los cuatro electrones en los cuatro átomos de H, habrá cuatro electrones emparejados (8 electrones en total) moviéndose en orbitales llenos alrededor del núcleo del átomo C alguna vez, y un par moviéndose alrededor de cada uno de los núcleos atómicos H algunas veces. Así, la capa externa del átomo de C y cada uno de los átomos de H se llenan al menos una parte del tiempo. Esto estabiliza la molécula. Recordemos que los átomos son más estables cuando sus capas externas están llenas y cuando cada orbital de electrones está lleno (es decir, con un par de electrones).
Los enlaces covalentes polares se forman cuando los electrones en una molécula se comparten de manera desigual. Esto sucede si los núcleos atómicos en una molécula son muy diferentes en tamaño. Este es el caso del agua, que se muestra a continuación.
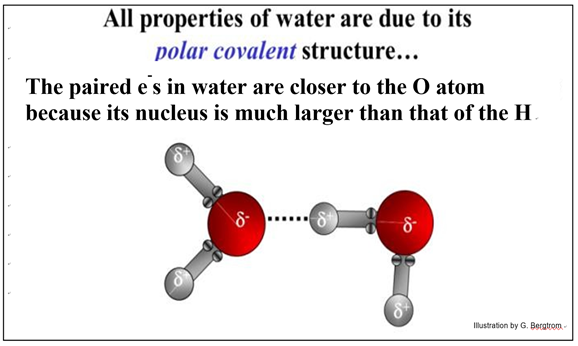
El núcleo más grande del átomo de oxígeno en H2O atrae electrones con mayor fuerza que cualquiera de los dos átomos de H. Como resultado, los electrones compartidos pasan más tiempo orbitando el átomo de O, de tal manera que el átomo de O lleva una carga negativa parcial mientras que cada uno de los átomos de H lleva una carga positiva parcial. La letra griega delta (d) indica cargas parciales en enlaces covalentes polares. En las dos ilustraciones anteriores, compare la posición de los electrones emparejados en el agua con los ilustrados para gas hidrógeno o metano.
Los enlaces covalentes polares del agua le permiten atraer e interactuar con otras moléculas covalentes polares, incluidas otras moléculas de agua. La naturaleza polar covalente del agua también ayuda mucho a explicar sus propiedades físicas y químicas, ¡y por qué el agua es esencial para la vida en este planeta!
Tanto los enlaces covalentes polares como los no polares juegan un papel importante en la estructura de las macromoléculas, como la insulina, la hormona proteica que se muestra a continuación.
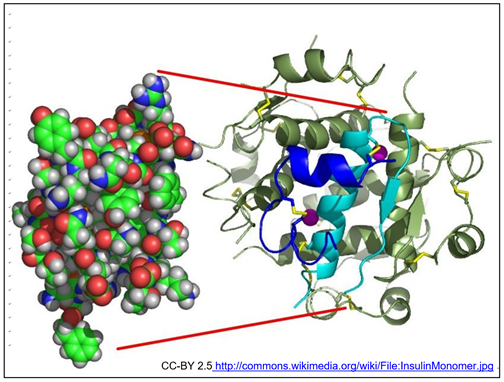
La imagen de rayos X de un modelo de relleno de espacio de la forma hexamérica de la insulina almacenada (arriba a la izquierda) enfatiza su estructura terciaria con gran detalle. Las regiones de estructura secundaria interna se resaltan en el diagrama de cinta de la derecha; como se secreta de los islotes de células de Langerhans del páncreas, la insulina activa es un dímero de dos polipéptidos (A y B), mostrados aquí en azul y cian respectivamente. La estructura de la subunidad y las interacciones que mantienen juntas las subunidades resultan de muchas interacciones electrostáticas (incluyendo enlaces H) y otras interacciones débiles. Los enlaces disulfuro (puentes) vistos como 'Vs' amarillos en el diagrama de cinta estabilizan los monómeros A y B asociados. Analizaremos la estructura de las proteínas con más detalle en un próximo capítulo.
B. Enlaces iónicos
Los átomos que ganan o pierden electrones para lograr una capa externa llena forman iones, adquiriendo una carga negativa o positiva, respectivamente. A pesar de estar cargados eléctricamente, los iones son estables porque sus capas externas de electrones están llenas. La sal común de mesa es un buen ejemplo (ilustrado a continuación).

El Na (sodio) puede donar un solo electrón a los átomos de Cl (cloro), generando iones Na+ y Cl-. Los iones con carga opuesta se unen formando un enlace iónico, una interacción electrostática de cargas opuestas que mantiene los iones Na+ y Cl- juntos en sal cristalina. Busque los modelos Bohr de estos dos elementos y vea cómo la ionización de cada hoja llenó las conchas externas (niveles de energía) en los iones.


