6.4: Gluconeogénesis
- Page ID
- 53808
En un animal bien alimentado, la mayoría de las células pueden almacenar una pequeña cantidad de glucosa como glucógeno. Todas las células descomponen el glucógeno según sea necesario para recuperar la energía nutrimental como G-6-P. La hidrólisis de glucógeno, o glucogenólisis, produce G-1-P que se convierte en G-6-P, como vimos en la parte superior de la Etapa 1 de la glucólisis. Pero, el glucógeno en la mayoría de las células se agota rápidamente entre las comidas. Por lo tanto, la mayoría de las células dependen de una fuente externa de glucosa diferente a la dieta. Esas fuentes son el hígado y en menor medida, las células renales, que pueden almacenar grandes cantidades de glucógeno después de las comidas. En los alimentadores continuos (por ejemplo vacas y otros rumiantes), la glucogenólisis está en curso. En alimentadores intermitentes (como nosotros), la glucogenólisis hepática puede suministrar glucosa a la sangre durante 6-8 horas entre comidas, para distribuirse según sea necesario a todas las células del cuerpo. Por lo tanto, puede esperar agotar las reservas de glucógeno hepático y renal después de una buena noche de sueño, un período de ejercicio intenso o cualquier período prolongado de baja ingesta de carbohidratos (ayuno o inanición). En estas circunstancias, los animales utilizan la gluconeogénesis (literalmente, nueva síntesis de glucosa) en células hepáticas y renales para proporcionar glucosa sistémica para nutrir otras células. Como siempre en individuos por lo demás sanos, las hormonas insulina y glucagón regulan la homeostasis de la glucosa en sangre, protegiendo contra la hipoglucemia (bajo nivel de azúcar en la sangre) y la hiperglucemia (azúcar alta en la sangre) respectivamente. La vía gluconeogénica produce glucosa a partir de sustratos precursores de carbohidratos y no carbohidratos. Estos precursores incluyen piruvato, lactato, glicerol y aminoácidos gluconeogénicos. Estos últimos son aminoácidos que pueden convertirse en alanina. Mire las reacciones lado a lado de la glucólisis y la gluconeogénesis en la página siguiente. Busque las dos reacciones de bypass, catalizadas por dos carboxilasas y dos fosfatasas (marrón en la ilustración) y las reacciones glicolíticas que funcionan a la inversa durante la gluconeogénesis.
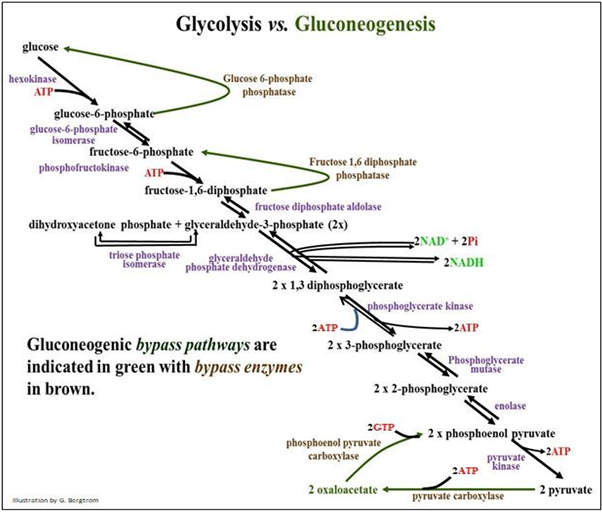
Si la glucólisis es una vía exergónica, entonces la gluconeogénesis debe ser endergónica. De hecho, mientras que la glucólisis a través de dos piruvatos genera una red de dos ATP, ¡la gluconeogénesis de dos piruvato a glucosa cuesta 4 ATP y dos GTP! Asimismo, la gluconeogénesis solo es posible si las enzimas de bypass están presentes. Estos son necesarios para sortear las tres reacciones biológicamente irreversibles de la glucólisis. Excepto por las reacciones de bypass, la gluconeogénesis es esencialmente una inversión de la glucólisis.
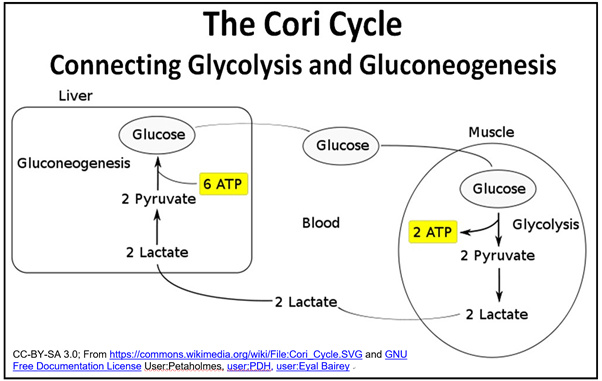
Como se dibuja en las vías anteriores, la glucólisis y la gluconeogénesis parecerían ser cíclicas. De hecho, este aparente ciclo fue reconocido por Carl y Gerti Cori, quienes compartieron el Premio Nobel de Medicina o Fisiología 1947 con Bernardo Houssay por descubrir cómo el glucógeno se descompone en piruvato en las células musculares (de hecho la mayoría), que luego pueden ser utilizadas para resintetizar la glucosa en las células hepáticas. El nombre del Coris, El Ciclo Cori, que se muestra a continuación, reconoce la interdependencia del hígado y el músculo en la descomposición y resíntesis de la glucosa.
A pesar de este requerimiento de energía libre, ¡la gluconeogénesis es energéticamente favorable en las células hepáticas y renales! Esto se debe a que las celdas son sistemas abiertos. La acumulación de piruvato en las células hepáticas y la rápida liberación de nueva glucosa en la sangre impulsan las reacciones energéticamente favorables de la gluconeogénesis. Así, bajo condiciones gluconeogénicas, la síntesis de glucosa ocurre con un DG' negativo, una disminución en la energía libre real. ¡Por supuesto, la glucólisis y la gluconeogénesis no son simultáneas! Qué vías operan en las que las células están estrechamente controladas.
La glucólisis es la norma en todos los tipos celulares, incluso en hígado y riñón. Sin embargo, el cese de la glucólisis a favor de la gluconeogénesis en estas últimas células está bajo control hormonal, como se ilustra a continuación.
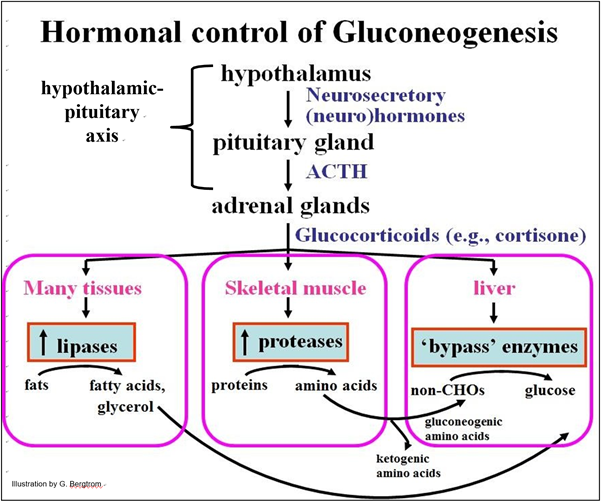
La clave para activar la gluconeogénesis hepática es el papel de las hormonas glucocorticoides. ¿Qué causa la secreción de glucocorticoides? Una larga noche de sueño, ayuno y más extremadamente, el hambre son formas de estrés. Las respuestas al estrés se inician en el eje hipotalámico-hipofisario. Diferentes factores estresantes hacen que el hipotálamo secrete una neurohormona que a su vez, estimula la liberación de ACTH (hormona adrenocorticotrópica) de la glándula pituitaria. La ACTH estimula entonces la liberación de cortisona y otros glucocorticoides de la corteza (capa externa) de las glándulas suprarrenales. Como sugiere el nombre glucocorticoide, estas hormonas participan en la regulación del metabolismo de la glucosa. Esto es lo que sucede en momentos de bajo nivel de azúcar en la sangre (por ejemplo, cuando la ingesta de carbohidratos es baja):
1. Los glucocorticoides estimulan la síntesis de enzimas de bypass gluconeogénicas en las células hepáticas.
2. Los glucocorticoides estimulan la síntesis de proteasas en el músculo esquelético, provocando la hidrólisis de los enlaces peptídicos entre los aminoácidos. Los aminoácidos gluconeogénicos circulan al hígado donde se convierten en piruvato, uno de los principales precursores de la gluconeogénesis. Algunos aminoácidos son cetogénicos; se convierten en acetil-S-CoA, precursor de cuerpos cetónicos.
(1). Los glucocorticoides estimulan el aumento de los niveles de enzimas incluyendo lipasas que catalizan la hidrólisis de los enlaces éster en triglicéridos (grasa) en células adiposas y otras células. Esto genera ácidos grasos y glicerol.
(2). El glicerol circula a las células hepáticas que lo toman lo convierten en G-3-P, incrementando la gluconeogénesis. Los ácidos grasos circulan a las células hepáticas donde se oxidan a acetil-S-CoA que luego se convierte en cuerpos cetonos. y se liberan a la cisculación.
(3). La mayoría de las células utilizan los ácidos grasos como nutriente de energía alternativa cuando la glucosa es limitante., y aunque las células del corazón y el cerebro dependen de la glucosa para obtener energía, las células cerebrales pueden usar cuerpos de ket9ona como un curso de energía alternativo.
papeles esenciales de los glucocorticoides
- ¡Es una pena que los humanos no podamos usar los ácidos grasos como sustratos gluconeogénicos! Las plantas y algunos animales inferiores tienen una vía del ciclo del glioxalato que puede convertir los productos de la oxidación de ácidos grasos (acetato) directamente en carbohidratos que pueden ingresar a la vía gluconeogénica. Al carecer de esta vía, nosotros (y los animales superiores en general) no podemos convertir las grasas en carbohidratos, ¡a pesar de que con demasiada facilidad podemos convertir estas últimas a las primeras!
El lado oscuro de los malos hábitos alimenticios es la inanición prolongada que puede abrumar la respuesta gluconeogénica. Esto se ve en reportes de regiones del tercer mundo que sufren inanición por sequía u otro desastre natural, o guerra. Los brazos y piernas espinosos de los niños hambrientos resultan del desgaste muscular mientras el cuerpo trata de proporcionar la glucosa necesaria para la supervivencia. Cuando la respuesta gluconeogénica es inadecuada para la tarea, el cuerpo puede recurrir al metabolismo cetogénico de las grasas. Piense en esto como un último recurso, que lleva a la producción de cuerpos cetónicos y al “aliento de acetona” en las personas hambrientas.


