2.6: Aminoácidos
- Page ID
- 53143
La mayoría de las moléculas principales de la célula -ya sean estructurales, como equivalentes celulares de las vigas y vigas de un edificio, o mecánicas, como enzimas que descomponen o juntan otras moléculas, son proteínas. Las proteínas interactúan con una amplia variedad de otras moléculas, aunque cualquier interacción dada suele ser bastante específica. La especificidad está determinada en parte por la atracción eléctrica entre las moléculas. Entonces, ¿qué determina la carga de diferentes regiones de una proteína?
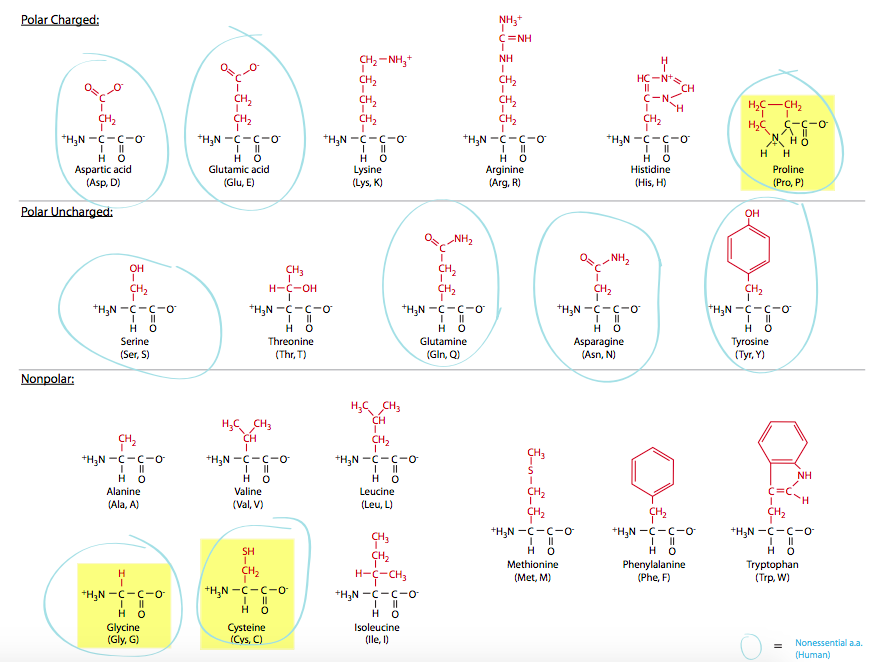
Los aminoácidos (Figura\(\PageIndex{9}\)), que se unen para producir proteínas, pueden estar cargados positivamente (básicos), cargados negativamente (ácidos), polares o no polares, en función de las características de sus cadenas laterales. La carga en el extremo amino o carboxilo de cada aminoácido no juega un papel en el carácter general de ninguna región particular de la proteína, debido a que son efectivamente neutros, habiendo sido enlazados, el grupo amino de un aminoácido al grupo carboxilo de otro, por un enlace peptídico. Obsérvese la Figura del aminoácido: es un carbono, llamado el carbono a, unido a grupos amino y carboxilo en lados opuestos, y al hidrógeno, y una cadena lateral, denotada por R. Estas cadenas laterales, de las cuales hay veinte comunes, pueden ser tan simples como un átomo de hidrógeno (glicina), o podrían ser bastante complejas, involucrando estructuras anulares extendidas (histidina, fenilalanina). La variedad en su tamaño, forma y carga se suman a un conjunto extremadamente versátil de bloques de construcción para algunas de las moléculas de trabajo más importantes de la célula.
quiralidad
Casi todos los aminoácidos (la glicina es la excepción) son ópticamente activos, lo que significa que son asimétricos de tal manera que es imposible superponer la molécula original sobre su imagen especular. Hay una “mano” en ellos, tanto como tu mano derecha no puede superponerse a tu mano izquierda si ambas palmas deben mirar en la misma dirección. De hecho, en la Figura aquí, también se puede entender por qué la glicina es una excepción, ya que su grupo R es un simple átomo de hidrógeno.
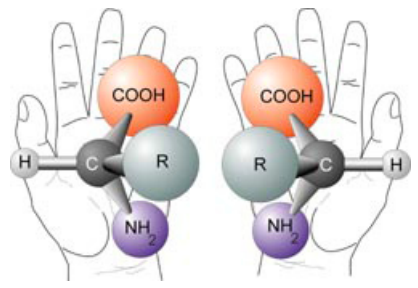
Los pares quirales, o enantiómeros, no solo tienen los mismos componentes atómicos como todos los isómeros, también tienen los mismos enlaces y orden de enlace. El término “ópticamente activo” proviene del descubrimiento de que polariza la luz es rotada en diferentes direcciones por enantiómeros. Los aminoácidos a menudo se marcan como d- (dextrorrotatorios) o l- (levorrotatorios) dependiendo de su configuración atómica en relación con los enantiómeros del gliceraldehído. Este es un sistema de nomenclatura común, pero no siempre lógico, ya que casi la mitad de los l-aminoácidos son de hecho dextrorrotatorios (rotación de la luz en el sentido de las agujas del reloj), pero sus configuraciones moleculares se asemejan al isómero levorrotatorio del gliceraldehído.
Las proteínas y péptidos creados por ribosomas se construyen con l-aminoácidos. Sin embargo, los d-aminoácidos existen en la naturaleza, y pueden incorporarse en péptidos a través de medios no ribosómicos. Un excelente ejemplo se encuentra en las paredes celulares de algunas bacterias. Debido a que la mayoría de las enzimas proteolíticas solo actúan sobre proteínas con aminoácidos, la incorporación de d-aminoácidos en la pared celular puede proteger a las bacterias del daño. Estos D-aminoácidos son incorporados por la transpeptidasa. La transpeptidasa es también el objetivo del antibiótico, la penicilina, que es un inhibidor irreversible de esa enzima.
En la célula, se forma un enlace peptídico entre dos aminoácidos con ayuda enzimática del ribosoma. Al igual que las dos reacciones de polimerización anteriores, la formación de enlaces peptídicos es una reacción de condensación en la que el carbono del grupo carboxilo y el nitrógeno del grupo amino de sus respectivos aminoácidos están unidos entre sí (Figura\(\PageIndex{10}\)). Este es un enlace muy estable debido a la resonancia del grupo amida. En la célula, los enlaces peptídicos son en su mayoría no reactivos, excepto cuando son atacados por enzimas proteolíticas.
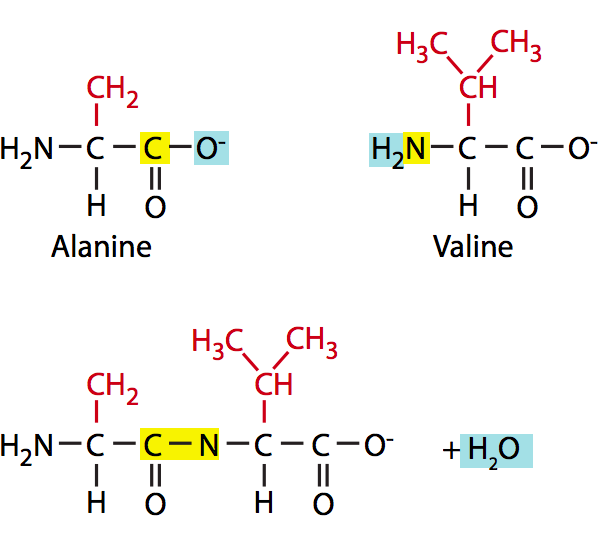
Un péptido es un término inexacto usado para relativamente pocos (generalmente <30) aminoácidos unidos entre sí. “Cada aminoácido en un polipéptido o proteína también puede denominarse “" residuo "” que a veces puede ser confuso porque el mismo término también se aplica a monómeros de ácidos nucleicos y de polisacáridos.” Los polímeros más grandes se conocen como polipéptidos o como proteínas, aunque los polipéptidos tienen más una connotación estructural y pueden usarse para indicar un estado inacabado o aún no funcional, mientras que la proteína generalmente implica alguna función fisiológica. Una de las características clave de las proteínas es la capacidad de formar estructuras secundarias, terciarias y para proteínas cuaternarias mediante patrones de plegamiento específicos. Si piensas en un largo trozo de hilo, hilo o cuerda, probablemente puedas imaginar un número infinito de formas diferentes de organizarlo, desde espirales hasta bucles y enredos aleatorios. Esto es esencialmente lo que puede suceder con una proteína con las limitaciones que le impone el tamaño y la carga de los aminoácidos que la componen.
La estructura primaria de una proteína es simplemente la secuencia de aminoácidos que componen la proteína. Estos aminoácidos están unidos por enlaces peptídicos desde el terminal carboxilo de un aminoácido al terminal amino del siguiente. La estructura secundaria se refiere a las formas localizadas, simples, que se pueden formar, como las hélices alfa o las láminas beta. Estos se producen principalmente a través de enlaces de hidrógeno a residuos cercanos (relativos a la estructura primaria).
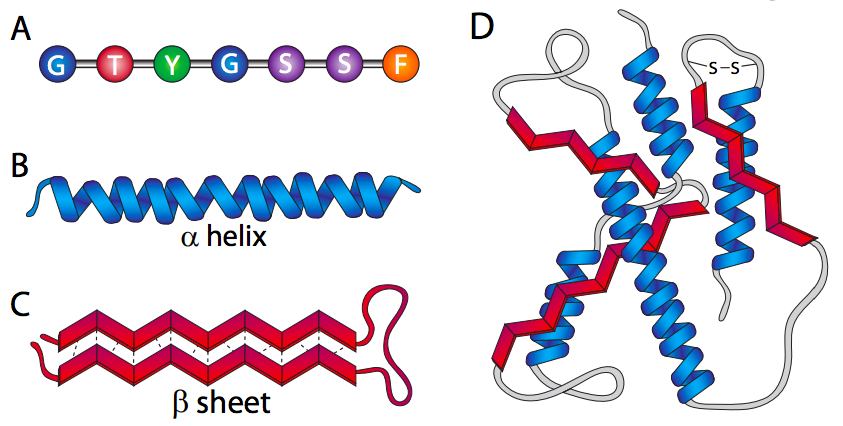
La estructura terciaria es una estructura tridimensional que se construye sobre arreglos de estructuras secundarias, a menudo a través de enlaces disulfuro e interacciones hidrófobas además de enlaces de hidrógeno. En el contexto de la estabilidad estructural, la cisteína juega un papel especial. Más allá de la estructura primaria, la mayoría del plegamiento de proteínas se mantiene en su lugar mediante enlaces de hidrógeno Aunque lo suficientemente fuertes en la mayoría de las situaciones, pueden ser interrumpidos sin una energía extraordinaria. Los enlaces disulfuro (—S-S—) son enlaces covalentes que se forman entre los grupos sulfhidrilo de dos cisteínas que bloquean eficazmente la estructura proteica local en su lugar, haciendo que la proteína sea extremadamente estable.
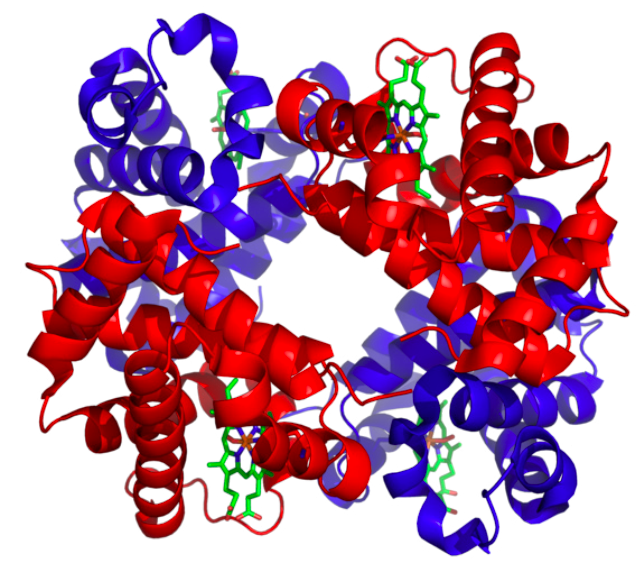
Finalmente, la estructura cuaternaria es la disposición de diferentes polipéptidos individuales (subunidades) en una proteína funcional. Obviamente, solo las proteínas multisubunitarias tienen una estructura cuaternaria.


