11.4: Comienza la glicosilación de proteínas N-ligadas en la sala de emergencias
- Page ID
- 53082
La glicosilación es una modificación importante de las proteínas eucariotas debido a que los residuos de azúcar añadidos a menudo se utilizan como indicadores moleculares o señales de reconocimiento a otras células que entran en contacto con ellas. Existen dos tipos de glicosilación proteica, los cuales requieren la importación del polipéptido diana en el ER. La glicosilación ligada a N comienza realmente en el retículo endoplásmico, pero la glicosilación ligada a O no ocurre hasta que el polipéptido ha sido transportado al aparato de Golgi. Por lo tanto, también es el caso de que la glicosilación ligada a N puede (y es) generalmente comenzar como un mecanismo co-traduccional, mientras que la glicosilación ligada a O debe estar ocurriendo postraduccionalmente. Otras diferencias importantes en los dos tipos de glicosilación son (1) la glicosilación ligada a N ocurre en los residuos de asparagina (N) dentro de una secuencia N-X-S o N-X-T (X es cualquier aminoácido que no sea P o D) mientras que la glicosilación unida a O ocurre en la cadena lateral de oxígeno hidroxilo de cualquiera de los residuos de serina o treonina determinado no por la secuencia circundante, sino por la estructura secundaria y terciaria; (2) La glicosilación ligada a N comienza con un “árbol” de 14 residuos de azúcar específicos que luego se poda y se remodela, pero permanece bastante grande, mientras que la glicosilación ligada a O se basa en la adición secuencial de azúcares individuales, y lo hace no suelen extenderse más allá de unos pocos residuos.
Técnicamente, la N-glicosilación comienza antes de que una proteína sea incluso traducida, ya que el oligosacárido dolihol pirofosfato (es decir, el “árbol” de azúcar -no un término oficial, por cierto) se sintetiza en la ER (Figura\(\PageIndex{12}\)) sin ser desencadenado por la traducción o entrada de proteínas.
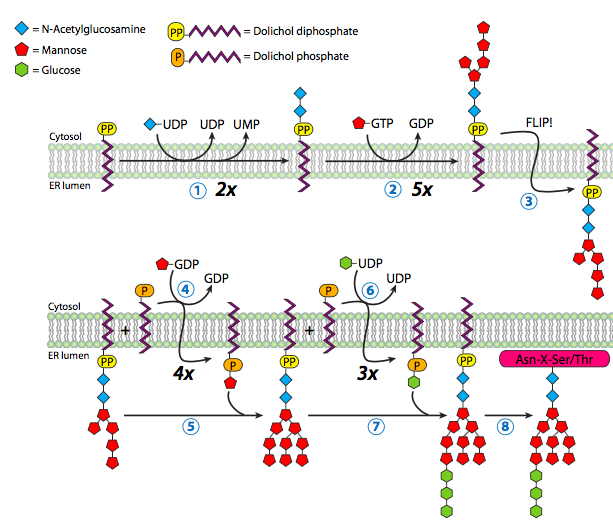
El dolihol es un hidrocarburo de cadena larga [entre 14-24 unidades de isopreno de 4+1 carbonos] que se encuentra principalmente en la membrana del RE, y sirve como anclaje temporal para el oligosacárido de N-glicosilación a medida que se sintetiza y espera una proteína apropiada para glicosilar. La síntesis de oligosacáridos comienza con la adición de dos residuos de N-acetilglucosamina al enlazador pirofosfato, seguido de una manosa. De esta manosa, el oligosacárido se ramifica, recibiendo una rama tres residuos más de manosa y la otra recibiendo uno. Hasta el momento, todas estas adiciones al oligosacárido se han venido dando en el citoplasma. ¡Ahora el glicolípido es volteado hacia adentro al lumen de la sala de emergencias! Una vez en el lumen, se agregan cuatro manosas más, y finalmente tres residuos de glucosa rematan la estructura.
No todos los nucleósidos se utilizan para este proceso: los azúcares solo se han encontrado vinculados a UDP, PIB y CMP. UDP es la N-acetilgalactosamina (GalNAc) más versátil, de unión, N-acetilglucosamina (GlcNAc), ácido N-acetilmurámico, galactosa, glucosa, ácido glucurónico y xilosa. El PIB se usa para manosa y fucosa, mientras que CMP solo se usa para ácido siálico.
Las enzimas que logran la glicosilación son glicosiltransferasas específicas tanto para el residuo de azúcar agregado como para el oligosacárido diana. Los azúcares utilizados por las enzimas no son simplemente el azúcar, sino azúcares nucleotídicos -generalmente un azúcar ligado a un nucleósido difosfato, por ejemplo, uracilo difosfato glucosa (UDP-glucosa) o GDP- manosa.
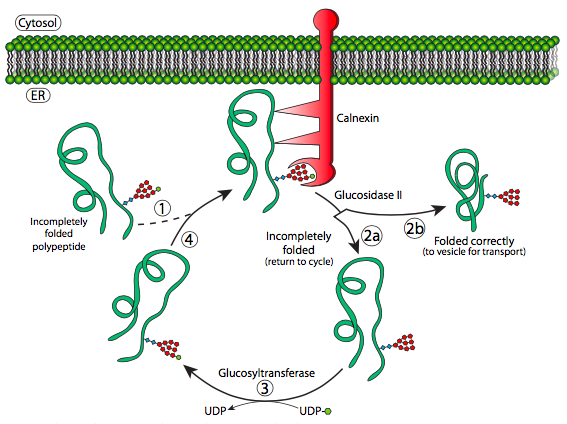
El oligosacárido N-ligado tiene dos funciones fisiológicas: actúa como base para una mayor glicosilación, y se utiliza como marcador para la comprobación de errores del plegamiento de proteínas mediante el sistema calnexina-calreticulina (Figura\(\PageIndex{13}\)). Una vez que el oligosacárido se une al nuevo polipéptido, el proceso de glicosilación posterior comienza con la acción de una glucosidasa y que elimina dos de las glucosas. La última glucosa es necesaria para ayudar a que la glicoproteína se acople con calnexina o calreticulina (Figura 13, paso 1 ó 4), que son proteínas muy similares que tienen una actividad glucosidasa lenta y se asocian con una actividad similar a una proteína disulfuro isomerasa.
La actividad similar a la proteína disulfuro isomerasa proviene de ERp57, que técnicamente es una tiol oxidorreductasa, pero funcionalmente similar a la PDI.
La principal diferencia es que la calreticulina es soluble en la luz del ER mientras que la calnexina se une a la membrana del ER. Ambos se aferran temporalmente a la glicoproteína dándole tiempo para (re) plegarse y posiblemente reorganizar los enlaces disulfuro, luego elimina la glucosa, permitiendo que la glicoproteína continúe en su camino. Es importante destacar que si la glicoproteína no ha sido completamente plegada (paso 2a), la enzima UDP-glucosa:glicoproteína glucosiltransferasa (GT) la reconoce y vuelve a agregar el residuo de glucosa (paso 3), obligándola a pasar nuevamente por el ciclo de calreticulina/calnexina con la esperanza de plegarse correctamente esta vez. Si ha sido plegada correctamente (paso 2b), puede ser reconocida por ER-α-1,2-manosidasa, la cual elimina una manosa, completando las modificaciones de glicosilación en la ER.
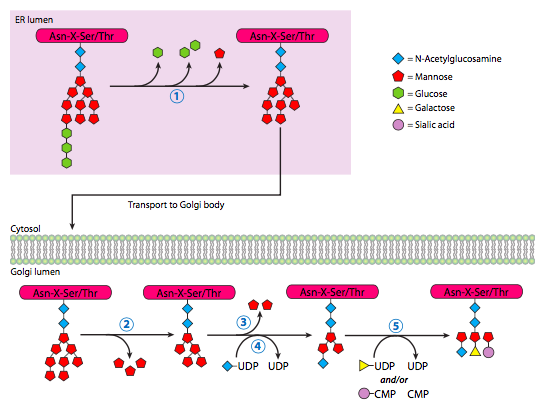
La mayoría de las glicoproteínas continúan con la remodelación de oligosacáridos una vez que han sido trasladadas de la sala de emergencias al aparato de Golgi por transporte vesicular. Allí, una variedad de glicosidasas y glicosiltransferasas podan y agregan al oligosacárido. Aunque la glicosilación es consistente y estereotipada para una proteína dada, todavía no está claro exactamente cómo se determinan los patrones de glicosilación.
Dos antibióticos comunes, la tunicamicina y la bacitracina, pueden apuntar a la glicosilación ligada a N, aunque sus propiedades antibióticas provienen de la alteración de la formación de paredes celulares bacterianas. La tunicamicina es un análogo de UDP-GlcNAc, y dentro de las células eucariotas puede alterar la formación inicial de oligosacáridos bloqueando la adición inicial de GlcNAc al dolichol-fosfato. Dado que puede ser transportada a células eucariotas, la tunicamicina no es clínicamente útil debido a su toxicidad. La bacitracina, por otro lado, es un pequeño polipéptido cíclico que se une a Dolichol-PP impidiendo su desfosforilación a Dolichol-P, el cual es necesario para construir el oligosacárido. La bacitracina no es permeable a las células, por lo que a pesar de que tiene una actividad similar a la de la tunicamicina en bacterias al interrumpir la síntesis extracelular de glicolípidos necesaria para la formación de la pared celular, es inofensiva para los eucariotas y por lo tanto es un antibiótico terapéutico útil.


