6.3: Algunos detalles de la glicólisis
- Page ID
- 53789
A. Glicolisis, Etapa 1
Reacción 1: En la primera reacción de glucólisis, la enzima hexoquinasa fosforila rápidamente la glucosa que ingresa a la célula, formando glucosa-6-fosfato (G-6-P). Como se muestra a continuación, la reacción global es exergónica; el cambio de energía libre para la reacción es -4 Kcal por mol de G-6-P sintetizado.
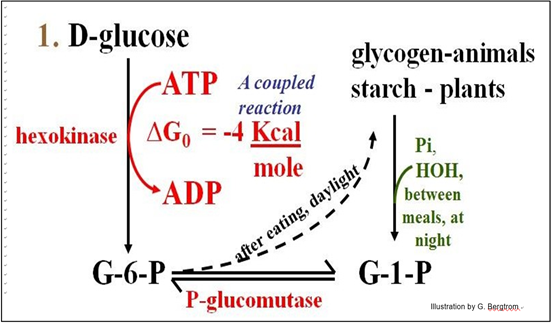
Esta es una reacción acoplada, en la que la fosforilación de la glucosa se acopla a la hidrólisis de ATP. La energía libre de la hidrólisis de ATP (una reacción energéticamente favorable) alimenta la fosforilación de la glucosa (una reacción energéticamente no favorable). La reacción también es biológicamente irreversible, como lo muestra la única flecha vertical. El exceso de glucosa en la dieta se puede almacenar en la mayoría de las células (especialmente células hepáticas y renales) como un polímero altamente ramificado de monómeros de glucosa llamado glucógeno. En algas verdes y plantas, la glucosa producida por la fotosíntesis se almacena como polímeros de almidón. Cuando la glucosa es necesaria para la energía, la hidrólisis de glucógeno y almidón forma glucosa-1- fosfato (G-1-P) que luego se convierte en G-6-P.
Veamos la energética (flujo de energía libre) de la reacción catalizada por hexoquinasa. Esta reacción puede verse como la suma de dos reacciones que se muestran a continuación.
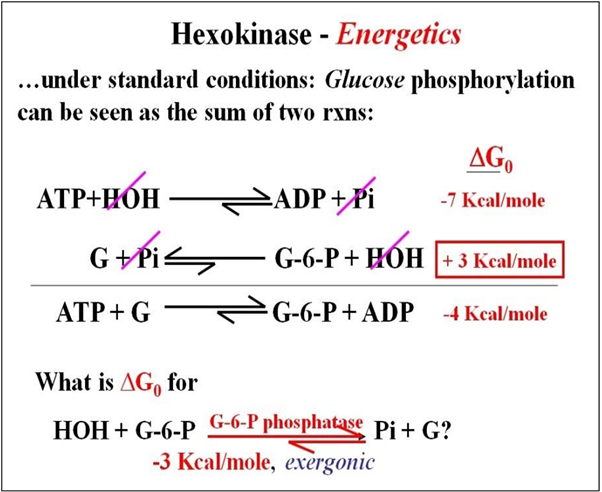
Recordemos que la hidrólisis de ATP es una reacción exergónica, liberando ~7 Kcal/mol (¡redondeando a la baja!) en un sistema cerrado bajo condiciones estándar. La reacción de condensación de la fosforilación de glucosa ocurre con un dGO de +3 kcal/mol. Esta es una reacción endergónica bajo condiciones estándar. Resumiendo los cambios de energía libre de las dos reacciones, podemos calcular el dGO global de -4 Kcal/mol para la reacción acoplada en condiciones estándar en un sistema cerrado.
Las reacciones anteriores están escritas como si fueran reversibles. Sin embargo, dijimos que la reacción acoplada global es biológicamente irreversible. ¿Dónde está la contradicción? Para explicar, decimos que una reacción catalizada por enzimas es biológicamente irreversible cuando los productos tienen una afinidad relativamente baja por el sitio activo de la enzima, haciendo que la catálisis (aceleración) de la reacción inversa sea muy ineficiente. Las enzimas que catalizan reacciones biológicamente irreversibles no permiten volver a los reactivos, pero a menudo están reguladas alostéricamente. Este es el caso de la hexoquinasa. Imagínese una célula que frena su consumo de G-6-P porque se están satisfaciendo sus necesidades energéticas. ¿Qué sucede cuando los niveles de G-6-P suben en las células? Se podría esperar que la reacción de la hexoquinasa se ralentice para que la célula no consuma innecesariamente un valioso recurso energético nutritivo. La regulación alostérica de la hexoquinasa se ilustra a continuación.

A medida que aumentan las concentraciones de G-6-P en la célula, el exceso de G-6-P se une a un sitio alostérico en la hexoquinasa. El cambio conformacional en la enzima se transfiere luego al sitio activo, inhibiendo la reacción.
152 Glicolisis Etapa 1, Reacción 1
Reacción 2: En esta reacción ligeramente endergónica y reversible, la isomerasa cataliza la isomerización de G-6-P a fructosa-6-P (F-6-P), como se muestra a continuación.

Reacción 3: En esta reacción biológicamente irreversible, la 6-fosfofructoquinasa (6-P- fructoquinasa) cataliza la fosforilación de F-6-P para hacer fructosa 1,6 di- fosfato (F1,6 DiP). Esta también es una reacción acoplada, en la que ATP proporciona el segundo fosfato. La reacción global se escribe como la suma de dos reacciones, como se muestra a continuación.
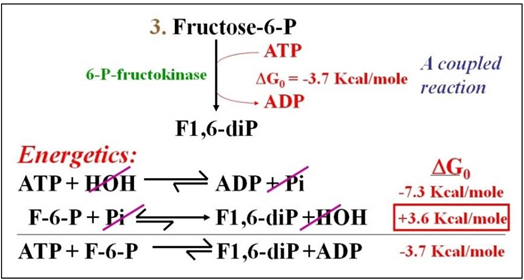
Al igual que la reacción de hexoquinasa, la reacción de 6-P-fructoquinasa es una reacción acoplada, exergónica y regulada alostéricamente. Múltiples efectores alostéricos, incluyendo ATP, ADP y AMP y ácidos grasos de cadena larga regulan esta enzima.
Reacciones 4 y 5: Estas son las últimas reacciones de la primera etapa de la glucólisis. En la reacción 4, F1,6 DiP (un azúcar 6-C) se divide reversiblemente en fosfato de dihidroxiacetona (DHAP) y gliceraldehído-3-fosfato (G-3-P). En la reacción 5 (también reversible), el DHAP se convierte en otro G-3-P. Aquí están las reacciones:
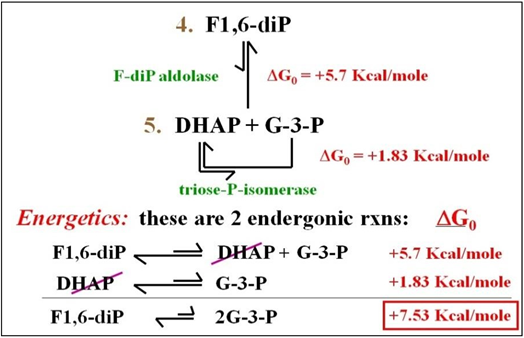
El resultado neto es la formación de dos moléculas de G-3-P en las últimas reacciones de la Etapa 1 de la glucólisis. Las enzimas F-dip aldolasa y triosa-P-isomerasa catalizan reacciones libremente reversibles. Además, ambas reacciones proceden con un cambio positivo de energía libre y, por lo tanto, son endergónicas. La suma de los cambios de energía libre para la división de F1,6 DiP en dos G-3-Ps es una friolera de +7.5 Kcal por mol, un proceso muy energéticamente desfavorable.
Resumiendo, al final de la Etapa 1 de la glucólisis, hemos consumido dos moléculas de ATP y dividido un carbohidrato 6C en dos carbohidratos 3-C. También hemos visto dos enzimas biológicamente irreversibles y reguladas alostéricamente.
B. Glucólisis, Etapa 2
Seguiremos solo una de las dos moléculas de G-3-P generadas al final de la Etapa 1 de la glucólisis, pero recordemos que ambas están pasando por la Etapa 2 de la glucólisis.
Reacción 6: Esta es una reacción redox. G-3-P se oxida a 1,3, ácido difosfoglicérico (1,3, DiPG) y NAD+ se reduce a NADH. La reacción catalizada por g de liceraldehído-3-fosfato deshidrogenasa se muestra a continuación.
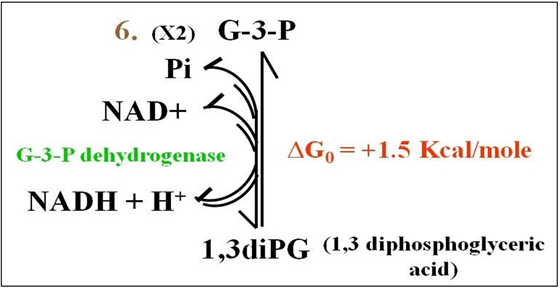
En esta reacción endergónica libremente reversible, se retira una molécula de hidrógeno (H 2) del G-3-P, dejando atrás el ácido fosfoglicérico. Este intermedio de oxidación de corta duración se fosforila para producir ácido 1,3 difosfoglicérico (1,3DiPG). Al mismo tiempo, la molécula de hidrógeno se divide en un ion hidruro (H -) y un protón (H +). Los iones H- reducen NAD + a NADH, dejando atrás los protones en solución. ¡Recuerda que todo esto está sucediendo en el sitio activo de la misma enzima!
Aunque cataliza una reacción reversible, la G-3-P deshidrogenasa está regulada alostéricamente. Sin embargo, a diferencia de la regulación de la hexoquinasa, ¡la de la G-3-P deshidrogenasa es más complicada! El regulador es NAD+ y el mecanismo de regulación alostérica de la G-3-P deshidrogenasa por NAD+ se llama cooperatividad negativa. Resulta que cuanto mayor sea el [NAD+] en la célula, menor será la afinidad de la enzima por más NAD+ y ¡más rápida será la reacción en la célula! El mecanismo se discute en el siguiente enlace.
154 Glicolisis Etapa 2; Reacción 6
Reacción 7: La reacción que se muestra a continuación es catalizada por fosfoglicerato quinasa. Es libremente reversible y exergónico, produciendo ATP y ácido 3-fosfoglicérico (3PG).
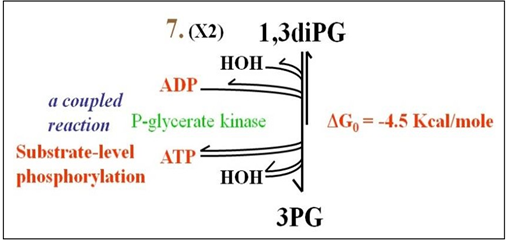
La catálisis de la transferencia de grupos fosfato entre moléculas por quinasas se denomina fosforilación a nivel de sustrato, a menudo la fosforilación de ADP para producir ATP. En esta reacción acoplada se utiliza la energía libre liberada al hidrolizar un fosfato a partir de 1,3 DiPG para elaborar ATP. Recuerda que esta reacción ocurre dos veces por glucosa inicial. Dos ATP se han sintetizado hasta este punto en la glucólisis. Llamamos a 1,3 DiPG un compuesto de fosfato de muy alta energía.
Reacción 8: Esta reacción endergónica libremente reversible mueve el fosfato del carbono número 3 de 3PG al carbono número 2 como se muestra a continuación.
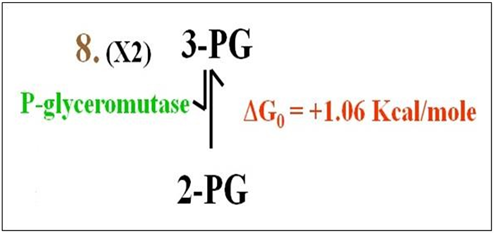
Mutasas como la fosglicerato mutasa catalizan la transferencia de grupos funcionales dentro de una molécula.
Reacción 9: En esta reacción (mostrada a continuación), la enolasa cataliza la conversión de 2PG en piruvato de fosfoenol (PEP).
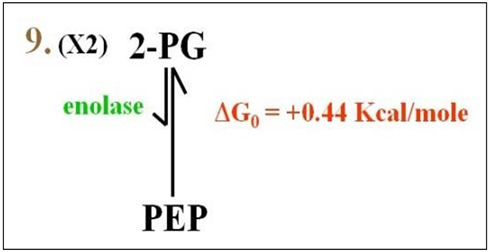
Reacción 10: Esta reacción da como resultado la formación de ácido pirúvico (piruvato), como se muestra a continuación. Recuerda nuevamente, se producen dos piruvatos por molécula de glucosa inicial.
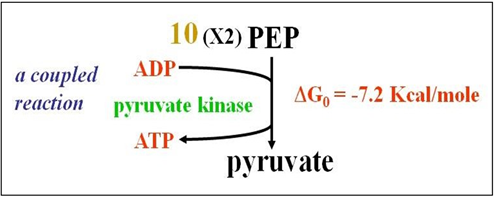
La enzima piruvato quinasa acopla la hidrólisis exergónica biológicamente irreversible de un fosfato de PEP y la transferencia del fosfato a ADP en una reacción acoplada. El producto de reacción, PEP, es otro compuesto fosfato de muy alta energía.
155 Glicolisis Etapa 2; Reacciones 7-10
La piruvato quinasa está regulada alostéricamente por ATP, ácido cítrico, ácidos grasos de cadena larga, F1,6 DiP y uno de sus propios sustratos, PEP.
En la glucólisis incompleta (aeróbica), el piruvato se oxida en las mitocondrias durante la respiración (ver los destinos alternos del piruvato arriba). Las fermentaciones se denominan glucólisis completa porque el piruvato se reduce a uno u otro producto final. Recordemos que la fatiga muscular resulta cuando el músculo esquelético utiliza la fermentación anaeróbica para obtener energía durante el ejercicio vigoroso. Cuando el piruvato se reduce a ácido láctico (lactato), la acumulación de ácido láctico provoca fatiga muscular. La enzima Lactato Deshidrogenasa (LDH) que cataliza esta reacción está regulada, pero no alostéricamente. ¡En cambio, diferentes tejidos musculares regulan la LDH haciendo diferentes versiones de la enzima! Haga clic en el enlace a continuación para obtener una explicación.
156 Fermentación: ¡La regulación de la reducción de piruvato NO es alostérica!
C. Balance Químico y Energético para la Glucólisis
Comparar los balances de glucólisis completa (fermentación) con ácido láctico y glucólisis incompleta (aeróbica), mostrando productos químicos y transferencias de energía.

Hay dos reacciones en la Etapa 2 de la glucólisis que producen cada una una una molécula de ATP. Dado que cada una de estas reacciones ocurre dos veces por molécula de glucosa inicial, la Etapa 2 de la glucólisis produce cuatro moléculas de ATP. Dado que la Etapa 1 consumió dos ATP, el rendimiento neto de energía química como ATP al final de la glucólisis es de dos ATP, ¡ya sean completos a lactato o incompletos a piruvato! Debido a que no pueden hacer uso del oxígeno, los anaerobios tienen que conformarse con las insignificantes 15 Kcal de ATP que obtienen de una fermentación. Dado que existen 687 Kcal potencialmente disponibles a partir de la combustión completa de un mol de glucosa, queda mucha más energía libre para ser capturada durante el resto de la respiración.
157 Balance general de la glucólisis
Recuerde también que la única reacción redox en la glucólisis aeróbica es en la Etapa 2. Esta es la oxidación de G-3-P, un intermedio glicolítico 3C. Ahora echa un vistazo a la reacción redox una vía de fermentación. Dado que el piruvato, también un intermedio 3C, se redujo, no ha habido oxidación neta de glucosa (es decir, intermedios glicolíticos) en la glucólisis completa.
En este momento, te habrás dado cuenta de que la glucólisis es una vía de reacción neta energéticamente favorable (cuesta abajo, espontánea) en un sistema cerrado, con un δGO negativo general. La glucólisis también es normalmente espontánea en la mayoría de nuestras células, impulsada por una constante necesidad de energía para hacer el trabajo celular. Así, la energía libre real de la glucólisis, o ΔG', también es negativa. De hecho, la glucólisis en células que respiran activamente procede con la liberación de más energía libre de la que lo haría en un sistema cerrado. En otras palabras, ¡el ΔG' para la glucólisis en células activas es más negativo que el ΔGO de la glucólisis!
Ahora, por un momento, veamos la gluconeogénesis, la Dieta Atkins y algunas circunstancias no tan normales cuando la glucólisis esencialmente va a la inversa, al menos en algunos tipos celulares. Bajo estas condiciones, la glucólisis es energéticamente desfavorable, y esas reacciones inversas son las que proceden con un ΔG' negativo!


