3.2: Enzimas
- Page ID
- 53397
Los catalizadores biológicos se llaman enzimas, y la abrumadora mayoría de las enzimas son proteínas. Las excepciones son una clase de moléculas de ARN conocidas como ribozimas, de las cuales la mayoría actúan sobre sí mismas (es decir, parte de la cadena de ARN es un sustrato para la parte de ribozima de la cadena). En este libro (y la mayoría de los libros de texto en este campo), a menos que se especifique lo contrario, el término enzima se refiere a uno hecho de proteína. Las enzimas confieren una especificidad extraordinaria a una reacción química: una reacción que pueda ocurrir entre una variedad de sustratos potenciales en una situación no catalizada solo puede permitirse entre dos sustratos específicos cuando es catalizada por una enzima. Las enzimas permiten que las células realicen reacciones químicas a velocidades de un millón a incluso un billón de veces más rápido de lo que las mismas reacciones se ejecutarían en condiciones similares sin enzimas. En algunos casos, las enzimas al - bajas reacciones para proceder que normalmente (es decir, sin enzima) requerirían temperatura, presión o acidez/alcalinidad más extremas. Finalmente, y quizás lo más importante para la vida, las enzimas pueden ser reguladas. Esto es crucial para la célula, ya que debe ser capaz de reaccionar ante diferentes situaciones, como la disponibilidad de energía, acumulación de subproductos tóxicos, la necesidad de reproducirse, etc. No solo las enzimas pueden modificarse covalentemente o no covalentemente para aumentar o disminuir su actividad, la célula también puede regular producción de las enzimas, proporcionando otro nivel de control sobre reacciones bioquímicas celulares particulares.
clasificación de enzimas
Las enzimas han sido catalogadas y clasificadas desde la década de 1950, tiempo durante el cual hubo una explosión de descubrimientos enzimáticos y la necesidad de una nomenclatura y catálogo unificados. Se estableció una Comisión Internacional de Enzimas y así se inició la Lista de Enzimas. Todas las enzimas ahora tienen nombres recomendados para uso común, a menudo reflejando nombres históricos, y un nombre sistemático, que es altamente específico. También cuentan con un número de clasificación en función de su actividad. Las principales clases de enzimas son
- Oxidorreductasas que llevan a cabo reacciones de oxidación-reducción,
- Transferasas que transfieren grupos funcionales,
- Hidrolasas que llevan a cabo reacciones de hidrólisis,
- Liasas que eliminan grupos para formar dobles enlaces,
- Iomerasas que reordenan los enlaces en una molécula pero que no agregan ni eliminan átomos, y
- Ligasas que forman enlaces en reacciones acopladas a hidrólisis de ATP.
Como ejemplo, la ADN ligasa (nombre recomendado) cataliza la formación de un enlace fosfodiéster entre el extremo 3' de un fragmento de ADN y el extremo 5' de otro. Su nombre sistemático bastante largo y tedioso es “poli (desoxirribonucleótido) :poli (desoxirribonucleótido) ligasa (formadora de AMP)” y su número de clasificación es 6.5.1.1. Como ligasa, es clase 6; debido a que forma enlaces éster fosfórico, es la subclase 5; la subclase de 1 en este caso carece de sentido porque es la única subclase de ligasas formadoras de enlaces fosforiceros, pero el número final designa la ADN ligasa por separado de otras enzimas 6.5.1 como el ARN ligasa, que es 6.5.1.3.
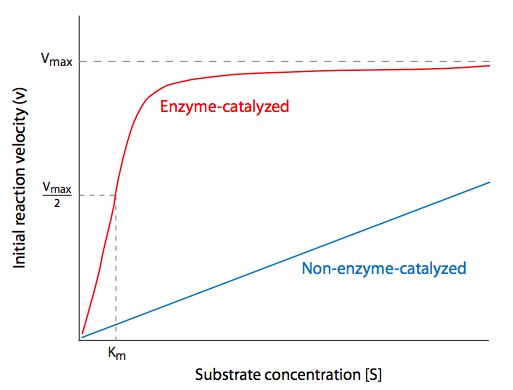
Las enzimas son el tipo de proteína más diverso en una célula. Varían no sólo en tamaño, sino también en el número de subunidades fabricadas independientemente que deben unirse para formar una enzima activa, u holoenzima. Parte de la razón para requerir tantas enzimas diferentes es que suelen ser muy específicas para sus moléculas de sustrato, y esa especificidad se basa en una combinación de forma y carga. Las interacciones entre el sustrato y la enzima a menudo se asemejan a una cerradura y llave o piezas de un rompecabezas. Si el sustrato se ajusta a la forma del sitio activo de la enzima (la parte de la enzima que lleva a cabo la reacción catalítica real), y las cargas interactúan (por ejemplo, aminoácidos cargados positivamente en la enzima que se alinean con cargas negativas en el sustrato), entonces puede haber una estabilización adicional del interacción por Van der Waals e interacciones de enlaces de hidrógeno. De hecho, la formación de un intermedio estable Enzima-Sustrato (ES) es energéticamente análoga al estado de transición (Figura\(\PageIndex{2}\)) de las reacciones.
La especificidad de las enzimas es tal que los estereoisómeros pueden no ser reconocidos por algunas enzimas: por ejemplo, una proteasa (enzimas que descomponen proteínas en trozos más pequeños hidrolizando los enlaces peptídicos entre aminoácidos específicos) como la tripsina se puede impedir por la presencia de un D-aminoácido en lugar del L-aminoácido habitual en una proteína, a pesar de que es una imagen especular del mismo aminoácido. Esta especificidad significa que las enzimas son altamente selectivas con respecto a las reacciones que catalizan, lo que significa que las reacciones específicas pueden mejorarse mucho sin causar un aumento general en muchas reacciones químicas relacionadas. Otra implicación de la alta especificidad es que las enzimas pueden (y a menudo lo hacen) tener alta afinidad por sus sustratos sin el problema de unirse a moléculas no sustrato (que no sean inhibidores específicos - ver más abajo).
Si la mayoría de las reacciones bioquímicas procedieran de manera extremadamente lenta, si acaso, sin catálisis, se necesitan enzimas para disminuir la energía de activación necesaria para que las reacciones químicas soporten la vida. Exactamente, ¿cómo disminuye una enzima la energía de activación de una reacción? ¿Qué significa exactamente “energía de activación” en el contexto de una célula? Para entender esto, hay dos principios a tener en cuenta: primero, cuando hablamos de reacciones químicas, generalmente, nos preocupan poblaciones de moléculas de sustrato, producto y enzimas, no individuos; y segundo, las reacciones generalmente se están produciendo entre moléculas disueltas en el acuoso citoplasma de la célula.
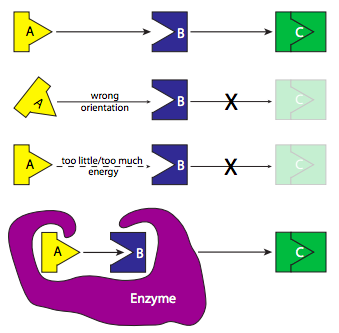
Considera una reacción en la que los sustratos A y B interactúan para formar el producto C (Figura\(\PageIndex{3}\)). Si esta reacción no es catalizada, depende de la casualidad de que una molécula de A se encuentre con una molécula de B en la orientación justa, y con la cantidad correcta de energía, para reaccionar y formar la nueva molécula. Podemos conceptualizar la “energía de activación” como la dificultad de unir A y B perfectamente para que la reacción pueda continuar. ¿Cómo podría una enzima disminuir esta energía de activación? Al facilitar que A y B se encuentren con la orientación y la energía adecuadas. Entonces podría tener sitios de unión para la molécula A y la molécula B, y una vez que se ha unido a estas dos moléculas, cambia su conformación, juntando A y B en las condiciones exactamente adecuadas para reaccionar y formar C. Una vez completada la reacción, el producto flota porque la enzima no tiene afinidad por ella, y la enzima vuelve a su forma inicial, lista para unirse a más sustratos.
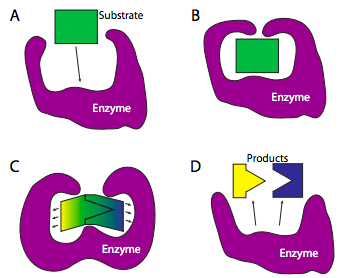
Las enzimas también pueden facilitar una reacción química al actuar como un sitio de retención temporal para un grupo activo que se transfiere de un sustrato a otro. Alternativamente, la formación temporal de enlaces de hidrógeno o incluso enlaces covalentes entre la enzima y el sustrato puede alterar las características químicas del sustrato para hacerlo reaccionar más fácilmente. Un ejemplo de mecanismos enzimáticos a nivel molecular se muestra en el Capítulo 5: Figura\(\PageIndex{1}\).
Otro ejemplo se puede encontrar con enzimas que rompen una molécula (Figura\(\PageIndex{4}\)). Para que una molécula se rompa, puede necesitar chocar con otra molécula con suficiente energía para romper uno o más de sus enlaces covalentes. Una enzima que cataliza la reacción de descomposición podría unirse a la molécula, y al unirla, experimenta un cambio conformacional que dobla o tuerce la molécula de tal manera que los enlaces en la molécula sustrato se debilitan o se rompen. Estos dos ejemplos simplifican demasiado la química de la actividad enzimática en una idea mecánica, pero la relación general en cómo una enzima disminuye la energía de activación para una reacción es precisa.