4.1: Estructura y composición de la membrana
- Page ID
- 53438
Dado que la mayoría de las células viven en un ambiente acuoso y los contenidos de la célula también son en su mayoría acuosos, es lógico pensar que una membrana que separa un lado del otro debe ser hidrófoba para formar una barrera efectiva contra fugas accidentales de materiales o agua. En el capítulo anterior sobre las biomoléculas básicas, las membranas celulares se definieron parcialmente como compuestas principalmente por fosfolípidos: moléculas consistentes en un grupo de cabeza polar fosforilado unido a una cadena principal de glicerol que tiene dos largas colas de hidrocarburos. La composición de los hidrocarburos puede variar en longitud y grado de saturación, y también hay variación en los grupos principales. También es importante recordar que aunque nos concentramos en los fosfolípidos como componentes primarios de la membrana, existen otras partes significativas: otros lípidos, incluyendo colesterol, proteínas de membrana integral y periférica, y lípidos y proteínas glicosilados.
Debido a que los fosfolípidos son anfipáticos, es decir, tienen una cabeza hidrofílica y una cola hidrofóbica, podría esperarse que la conformación más simple para un pequeño grupo de fosfolípidos en solución acuosa sea una micela (Figura\(\PageIndex{1}\) A), pero ¿es este realmente el caso? Las mezclas de moléculas hidrófobas y agua son termodinámicamente inestables, por lo que esta estructura protegería las colas de acilo graso hidrófobas del ambiente acuoso con el que interactúan los grupos cabeza. Las micelas se pueden formar con otros lípidos anfipáticos, siendo los más reconocibles los detergentes como el SDS (dodecilsulfato de sodio, también llamado laurilsulfato de sodio), utilizados en productos domésticos comunes como los champús. Los detergentes actúan rodeando la suciedad hidrofóbica (1B) y manteniéndola en solución dentro de la micela para ser enjuagada con el agua. En tamaños más pequeños, la micela es bastante estable; sin embargo, cuando hay una gran cantidad de fosfolípidos, el espacio dentro de la micela se hace más grande y puede atrapar agua en contacto directo con las colas hidrófobas (1C). Esto hace que la micela sea inestable, por lo que es poco probable que una sola capa grande de fosfolípido sirva de manera estable como membrana biológica. Las micelas se forman fácilmente con SDS y otros lípidos de cola simple porque su forma general (envoltura de van der Waals) es cónica (1D), lo que se presta para adaptarse a curvaturas apretadas. Sin embargo, los fosfolípidos son más cilíndricos, y es más difícil introducirlos en una micela esférica apretada. Si forman micelas, tienden a ser más grandes, y es probable que colapse.
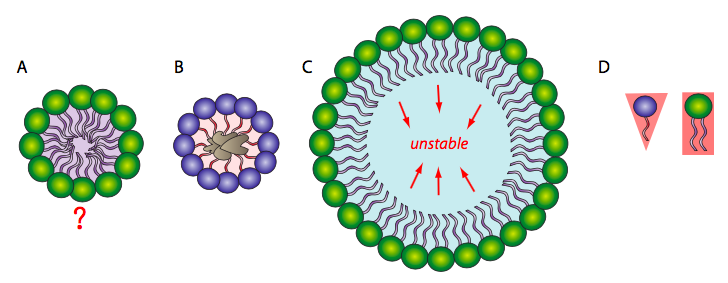
Por otro lado, una bicapa de fosfolípidos (Figura\(\PageIndex{2}\) A) podría formar un sándwich de acilo graso en el que los grupos de cabeza polar se orientan hacia afuera para interactuar con un ambiente acuoso, y los ácidos grasos son secuestrados entre ellos. Sin embargo, esto no resuelve el problema en los bordes del sándwich. En ocasiones, una micela colapsada puede formar una bicapa cerrada en la que los bordes parecen estar sellados, pero debido a la forma de los fosfolípidos, existe un mal contacto entre las cadenas de acilo. Una curva tan apretada es inestable y es probable que los fosfolípidos del borde se rompan entre sí. Entonces, la solución a la estructura ideal de fosfolípidos en un ambiente acuoso es una bicapa esférica de fosfolípidos (2B y recortada en 2C): sin bordes significa que no hay hidrofobicidad expuesta.
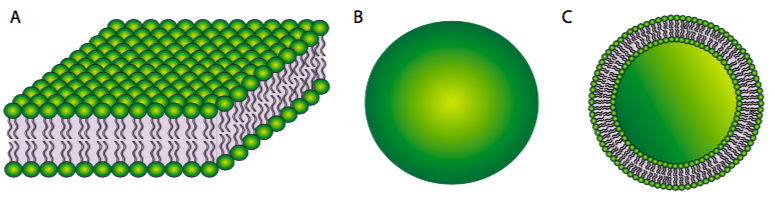
Figura\(\PageIndex{2}\).
La estabilidad de la bicapa esférica de fosfolípidos no implica que sea estática en sus propiedades físicas. En la mayoría de las condiciones fisiológicamente relevantes, la membrana es cohesiva, pero fluida. Puede moldear su superficie a los contornos de lo que sea sobre lo que esté descansando, y las mismas propiedades termodinámicas e hidrofóbicas que la hacen tan estable también le permiten sellar lágrimas menores espontáneamente. Mantener un rango de fluidez de trabajo es importante para la célula: si la membrana es demasiado rígida, entonces puede ser incapaz de moverse o someterse a procesos necesarios como la endocitosis, en la que una célula toma grandes moléculas extracelulares envolviéndolas con la membrana celular y pellizcándolas en una vesícula; mientras que si se vuelve demasiado fluido, puede perder integridad y desmoronarse.
Hay tres factores principales que rigen la fluidez de la membrana:
- grado de saturación de las cadenas de acilo graso,
- la temperatura, y
- la concentración de colesterol.
Así como las micelas demasiado grandes serán inestables, también hay una concentración mínima de lípidos necesaria para que se forme una micela. Esto se conoce como la concentración micelar crítica (cmc) y es una propiedad de cada lípido en particular. Por debajo del cmc, no hay suficientes lípidos anfipáticos para proteger mutuamente sus colas hidrófobas del agua, y la posición más probable de los lípidos está en la superficie de la solución acuosa, cabezas hidrofílicas en contacto, con las colas hidrófobas en el aire.
Los liposomas son bicapas esféricas artificiales (Figura\(\PageIndex{2}\)) que se utilizan tanto en investigación para el estudio de lípidos de membrana como de proteínas integrales de membrana. También se utilizan para administrar fármacos y otras macromoléculas en las células para cualquier investigación con fines terapéuticos. Un método común para obtener ADN, una molécula grande que normalmente no se transporta a las células, a una célula se llama lipofección. Esta técnica implica la creación de liposomas dentro de una solución que contiene el ADN de interés. Esto atrapa el ADN en el liposomas, que luego se puede aplicar a las células. Los liposomas luego se fusionan con la membrana plasmática y entregan el ADN a la célula.
Otra técnica para introducir ADN extraño en una célula es la electroporación, que ilustra la propiedad autosellante de la bicapa fosfolipídica (Figura\(\PageIndex{3}\)). La célula (generalmente miles de células, en realidad) se coloca en una solución de ADN y se somete a una corriente eléctrica. Esto tira transitoriamente de la membrana celular en todas las direcciones, provocando que se abran muchos agujeros pequeños. Luego, el ADN se mueve hacia la célula, y los agujeros curan espontáneamente. Por supuesto, el proceso no es perfecto, y debido a las variaciones en las celdas y en el campo eléctrico, algunas celdas no podrán volver a sellar los agujeros, o por otras razones pueden no sobrevivir al proceso.
Las cadenas de acilo graso completamente saturadas pueden rotar libremente alrededor de cualquier enlace y, por lo tanto, pueden empaquetarse muy estrechamente, disminuyendo así la uididad de la membrana A medida que se introducen más cadenas de acilo graso insaturado en la membrana, más espacio hay entre algunas de las colas de acilo graso, y hay un aumento en la fluidez. De manera similar a temperaturas más altas, incluso las cadenas de acilo graso saturadas, con su mayor energía, se mueven más y crean más espacio entre las cadenas, aumentando también la fluidez. Finalmente, el colesterol, como una pequeña molécula lipídica plana, puede intercalarse entre las colas de acilo graso. Curiosamente, en temperaturas fisiológicas normales, el efecto del colesterol depende de su concentración. A concentraciones normales, el colesterol restringe el movimiento de la cola de acilo y disminuye la fluidez. Sin embargo, a concentraciones muy bajas, el colesterol tiene el efecto contrario, separando las colas hidrófobas y aumentando ligeramente la fluidez, especialmente en las regiones más internas de la membrana. [Por si te lo preguntabas, los problemas médicos humanos con el colesterol no están relacionados con el colesterol en las membranas celulares, y se refiere al colesterol (unido a portadores de lipoproteínas) en el torrente sanguíneo. Ese colesterol puede acumularse en los vasos sanguíneos, disminuyendo el diámetro interno y junto con él, el flujo sanguíneo. Cuando esto le sucede al corazón, que usa mucho oxígeno, la privación de oxígeno puede causar necrosis y un ataque al corazón.]
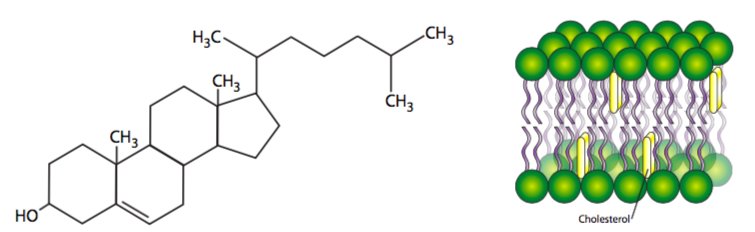
El efecto del colesterol es en realidad un poco más complicado de lo explicado anteriormente. El colesterol no solo es plano sino rígido, y se intercala cerca entre las colas de acilo cerca de la región de la cabeza. Ser causa el colesterol es algo más corto que muchas colas de acilo, mientras que las partes de las cadenas de hidrocarburos más cercanas a los grupos de cabeza están estabilizadas y restringidas en movimiento, el colesterol en realidad actúa como espaciador para el otro extremo (metilo) de cada cadena, por lo que en el dominio central del núcleo hidrófobo del bicapa, en realidad hay mayor fluidez alrededor de los colesteroles. La concentración de colesterol varía mucho entre los orgánulos de la misma célula, e incluso puede regularse dinámicamente en respuesta a los cambios de temperatura. Las muestras de membrana tomadas de peces que viven en temperaturas más cálidas contienen más colesterol que las muestras de la misma especie aclimatadas a una temperatura más baja.
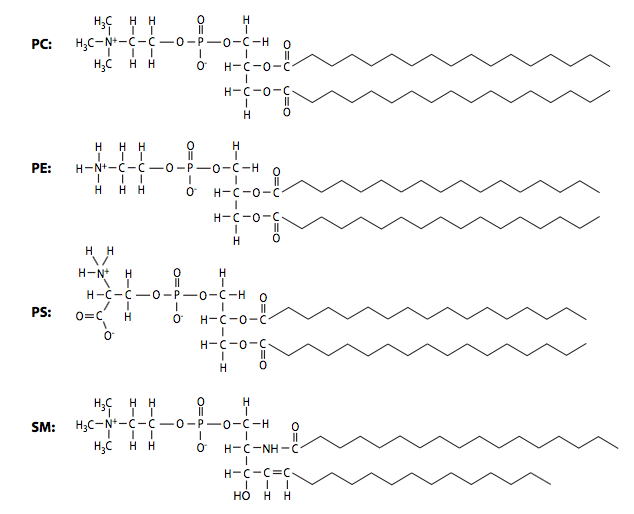
Además de los tres factores señalados anteriormente, la composición de fosfolípidos también puede alterar la fluidez de la membrana: las cadenas acilo más cortas conducen a una mayor fluidez, mientras que las cadenas más largas, con más área superficial para la interacción, generan membranas con mayor viscosidad. La composición de fosfolípidos de las membranas biológicas es dinámica y puede variar ampliamente. La siguiente tabla muestra las diferencias en las proporciones de las especies principales de fosfolípidos fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidilserina (PS) y esfingomielina (SM) en membranas plasmáticas de dos tipos celulares diferentes. Como cabría esperar en función de sus diferentes funciones, las proporciones de lípidos de la membrana plasmática de una célula de Schwann mielinizante son muy diferentes de los lípidos en la membrana plasmática de un glóbulo rojo.
| Lípido | Celda Schwann PM | PM eritrocitario |
|---|---|---|
| Fosfatidilcolina | 44% | 19% |
| Fosfatidiletanolamina | 14% | 18% |
| Fosfatidilserina | 3% | 8% |
| Esfingomielina | 29% | 17% |
Incluso dentro de una sola célula, la composición de la membrana plasmática difiere de la de los orgánulos intracelulares. Incluso hay heterogeneidad dentro de una membrana misma: los lípidos no se distribuyen simplemente al azar en la membrana. Las investigaciones realizadas en las últimas dos décadas han identificado “balsas” lipídicas que parecen ser especi c para incrustar proteínas particulares. Dado que son lípidos no anclados, las balsas pueden moverse lateralmente dentro de la membrana al igual que la mayoría de las moléculas lipídicas individuales. Finalmente, existen diferentes proporciones de los lípidos entre las dos capas de la bicapa. La cara citoplasmática de cada membrana tendrá diferentes asociaciones y funciones que la cara no citoplásmica, entonces, ¿por qué deberíamos esperar que la composición lipídica sea la misma?
Aunque las balsas lipídicas fueron consideradas una posibilidad en el modelo de membrana fluido-mosaico propuesto por Singer y Nicholson en 1972, solo en las últimas dos décadas se ha investigado seriamente la idea, pero ha habido dificultades técnicas para visualizar un pequeño dominio de lípidos dentro de un océano virtual de lípidos. En términos generales, las balsas se consideran pequeñas áreas de lípidos ordenados dentro de una membrana no dirigida más grande. Las balsas lipídicas se forman con mayor frecuencia en asociación con proteínas de membrana específicas mientras que excluyen otras Algunas de las proteínas son proteínas de membrana periférica como src o la molécula de adhesión ligada a GPI Thy-1, mientras que otras son proteínas transmembrana como el receptor de células T. Por lo general, las proteínas incluidas tienen funciones relacionadas con la señal, y un modelo propone que estas proteínas pueden dirigir la organización de lípidos seleccionados alrededor de ellas, en lugar de al revés.
Aunque algunos fosfolípidos están directamente ligados a las proteínas y al citoesqueleto, la mayoría no lo están, y por lo tanto son libres de moverse dentro del plano de su capa de la bicapa. En el experimento que se muestra en la Figura\(\PageIndex{6}\) siguiente, la superficie celular se ha marcado con un colorante unido covalentemente que fluoresce rojo cuando se excita por la luz verde. Cuando las moléculas de tinte se exponen a luz de alta intensidad durante un periodo prolongado, dejan de emitir fluorescencia, fenómeno conocido como fotoblanqueo. El fotoblanqueo es un efecto permanente, y por lo tanto se puede inferir que si una mancha fotoblanqueada vuelve a emitir fluorescencia, entonces otros fosfolípidos, no blanqueados, deben haberse movido al lugar. Este experimento demuestra claramente la movilidad lateral de los fosfolípidos en una membrana.
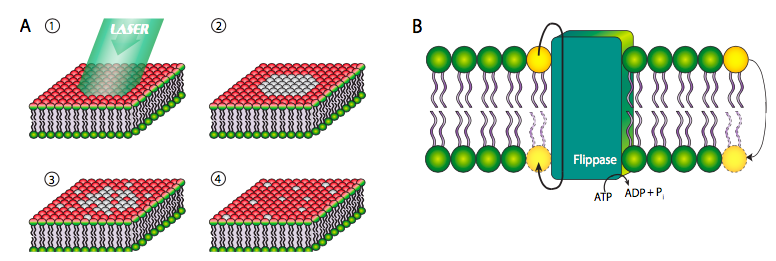
Sin embargo, este no es el caso de la movilidad transversal de una cara de la membrana a la otra. Debido a la energía altamente desfavorable de empujar un grupo de cabeza polar a través de las capas de cola lipídica, los fosfolípidos rara vez se mueven de una capa a otra dentro de una membrana (Figura\(\PageIndex{6}\) B, fosfolípido amarillo del extremo derecho). Dicho movimiento se ve facilitado en gran medida por una enzima ippasa, que hidroliza una molécula de ATP para que la energía empuje un fosfolípido de una cara de la bicapa a la otra.
En una bicapa de fosfolípidos puros, tanto las proteínas de membrana como los lípidos tienen movilidad lateral, pero en las células vivas, las proteínas generalmente están restringidas ya sea por asociación preferencial con ciertos tipos de lípidos, por unión directa a elementos citoesqueléticos, por unión directa al citoesqueleto, o por estar “cercado” por la red citoesquelética directamente subyacente a la membrana celular. Desde 1972, el modelo Singer-Nicholson “mosaico de fluidos” de estructura de membrana ha sido aceptado como modelo general para membranas biológicas. Propone que las proteínas integrales de membrana así como los lípidos de membrana tienen libertad lateral de movimiento. Esto ha sido modificado con el reconocimiento de balsas lipídicas y parches de proteínas de membrana agrupadas, pero sigue siendo viable como modelo básico.
Durante más de un siglo desde que Meyer (1899) y Overton (1901) lo sugirieron por primera vez, la teoría predominante para el mecanismo de la anestesia general gaseosa (por ejemplo, éter etílico, halotano, óxido nitroso, ciclopropano) ha sido que se dividen e interactúan con los lípidos de las membranas plasmáticas de las neuronas y por alterando las propiedades físicas de la membrana lograr la anestesia. No obstante, en 1985, Franks y Lieb publicaron un reporte en Nature que, por primera vez, demostró que una enzima podría verse directamente afectada por un anestésico gaseoso. Desde ese reporte, la evidencia se ha ido construyendo contra el viejo modelo de alteración de las propiedades lipídicas de membrana, y ahora se asume el modelo actual de interacción directa gas-proteína.


