6.4: Gluconeogénesis
- Page ID
- 53170
Habiendo considerado la reacción anabólica inicial de la vida - la fijación de carbono por fotosíntesis, ahora volvemos nuestra atención a utilizar los metabolitos más pequeños para generar glucosa y otros azúcares e hidratos de carbono. La glucosa es el combustible más importante para la mayoría de los organismos, y el único combustible para algunos tipos de células, como las neuronas cerebrales. Los bloques de construcción potenciales de la glucosa incluyen muchos de los productos e intermedios de la glucólisis y el ciclo de TCA, así como la mayoría de los aminoácidos. La reacción clave es la conversión de cualquiera de estos compuestos en oxaloactetato antes de usarlos para producir glucosa. En los animales, los aminoácidos leucina e isoleucina, así como cualquier ácido graso, no pueden usarse para construir glucosa porque primero se convierten en acetil-CoA, y los animales no tienen vía para la conversión de acetil-CoA a oxaloacetato. Las plantas, por otro lado, pueden empujar acetil-CoA a oxaloacetato a través del ciclo del glioxilato, que se discutirá en breve.
El proceso de gluconeogénesis es en muchos sentidos el simple opuesto de la glucólisis, por lo que no es sorprendente que algunas de las enzimas utilizadas en la glucólisis sean las mismas que las utilizadas para la gluconeogénesis. No obstante, hay algunas excepciones. Estos surgieron (y probablemente han evolucionado) por dos razones principales-
- la termodinámica de la reacción es prohibitiva, y
- la necesidad de un control independiente de los procesos catabólicos y anabólicos.
Dado que existe este paralelo, primero exploraremos la gluconeogénesis comenzando con uno de los principales productos de la glucólisis, el piruvato. El piruvato se puede convertir en oxaloacetato por la piruvato carboxilasa, en una reacción que requiere hidrólisis de ATP. El oaxaloacetato es luego convertido en fosfoenolpiruvato (PEP) por PEP carboxiquinasa, que también utiliza hidrólisis de nucleótidos trifosfato para obtener energía, aunque esta vez es GTP.
Curiosamente, la PEP carboxiquinasa (PEPCK) no está regulada a nivel proteico. No se conocen activadores o inhibidores de su actividad. La única regulación de PEPCK parece estar a nivel de transcripción: el glucagón puede estimularlo (al igual que los gluocorticoides y la hormona tiroidea), mientras que la insulina puede inhibirla. Las otras enzimas gluconeogénicas, sin embargo, tienen activadores e inhibidores directos. Son moduladores alostéricos, que se unen lejos de, pero influyen en la forma y eficacia del sitio de unión al sustrato. Al examinar la regulación de estas enzimas, destaca un importante regulador porque no es un metabolito ni de la glucólisis ni de la gluconeogénesis. La fructosa-2,6-bisfosfato (F2,6P) es un activador de la fosfofructoquinasa y un inhibidor de la fructosa bis-fosfatasa. Los niveles de F2,6P están controlados por fructosa-bis-fosfatasa-2 y fosfofructoquinasa-2, que a su vez están controlados por niveles de fructosa-6-fosfato, así como a través de una cascada de señalización impulsada por hormonas que se muestra en la Figura de la página siguiente.
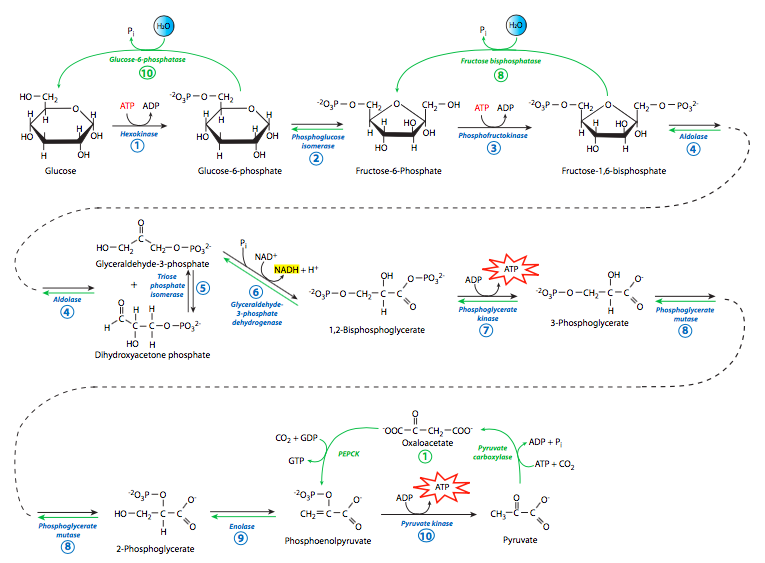
Como se muestra en el resumen/comparación (Figura\(\PageIndex{8}\)), desde la formación de PEP hasta la formación de fructosa-1,6-bisfosfato las enzimas utilizadas en la gluconeogénesis son exactamente las mismas enzimas utilizadas en la glucólisis. Esto funciona porque el cambio de energía libre en esas reacciones es relativamente pequeño. Sin embargo, en la desfosforilación de fructosa-1,6-bisfosfato a fructosa-6-fosfato, y posteriormente en la desfosforilación de glucosa-6-fosfato a glucosa, hay un gran cambio de energía libre que actúa contra las reacciones gluconeogénicas. Así, las enzimas que impulsan estas reacciones son diferentes de las enzimas que impulsan las reacciones inversas en la glucólisis (es decir, hexoquinasa, fosfofructoquinasa). Estas dos reacciones hidrolíticas son catalizadas por fructosa bis-fosfatasa y glucosa-6-fosfatasa, respectivamente. La inversión total de la glucólisis en animales está limitada, sin embargo, a hígado y riñón, ya que son los únicos tejidos que expresan glucosa-6-fosfatasa. Otros tejidos utilizan diferentes mecanismos para generar glucosa (por ejemplo, glucogenólisis).
El ciclo del glioxilato proporciona un mecanismo para que las plantas conviertan acetil-CoA en oxaloacetato, y por lo tanto contribuyan a la gluconeogénesis. Esto les permite convertir los ácidos grasos y los aminoácidos hidrófobos leucina e isoleucina en glucosa cuando sea necesario. La capacidad de hacer esto proviene de un orgánulo específico de planta llamado glioxisoma, así como de algunas enzimas mitocondriales. La parte glioxisómica del ciclo consta de ve etapas, de las cuales las tres primeras contribuyen a la conversión, mientras que las dos últimas etapas regeneran el oxaloacetato glioxisómica (Figura\(\PageIndex{9}\)).
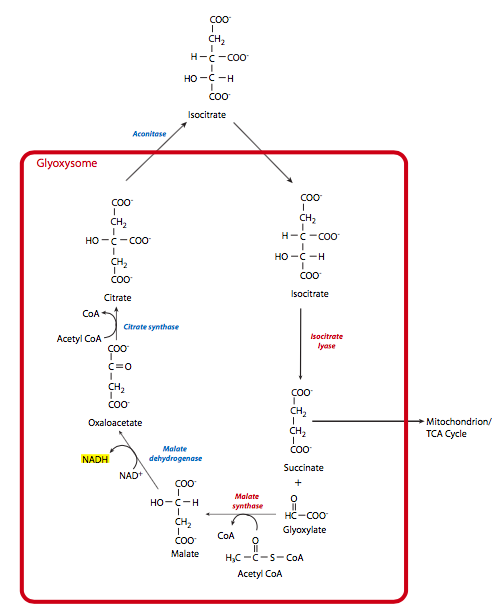
- Una vez que las macromoléculas se han descompuesto en acetil-CoA, ingresan al glioxisoma y se combinan con oxaloacetato para producir citrato. Esto es catalizado por la citrato sintasa al igual que en el ciclo de TCA mitocondrial. La siguiente reacción también utiliza una enzima familiar: la aconitasa cataliza la conversión de citrato en isocitrato. Sin embargo, la aconitasa es una enzima citosólica, por lo que el citrato se transporta fuera del glioxisoma y luego el isocitrato se transporta de nuevo hacia adentro.
- En este punto, la enzima glioxisómica específica, la isocitrato liasa, hidroliza el isocitrato para producir succinato y glioxilato. El succinato se transporta a la mitocondria, donde las enzimas del ciclo TCA lo convierten en fumarato y luego malato, que se transporta hacia el citosol. En el citosol, el malato se convierte en oxaloactetato a través de malato deshidrogenasa, y la gluconeogénesis puede continuar.
- El glioxilato es actuado por otra enzima glioxisómica, la malato sintasa, que lo agrega a acetil-CoA para formar malato.
- El paso final de la porción glioxisómica del ciclo de glioxilato es la oxidación del malato a oxaloacetato por malato glioxisómica deshidrogenasa.
Entonces, para resumir, se usa el charco de oxaloacetato dentro del glioxisoma y se regenera dentro del glioxisoma. El acetil-CoA se convierte en succinato dentro del glioxisoma, pero luego va a la mitocondria para la conversión a malato, y finalmente al citosol para la conversión a un conjunto separado de oxaloacetato que luego se usa en la gluconeogénesis.


