14.3: Receptores 7-TM (acoplados a proteína G)
- Page ID
- 53411
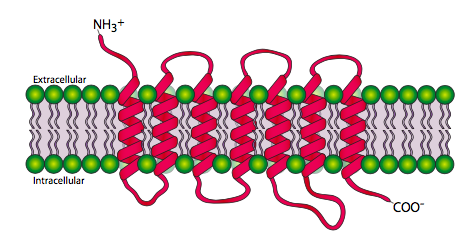
Los receptores 7-transmembrana, o receptores acoplados a proteína G son, como era de esperar, una familia de proteínas que pasan a través de la membrana celular 7 veces. El terminal amino es extracelular y el terminal carboxilo es intracelular. La figura\(\PageIndex{2}\) muestra las regiones transmembranales extendidas para mayor claridad, pero los dominios transmembrana realmente se forman juntos en forma más cilíndrica.
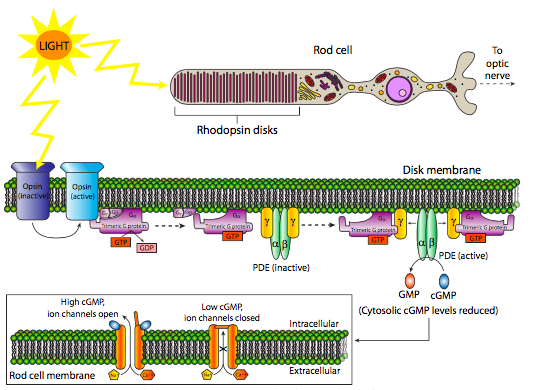
Las proteínas 7-TM se utilizan como receptores para neurotransmisores como la epinefrina (receptor β-adrenérgico), la acetilcolina (receptor muscarínico) y la serotonina, así como hormonas como el glucagón o la hormona estimulante de la tiroides, e incluso ligandos no moleculares como la luz! Las rodopsinas son una clase de receptores 7-TM que se activan cuando absorben un fotón (Figura\(\PageIndex{5}\)). La activación de esta familia de receptores, ya sea por fotón o por unión a ligando más convencional, induce un cambio conformacional en el dominio citoplásmico que altera la interacción entre el receptor y un complejo proteico conocido como proteína G heterotrimérica.
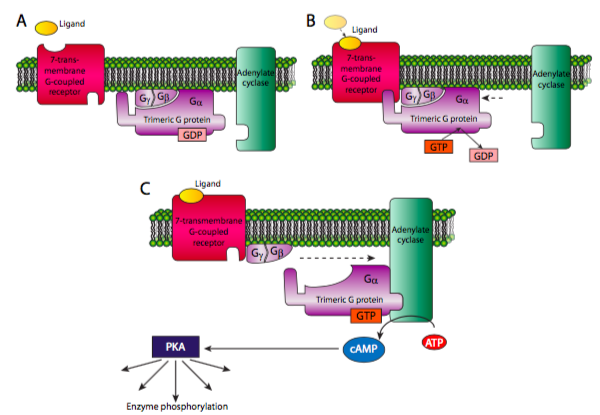
La proteína G heterotrimérica consiste en una subunidad a, b y g, de las cuales la subunidad a puede unirse a GTP o GDP, y puede hidrolizar GTP a GDP. Cuando el receptor 7-TM está inactivo, el complejo de la proteína G suele estar cerca asociado con la membrana por miristoilación o palmitoilación de la subunidad a y farnesilación o geranilgeranilación de la subunidad g. Una vez activado el receptor 7-TM, se asocia con la proteína G heterotrimérica, lo que provoca que el Ga suelte el GDP y se una a un GTP. Esto disocia entonces la Ga de las otras dos subunidades. Luego se puede asociar y activar una enzima para expandir la cascada de señalización. Una de las dos vías clásicas comienza con la activación de Ga de la adenilato (adenilil) ciclasa. La adenilato ciclasa (AC) convierte el ATP en AMPc. Dado que el ATP es abundante y la AC es una enzima relativamente rápida, el primer ampli catión de la señal viene con la generación de la molécula “segundo mensajero” AMPc. Cada molécula de cAMP puede entonces activar otras enzimas, siendo la principal proteína quinasa A. PKA puede fosforilar una variedad de sustratos para alterar la actividad celular por expresión génica, motores moleculares o cambios metabólicos.
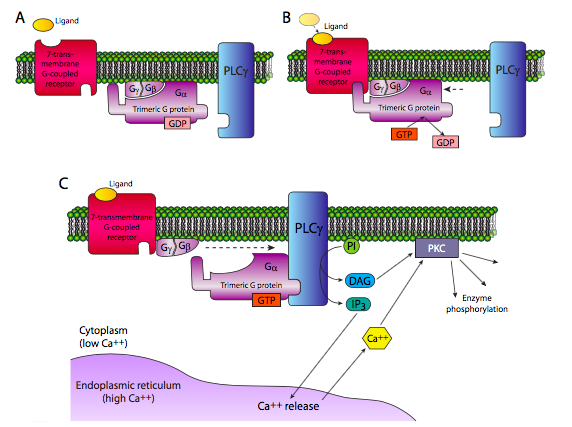
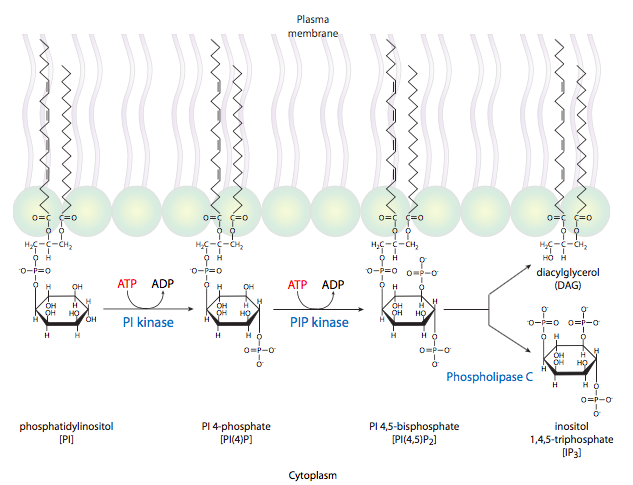
La otra vía clásica para los receptores 7-TM es la activación de la fosfolipasa Cb, también por Ga. En realidad, el PLCb produce dos moléculas de segundo mensajero: hidroliza fosfatidilinositol en diacilgilcerol (DAG) e inositol trifosfato (IP 3). IP 3 induce principalmente la liberación de Ca 2+ del retículo endoplásmico. El DAG puede activar la proteína quinasa C. PKC también es activada por Ca 2+ y tanto Ca 2+ como DAG pueden activar PKC sinérgicamente. La proteína quinasa C es una importante quinasa central que se ha demostrado que fosforila y controla la actividad de muchas otras enzimas, desde elementos citoesqueléticos hasta factores de transcripción.
Una variación interesante de las vías clásicas 7-TM comienza con los receptores de rodopsina en células bastoncillos. Estos receptores se unen a fotones para su activación y se acoplan a una proteína G heterotrimérica. El Ga-GTP luego se une a la subunidad g de la fosfodiesterasa (PDE), activándola y catalizando la conversión de GMPc a GMP. A medida que disminuye el cGMP, los canales iónicos se cierran, polarizando la membrana y cambiando la señal de la célula bastón al cerebro (a través de neuronas de conexión).
Los segundos mensajeros deben tener dos propiedades. Deben ser lo suficientemente pequeñas para difundirse de manera efectiva, y la célula debe ser capaz de generarlos rápidamente. Ca 2+ y cAMP entran en esta categoría. Además, ambos se pueden eliminar de la circulación con bastante rapidez: el primero por bombas de Ca 2+ en el ER y Golgi, y el segundo por la actividad fosfodiesterasa. Cuando se descubrió la vía de la proteína G, el uso de segundos mensajeros lipídicos fue sorprendente. Los fosfolípidos de membrana fueron ignorados en gran medida en ese momento como componentes estáticos simples de las membranas. Ahora está claro que algunos de los fosfolípidos son bioquímicamente activos, con varias enzimas que los modifican, incluyendo fosfolipasas, fosfolípidos quinasas y fosfolipidos fosfatasas. Algunas de estas enzimas tienen una variedad de funciones debido a que su sustrato de producto puede ser una molécula mensajera importante. Por ejemplo, la PI3K (fosfatidilinositol-3-quinasa) es una quinasa de señalización central porque su producto, PIP3 (fosfatidilinositol (3,4,5) -trifosfato) es un activador para Akt/PKB y otras enzimas que pueden activar varias vías de señalización.
La activación debe terminar eventualmente, y lo hace cuando Ga hidroliza el GTP unido a él. De esta manera, el Ga actúa como una especie de temporizador para la cascada de señalización. Esto es importante porque para que la señalización sea efectiva, debe controlarse estrechamente. Muy temprano en este curso, se señaló que el Ca 2+ se mantiene a una concentración muy baja en el citoplasma de la célula porque queremos que los mecanismos sensibles al Ca 2+ puedan reaccionar rápidamente ante una afluencia de calcio, pero igualmente queremos poder apagar rápidamente la señal como necesario, y eso obviamente es mucho más fácil de hacer secuestrando una pequeña cantidad de Ca 2+ que mucha de ella. De manera similar, si se requiere la actividad sostenida de una célula receptora, se logra mediante la activación continua del receptor y no por un efecto duradero a partir de una sola activación. Esto asegura que si un efecto celular debe ser abrupta y rápidamente cortado, se puede lograr sin un periodo de retraso significativo entre el cese de la secreción hormonal y el cese de la señalización intracelular.
El receptor también forma parte de otro mecanismo de cierre: para evitar la sobreestimulación, los receptores se desensibilizan por poco tiempo después de que se hayan activado. La quinasa receptora acoplada a proteína G (GRK) phos- forila el receptor 7-TM. La fosforilación crea sitios de reconocimiento para arrestinas. Las arrestinas tienen una variedad de funciones, la más simple de las cuales es actuar como un inhibidor competitivo de la unión a proteínas G por el receptor. Se trata de una desensibilización de vida relativamente corta.
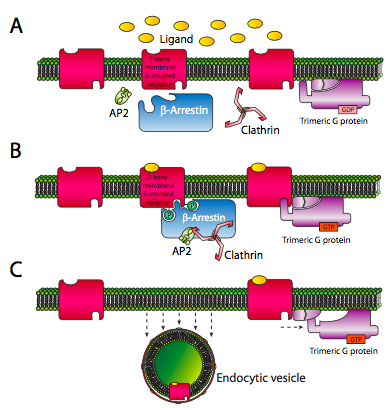
Para una desensibilización más prolongada, la arrestina se une a AP2 y clathrin, nucleando la formación de una vesícula enodítica recubierta de clathrina. Esto elimina el receptor de la superficie celular, desensibilizando la célula por un periodo de tiempo mucho más largo que la simple competencia entre la arrestina y la proteína G.
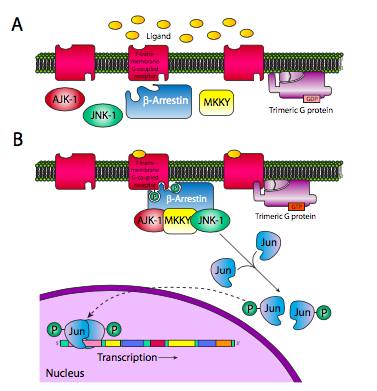
Las arrestinas tienen otra función potencial. Pueden actuar como proteínas de andamiaje que aportan un complejo de señalización completamente diferente al receptor 7-TM. La Figura\(\PageIndex{8}\) muestra un ejemplo en el que se usa el receptor 7-TM para activar un factor de transcripción Jun.
La b-arrestina trae AJK-1, MKKY y JNK-1 para activar JNK-1, que luego puede fosforilar Jun. Esto permite la translocación de fosfo-Jun al núcleo y la posterior dimerización, convirtiéndolo en un factor de transcripción activo.
¿Cuáles son algunas de las acciones celulares que pueden ser evocadas por la activación del receptor 7-TM? La dinámica de Ca 2+ se abordará en una sección separada. Se ha demostrado que la IP 3 evoca contracción del músculo liso y esquelético, polimerización de actina y cambios en la forma celular, liberación de calcio de las reservas intracelulares, apertura de canales de potasio y despolarización de la membrana; el cAMP ha sido implicado en el control de la descomposición del glucógeno y la gluconeogénesis, metabolismo del triaciglicerol, secreción de estrógenos por las células ováricas, secreción de glucocorticoides y aumento de la permeabilidad de las células renales al agua.