15.3: Controlar el ciclo celular
- Page ID
- 53292
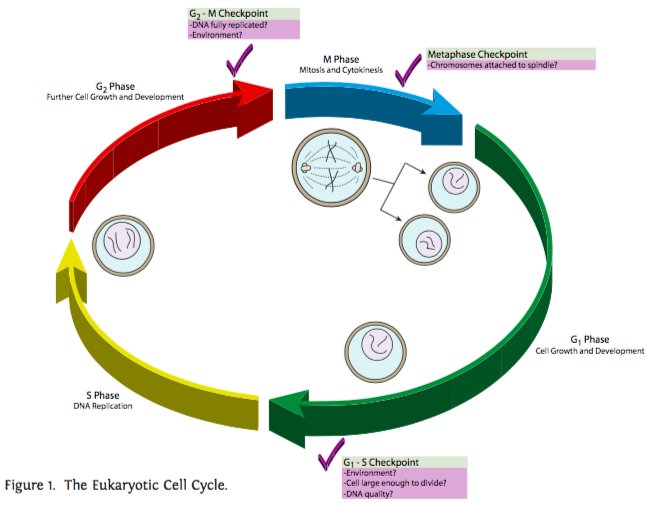
Hay tres puntos de control principales para el control del ciclo celular (Figura\(\PageIndex{1}\)). El primero regula la transición de la fase G 1 a la fase S. Recordemos que G 1 puede ser una fase muy larga, incluso (en el caso de G 0) tan larga como la vida útil de la célula. Sin embargo, una vez que la célula alcanza la fase S, se compromete a pasar por las fases S, G 2 y M para reproducirse. Esto se debe a que una vez que ha comenzado la fase S, hay más del complemento diploide normal de ADN dentro de la célula. Con el tiempo esto confundiría a la célula (por ejemplo, por sobreexpresión de genes duplicados) ya que intentaba usar el ADN para dirigir la síntesis de ARN y proteínas, y podría enfermarse y morir. El segundo punto de control importante regula la entrada a la mitosis. Una vez que comienza la mitosis, la mayor parte de la actividad metabólica de la célula se apaga, y la célula concentra sus recursos en dividir el material nuclear y celular por igual para soportar la vida de ambas células hijas resultantes. Si la célula necesita más tiempo para hacer las reparaciones finales en el ADN o incluso para abultar un poco, este punto de control puede retener la celda en G 2 un poco más para que esas cosas sucedan. Finalmente, el tercer punto de control principal ocurre durante la mitosis, y regula la transición de la metafase a la anafase. Dado que las cromátidas hermanas están siendo divididas y trasladadas a polos opuestos para formar los nuevos núcleos, es importante que todas ellas estén perfectamente alineadas en la metafase y las proteínas que las mantienen unidas hayan caído. Si no se dividen de manera uniforme, las células hijas tendrán números anormales de cromosomas (aneuploidía) que generalmente conducen a consecuencias deletéreas.
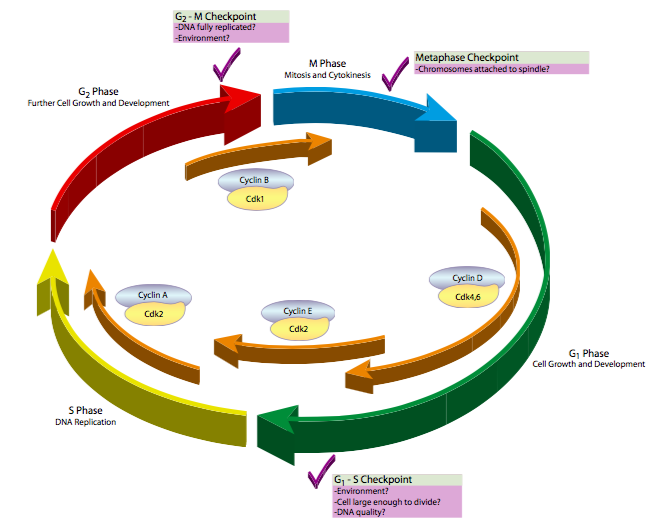
La metodología de algunos de los primeros experimentos es perfectamente adecuada para explicar cómo funciona esto. El trabajo seminal en este campo fue un artículo de 1971 en J. Exp. Zool. por Masui y Markert. En ella, examinaron huevos de rana (Xenopus laevis) que fueron detenidos en G 2. Los ovocitos se detienen durante aproximadamente 8 meses de forma natural con el fin de acumular la masa necesaria para iniciar un nuevo organismo una vez que haya sido fertilizado. La pregunta básica que se hace es ¿qué está provocando que los huevos salgan de G 2 y entren en fase M? Ya se sabía que la hormona progesterona puede desencadenar esta transición, pero ¿cuáles son los actores intracelulares en el cambio en el estado celular? Masui y Markert decidieron probar si había una molécula citoplásmica que fuera responsable. Tomaron una pequeña cantidad de citoplasma de un óvulo en fase M y lo inyectaron en un óvulo G 2 -detenido. Esto desencadenó la maduración del óvulo G2-arrestado y lo empujó a la fase M, incluso sin progesterona. La actividad se denominó factor promotor de la maduración (MPF), y se planteó la hipótesis de ser una proteína soluble, citosólica.
En experimentos posteriores, otros investigadores intentaron encontrar el desencadenante proteico específico, y a partir de ahí, presumiblemente, el resto del mecanismo. Al fraccionar el citoplasma de ovocitos en fase M por cromatografía en columna, se encontró que una proteína, llamada ciclina B, aumentaba y bajaba de concentración en sincronización directa con la actividad de MPF. Además, la adición de ciclina B sola fue suficiente para rescatar la actividad de MPF del extracto citoplásmico en fase M que se había agotado por el tratamiento con RNasa (previniendo la síntesis de cualquier proteína nueva, incluida la ciclina B, y aboliendo la actividad de MPF). Esto claramente coloca a la ciclina B en la vanguardia del mecanismo de maduración, pero hubo un problema importante: la ciclina B no tenía actividad enzimática. ¿Cómo estaba efectuando los cambios necesarios para avanzar de la fase G 2 a la M?
Este problema fue respondido por experimentos en un organismo muy diferente, la levadura de fisión, Schizosaccharomyces pombe. Debido a que tienen un tiempo de ciclo muy corto, un genoma relativamente pequeño, y se les pueden dar mutaciones aleatorias en masa por irradiación o tratamiento químico, las levaduras son excelentes organismos modelo para muchos tipos de estudios biológicos. Después de la mutación aleatoria de una población de levaduras, se pueden cribar para detectar mutaciones de tipos particulares, como el ciclo de división celular (cdc). Cuando las mutaciones son secuenciadas e identificadas, a menudo son nombradas por el tipo de mutación y orden de descubrimiento. Resulta que Cdc2 mostró dos fenotipos interesantes cuando mutó en direcciones opuestas. Las mutaciones que noquearon la función de cdc2 provocaron la formación de levaduras extremadamente grandes que no experimentan división celular, mientras que las mutaciones que hicieron que cdc2 fuera hiperactivo provocaron la formación de células muy pequeñas que se dividen rápidamente. La interpretación fue que cuando falta cdc2 o inactiva, las células no pueden progresar a mitosis, por lo que permanecen en G2 acumulando material a granel en preparación para una división celular que nunca llega. Por el contrario, cuando cdc2 es hiperactiva, conduce a la célula rápidamente a la mitosis, incluso si no ha estado en G 2 el tiempo suficiente para sintetizar suficiente masa para formar dos células de tamaño normal. Esto une muy bien a cdc2 con la regulación del ciclo celular, e incluso tiene una actividad enzimática: es una quinasa. Esto lo convirtió en un candidato perfecto como coordinador de primer orden de eventos celulares porque la fosforilación es rápida, la fosforilación suele activar alguna otra enzima y las quinasas suelen actuar sobre una serie de dianas, no solo una. Así que ahora tenemos una ciclina (identificada como cdc13 en S. pombe) y una quinasa dependiente de ciclina que trabajan en conjunto para promover la progresión del ciclo celular a la fase M.


