2.1: Los bloques de construcción de las moléculas
- Page ID
- 54078
En su nivel más fundamental, la vida está conformada por la materia. La materia ocupa espacio y tiene masa. Toda la materia está compuesta por elementos, sustancias que no pueden descomponerse ni transformarse químicamente en otras sustancias. Cada elemento está hecho de átomos, cada uno con un número constante de protones y propiedades únicas. Se han definido un total de 118 elementos; sin embargo, solo 92 ocurren de forma natural, y menos de 30 se encuentran en las células vivas. Los 26 elementos restantes son inestables y, por lo tanto, no existen por mucho tiempo o son teóricos y aún no se han detectado.
Cada elemento es designado por su símbolo químico (como H, N, O, C y Na), y posee propiedades únicas. Estas propiedades únicas permiten que los elementos se combinen y se unan entre sí de maneras específicas.
Átomos
Un átomo es el componente más pequeño de un elemento que conserva todas las propiedades químicas de ese elemento. Por ejemplo, un átomo de hidrógeno tiene todas las propiedades del elemento hidrógeno, tal como existe como gas a temperatura ambiente, y se une con el oxígeno para crear una molécula de agua. Los átomos de hidrógeno no se pueden descomponer en nada más pequeño sin dejar de conservar las propiedades del hidrógeno. Si un átomo de hidrógeno se descomponía en partículas subatómicas, ya no tendría las propiedades del hidrógeno.
En el nivel más básico, todos los organismos están hechos de una combinación de elementos. Contienen átomos que se combinan para formar moléculas. En organismos multicelulares, como los animales, las moléculas pueden interactuar para formar células que se combinan para formar tejidos, que conforman órganos. Estas combinaciones continúan hasta que se forman organismos multicelulares enteros.
Todos los átomos contienen protones, electrones y neutrones (Figura\(\PageIndex{1}\)). La única excepción es el hidrógeno (H), que está hecho de un protón y un electrón. Un protón es una partícula cargada positivamente que reside en el núcleo (el núcleo del átomo) de un átomo y tiene una masa de 1 y una carga de +1. Un electrón es una partícula cargada negativamente que viaja en el espacio alrededor del núcleo. Es decir, reside fuera del núcleo. Tiene una masa insignificante y tiene una carga de —1.
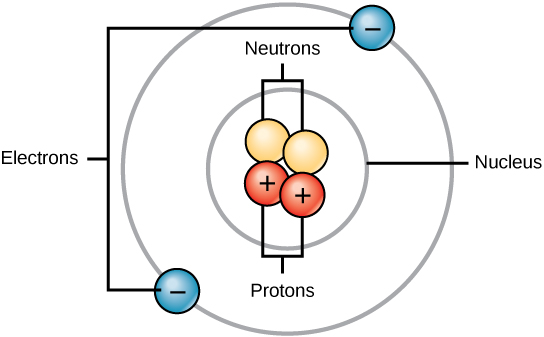
Los neutrones, al igual que los protones, residen en el núcleo de un átomo. Tienen una masa de 1 y sin cargo. Las cargas positivas (protones) y negativas (electrones) se equilibran entre sí en un átomo neutro, que tiene una carga neta cero.
Debido a que los protones y neutrones tienen cada uno una masa de 1, la masa de un átomo es igual al número de protones y neutrones de ese átomo. El número de electrones no factoriza en la masa general, porque su masa es muy pequeña.
Como se indicó anteriormente, cada elemento tiene sus propias propiedades únicas. Cada uno contiene un número diferente de protones y neutrones, dándole su propio número atómico y número másico. El número atómico de un elemento es igual al número de protones que contiene ese elemento. El número de masa, o masa atómica, es el número de protones más el número de neutrones de ese elemento. Por lo tanto, es posible determinar el número de neutrones restando el número atómico del número másico.
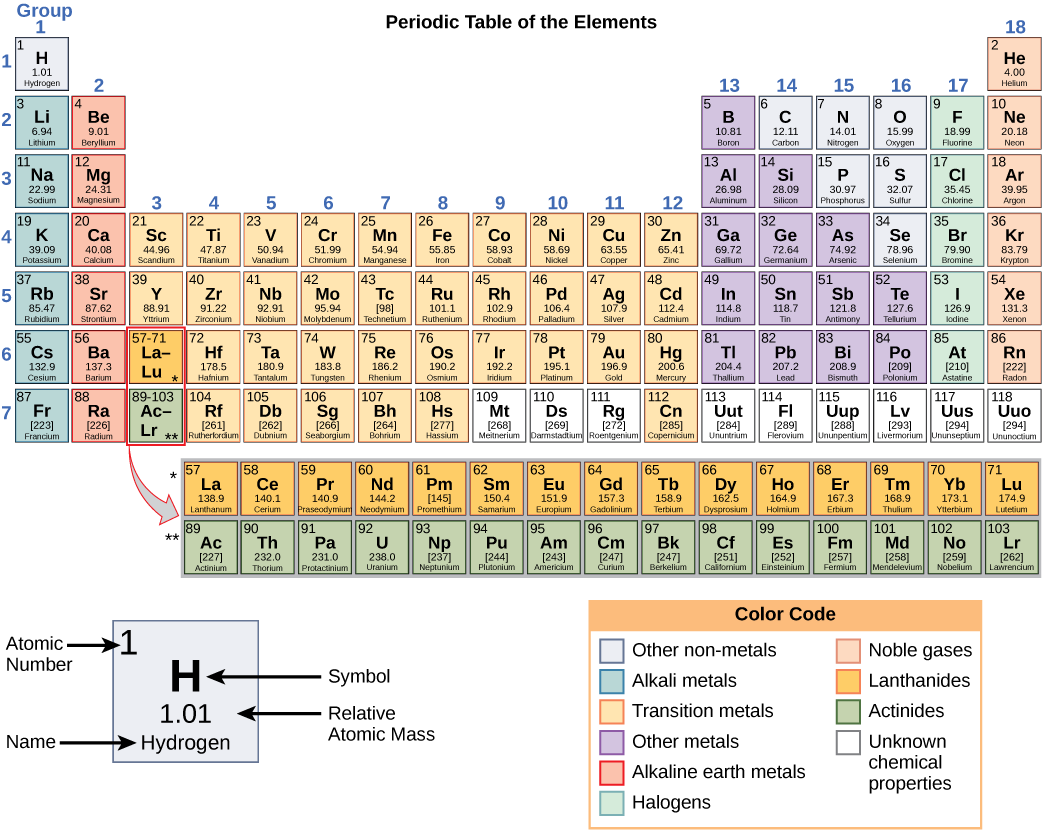
Estos números proporcionan información sobre los elementos y cómo reaccionarán cuando se combinen. Diferentes elementos tienen diferentes puntos de fusión y ebullición, y se encuentran en diferentes estados (líquido, sólido o gas) a temperatura ambiente. También se combinan de diferentes maneras. Algunos forman tipos específicos de bonos, mientras que otros no. La forma en que se combinan se basa en el número de electrones presentes. Debido a estas características, los elementos están dispuestos en la tabla periódica de elementos, un gráfico de los elementos que incluye el número atómico y la masa atómica relativa de cada elemento. La tabla periódica también proporciona información clave sobre las propiedades de los elementos (Figura\(\PageIndex{2}\)), a menudo indicadas por la codificación de colores. La disposición de la tabla también muestra cómo se organizan los electrones en cada elemento y proporciona detalles importantes sobre cómo reaccionarán los átomos entre sí para formar moléculas.
Los isótopos son diferentes formas del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Algunos elementos, como el carbono, potasio y uranio, tienen isótopos naturales. El carbono-12, el isótopo más común del carbono, contiene seis protones y seis neutrones. Por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones) y un número atómico de 6 (lo que lo convierte en carbono). El Carbono-14 contiene seis protones y ocho neutrones. Por lo tanto, tiene un número de masa de 14 (seis protones y ocho neutrones) y un número atómico de 6, lo que significa que sigue siendo el elemento carbono. Estas dos formas alternas de carbono son isótopos. Algunos isótopos son inestables y perderán protones, otras partículas subatómicas o energía para formar elementos más estables. Estos se denominan isótopos radiactivos o radioisótopos.
CONEXIÓN ARTE
¿Cuántos neutrones tienen (K) potasio-39 y potasio-40, respectivamente?
EVOLUCIÓN EN ACCIÓN: Datación
El carbono-14 (14 C) es un radioisótopo natural que es creado en la atmósfera por los rayos cósmicos. Este es un proceso continuo, por lo que siempre se está creando más 14 C. A medida que se desarrolla un organismo vivo, el nivel relativo de 14 C en su cuerpo es igual a la concentración de 14 C en la atmósfera. Cuando un organismo muere, ya no está ingiriendo 14 C, por lo que la proporción disminuirá. 14 C decae a 14 N por un proceso llamado decaimiento beta; emite energía en este lento proceso.
Después de aproximadamente 5,730 años, solo la mitad de la concentración inicial de 14 C habrá sido convertida a 14 N. El tiempo que tarda la mitad de la concentración original de un isótopo en desintegrarse a su forma más estable se llama su vida media. Debido a que la vida media de 14 C es larga, se utiliza para envejecer objetos anteriormente vivos, como los fósiles. Utilizando la relación entre la concentración de 14 C que se encuentra en un objeto y la cantidad de 14 C detectada en la atmósfera, se puede determinar la cantidad del isótopo que aún no se ha descompuesto. Con base en esta cantidad, la edad del fósil puede calcularse a aproximadamente 50,000 años (Figura\(\PageIndex{3}\)). Los isótopos con vidas medias más largas, como el potasio-40, se utilizan para calcular las edades de los fósiles más antiguos. Mediante el uso de la datación por carbono, los científicos pueden reconstruir la ecología y biogeografía de organismos que viven en los últimos 50,000 años.

CONCEPT EN ACCIÓN
Para conocer más sobre átomos e isótopos, y cómo se puede distinguir un isótopo de otro, visite este sitio y ejecute la simulación.
Bonos Químicos
La forma en que los elementos interactúan entre sí depende de cómo están dispuestos sus electrones y cuántas aberturas para los electrones existen en la región más externa donde los electrones están presentes en un átomo. Los electrones existen a niveles de energía que forman conchas alrededor del núcleo. El caparazón más cercano puede contener hasta dos electrones. El caparazón más cercano al núcleo siempre se llena primero, antes de que se pueda llenar cualquier otra concha. El hidrógeno tiene un electrón; por lo tanto, solo tiene un punto ocupado dentro de la capa más baja. El helio tiene dos electrones; por lo tanto, puede llenar completamente la capa más baja con sus dos electrones. Si miras la tabla periódica, verás que el hidrógeno y el helio son los únicos dos elementos en la primera fila. Esto se debe a que sólo tienen electrones en su primer caparazón. El hidrógeno y el helio son los únicos dos elementos que tienen el caparazón más bajo y ningún otro caparazón.
El segundo y tercer nivel de energía pueden contener hasta ocho electrones. Los ocho electrones están dispuestos en cuatro pares y una posición en cada par se llena con un electrón antes de que se complete cualquier par.
Al mirar nuevamente la tabla periódica (Figura\(\PageIndex{2}\)), notará que hay siete filas. Estas filas corresponden al número de conchas que tienen los elementos dentro de esa fila. Los elementos dentro de una fila en particular tienen un número creciente de electrones a medida que las columnas proceden de izquierda a derecha. Aunque cada elemento tiene el mismo número de conchas, no todas las conchas están completamente llenas de electrones. Si miras la segunda fila de la tabla periódica, encontrarás litio (Li), berilio (Be), boro (B), carbono (C), nitrógeno (N), oxígeno (O), flúor (F) y neón (Ne). Todos estos tienen electrones que ocupan sólo la primera y segunda conchas. El litio solo tiene un electrón en su caparazón más exterior, el berilio tiene dos electrones, el boro tiene tres, y así sucesivamente, hasta que toda la cáscara se llena con ocho electrones, como es el caso del neón.
No todos los elementos tienen suficientes electrones para llenar sus cáscaras más externas, pero un átomo está en su punto más estable cuando se llenan todas las posiciones de los electrones en la capa más externa. Debido a estas vacantes en las conchas más externas, vemos la formación de enlaces químicos, o interacciones entre dos o más elementos iguales o diferentes que resultan en la formación de moléculas. Para lograr una mayor estabilidad, los átomos tenderán a llenar completamente sus capas externas y se unirán con otros elementos para lograr este objetivo compartiendo electrones, aceptando electrones de otro átomo o donando electrones a otro átomo. Debido a que las conchas más externas de los elementos con números atómicos bajos (hasta calcio, con número atómico 20) pueden contener ocho electrones, esto se conoce como la regla del octeto. Un elemento puede donar, aceptar o compartir electrones con otros elementos para llenar su capa exterior y satisfacer la regla del octeto.
Cuando un átomo no contiene igual número de protones y electrones, se le llama ion. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Los iones positivos se forman al perder electrones y se llaman cationes. Los iones negativos se forman ganando electrones y se llaman aniones.
Por ejemplo, el sodio solo tiene un electrón en su caparazón más externo. Se necesita menos energía para que el sodio done ese electrón que para aceptar siete electrones más para llenar la capa externa. Si el sodio pierde un electrón, ahora tiene 11 protones y sólo 10 electrones, dejándolo con una carga general de +1. Ahora se le llama ion de sodio.
El átomo de cloro tiene siete electrones en su capa externa. Nuevamente, es más eficiente energéticamente que el cloro gane un electrón que perder siete. Por lo tanto, tiende a ganar un electrón para crear un ion con 17 protones y 18 electrones, dándole una carga neta negativa (—1). Ahora se le llama ion cloruro. Este movimiento de electrones de un elemento a otro se conoce como transferencia de electrones. Como\(\PageIndex{4}\) ilustra la Figura, un átomo de sodio (Na) solo tiene un electrón en su capa más externa, mientras que un átomo de cloro (Cl) tiene siete electrones en su capa más externa. Un átomo de sodio donará su único electrón para vaciar su caparazón, y un átomo de cloro aceptará ese electrón para llenar su caparazón, convirtiéndose en cloruro. Ambos iones ahora satisfacen la regla del octeto y tienen conchas más externas completas. Debido a que el número de electrones ya no es igual al número de protones, cada uno es ahora un ion y tiene una carga +1 (sodio) o —1 (cloruro).
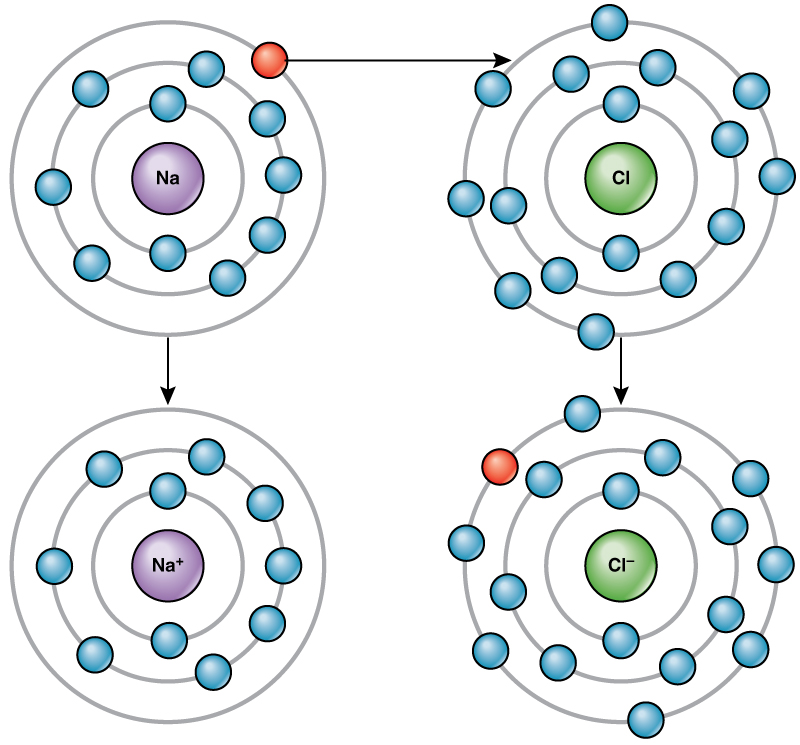
Enlaces Iónicos
Hay cuatro tipos de enlaces o interacciones: iónicos, covalentes, enlaces de hidrógeno e interacciones de van der Waals. Los enlaces iónicos y covalentes son interacciones fuertes que requieren un mayor aporte de energía para romperse. Cuando un elemento dona un electrón de su capa externa, como en el ejemplo del átomo de sodio anterior, se forma un ion positivo. El elemento que acepta el electrón está ahora cargado negativamente. Debido a que las cargas positivas y negativas se atraen, estos iones permanecen juntos y forman un enlace iónico, o un enlace entre iones. Los elementos se unen con el electrón de un elemento permaneciendo predominantemente con el otro elemento. Cuando los iones Na + y Cl — se combinan para producir NaCl, un electrón de un átomo de sodio permanece con los otros siete del átomo de cloro, y los iones de sodio y cloruro se atraen entre sí en una red de iones con una carga neta cero.
Enlaces covalentes
Otro tipo de enlace químico fuerte entre dos o más átomos es un enlace covalente. Estos enlaces se forman cuando un electrón se comparte entre dos elementos y son la forma más fuerte y común de enlace químico en los organismos vivos. Se forman enlaces covalentes entre los elementos que componen las moléculas biológicas en nuestras células. A diferencia de los enlaces iónicos, los enlaces covalentes no se disocian en agua.
Los átomos de hidrógeno y oxígeno que se combinan para formar moléculas de agua están unidos por enlaces covalentes. El electrón del átomo de hidrógeno divide su tiempo entre la capa externa del átomo de hidrógeno y la capa externa incompleta del átomo de oxígeno. Para llenar completamente la capa externa de un átomo de oxígeno, se necesitan dos electrones de dos átomos de hidrógeno, de ahí el subíndice “2” en H 2 O. Los electrones se comparten entre los átomos, dividiendo su tiempo entre ellos para “llenar” la capa exterior de cada uno. Este reparto es un estado de menor energía para todos los átomos involucrados que si existieran sin sus cáscaras externas llenas.
Existen dos tipos de enlaces covalentes: polares y no polares. Se forman enlaces covalentes no polares entre dos átomos del mismo elemento o entre diferentes elementos que comparten los electrones por igual. Por ejemplo, un átomo de oxígeno puede unirse con otro átomo de oxígeno para llenar sus cáscaras externas. Esta asociación es no polar porque los electrones estarán igualmente distribuidos entre cada átomo de oxígeno. Dos enlaces covalentes se forman entre los dos átomos de oxígeno porque el oxígeno requiere dos electrones compartidos para llenar su capa más externa. Los átomos de nitrógeno formarán tres enlaces covalentes (también llamados triple covalentes) entre dos átomos de nitrógeno porque cada átomo de nitrógeno necesita tres electrones para llenar su capa más externa. Otro ejemplo de un enlace covalente no polar se encuentra en la molécula de metano (CH 4). El átomo de carbono tiene cuatro electrones en su caparazón más externo y necesita cuatro más para llenarlo. Obtiene estos cuatro de cuatro átomos de hidrógeno, cada átomo proporciona uno. Todos estos elementos comparten los electrones por igual, creando cuatro enlaces covalentes no polares (Figura\(\PageIndex{5}\)).
En un enlace covalente polar, los electrones compartidos por los átomos pasan más tiempo más cerca de un núcleo que del otro núcleo. Debido a la distribución desigual de electrones entre los diferentes núcleos, se desarrolla una carga ligeramente positiva (δ+) o ligeramente negativa (δ—). Los enlaces covalentes entre los átomos de hidrógeno y oxígeno en el agua son enlaces covalentes polares. Los electrones compartidos pasan más tiempo cerca del núcleo de oxígeno, dándole una pequeña carga negativa, que pasan cerca de los núcleos de hidrógeno, dando a estas moléculas una pequeña carga positiva.
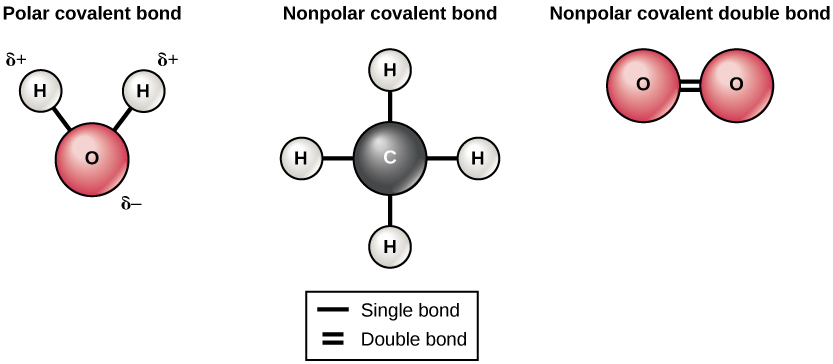
Enlaces de Hidrógeno
Los enlaces iónicos y covalentes son enlaces fuertes que requieren una energía considerable para romperse. Sin embargo, no todos los enlaces entre elementos son enlaces iónicos o covalentes. También se pueden formar enlaces más débiles. Se trata de atractivos que ocurren entre cargas positivas y negativas que no requieren de mucha energía para romperse. Dos enlaces débiles que ocurren con frecuencia son los enlaces de hidrógeno y las interacciones de van der Waals. Estos enlaces dan lugar a las propiedades únicas del agua y a las estructuras únicas del ADN y las proteínas.
Cuando se forman enlaces covalentes polares que contienen un átomo de hidrógeno, el átomo de hidrógeno en ese enlace tiene una carga ligeramente positiva. Esto se debe a que el electrón compartido es arrastrado con mayor fuerza hacia el otro elemento y lejos del núcleo de hidrógeno. Debido a que el átomo de hidrógeno es ligeramente positivo (δ+), será atraído por cargas parciales negativas vecinas (δ—). Cuando esto sucede, se produce una interacción débil entre la carga δ+ del átomo de hidrógeno de una molécula y la carga δ— de la otra molécula. Esta interacción se llama un enlace de hidrógeno. Este tipo de enlace es común; por ejemplo, la naturaleza líquida del agua es causada por los enlaces de hidrógeno entre las moléculas de agua (Figura\(\PageIndex{6}\)). Los enlaces de hidrógeno le dan al agua las propiedades únicas que sostienen la vida. Si no fuera por enlaces de hidrógeno, el agua sería un gas en lugar de un líquido a temperatura ambiente.
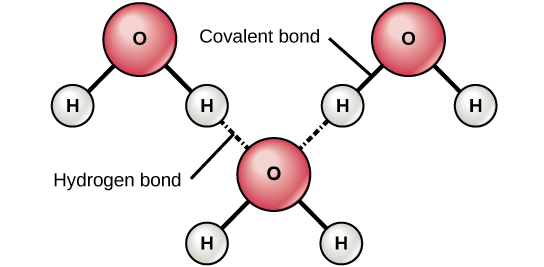
Se pueden formar enlaces de hidrógeno entre diferentes moléculas y no siempre tienen que incluir una molécula de agua. Los átomos de hidrógeno en enlaces polares dentro de cualquier molécula pueden formar enlaces con otras moléculas adyacentes. Por ejemplo, los enlaces de hidrógeno mantienen unidas dos largas cadenas de ADN para dar a la molécula de ADN su característica estructura bicatenaria. Los enlaces de hidrógeno también son responsables de parte de la estructura tridimensional de las proteínas.
Interacciones de van der Waals
Al igual que los enlaces de hidrógeno, las interacciones de van der Waals son débiles atracciones o interacciones entre moléculas. Ocurren entre átomos polares, unidos covalentemente, en diferentes moléculas. Algunas de estas débiles atracciones son causadas por cargas parciales temporales que se forman cuando los electrones se mueven alrededor de un núcleo. Estas interacciones débiles entre moléculas son importantes en los sistemas biológicos.
CARRERAS EN ACCIÓN: Técnico en radiografía
¿Usted o alguien que conozca alguna vez ha tenido una resonancia magnética (MRI), una mamografía o una radiografía? Estas pruebas producen imágenes de sus tejidos blandos y órganos (como con una resonancia magnética o una mamografía) o sus huesos (como sucede en una radiografía) mediante el uso de ondas de radio o isótopos especiales (radiomarcados o marcados fluorescentemente) que se ingieren o inyectan en el cuerpo. Estas pruebas proporcionan datos para diagnósticos de enfermedades mediante la creación de imágenes de sus órganos o sistema esquelético.
La resonancia magnética funciona sometiendo los núcleos de hidrógeno, que abundan en el agua en los tejidos blandos, a campos magnéticos fluctuantes, que hacen que emitan su propio campo magnético. Esta señal es entonces leída por sensores en la máquina e interpretada por una computadora para formar una imagen detallada.
Algunos tecnólogos y técnicos de radiografía se especializan en tomografía computarizada, resonancia magnética y mamografía. Producen películas o imágenes del cuerpo que ayudan a los profesionales médicos a examinar y diagnosticar. Los radiólogos trabajan directamente con los pacientes, explicando la maquinaria, preparándolos para los exámenes y asegurando que su cuerpo o partes del cuerpo se posicionen correctamente para producir las imágenes necesarias. Luego, médicos o radiólogos analizan los resultados de las pruebas.
Los técnicos de radiografía pueden trabajar en hospitales, consultorios médicos o centros especializados en imágenes. La capacitación para convertirse en técnico en radiografía ocurre en hospitales, colegios y universidades que ofrecen certificados, títulos asociados o licenciaturas en radiografía.
Resumen
La materia es cualquier cosa que ocupa espacio y tiene masa. Se compone de átomos de diferentes elementos. Todos los 92 elementos que ocurren de forma natural tienen cualidades únicas que les permiten combinarse de diversas maneras para crear compuestos o moléculas. Los átomos, que consisten en protones, neutrones y electrones, son las unidades más pequeñas de un elemento que conservan todas las propiedades de ese elemento. Los electrones pueden ser donados o compartidos entre átomos para crear enlaces, incluyendo enlaces iónicos, covalentes e hidrógeno, así como interacciones de van der Waals.
Conexiones de arte
Figura\(\PageIndex{2}\): ¿Cuántos neutrones tienen (K) potasio-39 y potasio-40, respectivamente?
- Contestar
-
El Potasio-39 tiene veinte neutrones. El potasio-40 tiene veintiún neutrones.
Glosario
- anión
- un ion negativo formado por la obtención de electrones
- número atómico
- el número de protones en un átomo
- catión
- un ion positivo formado por la pérdida de electrones
- enlace químico
- una interacción entre dos o más elementos iguales o diferentes que da como resultado la formación de moléculas
- enlace covalente
- un tipo de enlace fuerte entre dos o más elementos iguales o diferentes; formas cuando los electrones se comparten entre elementos
- electrón
- una partícula cargada negativamente que reside fuera del núcleo en el orbital electrónico; carece de masa funcional y tiene una carga de —1
- transferencia de electrones
- el movimiento de electrones de un elemento a otro
- elemento
- una de 118 sustancias únicas que no se pueden descomponer en sustancias más pequeñas y conservan la característica de esa sustancia; cada elemento tiene un número específico de protones y propiedades únicas
- enlace de hidrógeno
- un enlace débil entre átomos de hidrógeno parcialmente cargados positivamente y elementos o moléculas parcialmente cargados negativamente
- ion
- un átomo o compuesto que no contiene el mismo número de protones y electrones, y por lo tanto tiene una carga neta
- enlace iónico
- un enlace químico que se forma entre iones de cargas opuestas
- isótopo
- una o más formas de un elemento que tienen diferentes números de neutrones
- número de masa
- el número de protones más neutrones en un átomo
- materia
- cualquier cosa que tenga masa y ocupe espacio
- neutrones
- una partícula sin carga que reside en el núcleo de un átomo; tiene una masa de 1
- enlace covalente no polar
- un tipo de enlace covalente que se forma entre los átomos cuando los electrones se comparten por igual entre los átomos, lo que resulta en ninguna región con cargas parciales como en los enlaces covalentes polares
- núcleo
- (química) el centro denso de un átomo compuesto por protones y (excepto en el caso de un átomo de hidrógeno) neutrones
- regla del octeto
- establece que la capa más externa de un elemento con un número atómico bajo puede contener ocho electrones
- tabla periódica de elementos
- un organigrama de elementos, que indica el número atómico y el número de masa de cada elemento; también proporciona información clave sobre las propiedades de los elementos
- enlace covalente polar
- un tipo de enlace covalente en el que los electrones son arrastrados hacia un átomo y lejos de otro, dando como resultado regiones cargadas ligeramente positivas y ligeramente negativas de la molécula
- protón
- una partícula cargada positivamente que reside en el núcleo de un átomo; tiene una masa de 1 y una carga de +1
- isótopo radiactivo
- un isótopo que emite espontáneamente partículas o energía para formar un elemento más estable
- Interacción de van der Waals
- una atracción o interacción débil entre moléculas causada por átomos ligeramente cargados positivamente o ligeramente cargados negativamente


