3.3: Otras Consideraciones en Membranas
- Page ID
- 53108
Fuente: BiochemFFA_3_3.pdf. Todo el libro de texto está disponible de forma gratuita de los autores en http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
Existen muchas funciones y factores relacionados con las membranas celulares que no encajan en categorías amplias. Esos ítems serán el foco de esta sección.
Endocitosis
Además de las proteínas transportadoras y los canales iónicos, otra forma común de que los materiales ingresen a las células es mediante el proceso de endocitosis. La endocitosis es una forma alternativa de transporte activo para introducir materiales en las células. Algunos de estos procesos, como la fagocitosis, son capaces de importar partículas mucho más grandes de lo que sería posible a través de una proteína transportadora. Al igual que las proteínas transportadoras, la endocitosis utiliza energía para el propósito (aunque no es tan visible como con los transportadores de proteínas), pero a diferencia de los transportadores de proteínas, el proceso no es tan específico para moléculas individuales.
Como resultado, el proceso suele implicar la importación de muchas moléculas diferentes cada vez que ocurre. La lista de compuestos que ingresan a las células de esta manera incluye los LDL y su contenido lipídico, pero también incluye cosas como el hierro (empaquetado en transferrina), vitaminas, hormonas, proteínas, e incluso algunos virus se cuelan por este medio. Hay tres tipos de endocitosis que consideraremos (Figura 3.53).
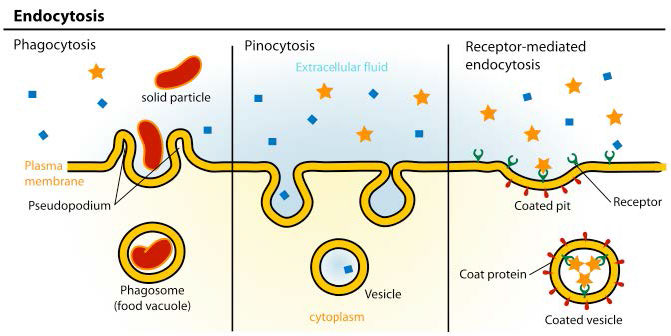
Endocitosis mediada por receptores
El proceso de endocitosis mediada por receptores es un medio relativamente específico de llevar moléculas a las células porque requiere que el material entrante esté asociado de alguna manera con un receptor específico de la superficie celular. En el ejemplo de la Figura 3.53, el receptor es el receptor celular de LDL. Las invaginaciones recubiertas de clatrina, como se muestra en la figura, se conocen como “fosas recubiertas”. El mecanismo procede con una brotación interna del receptor de membrana plasmática (vesículas recubiertas). La unión del ligando (apoB-100 de la LDL, por ejemplo, en la Figura 3.54) al receptor de LDL conduce a la formación de una invaginación de membrana. La partícula de LDL absorbida se funde para formar un endosoma temprano (Figura 3.55) y los contenidos se clasifican y procesan posteriormente para su uso por la célula.
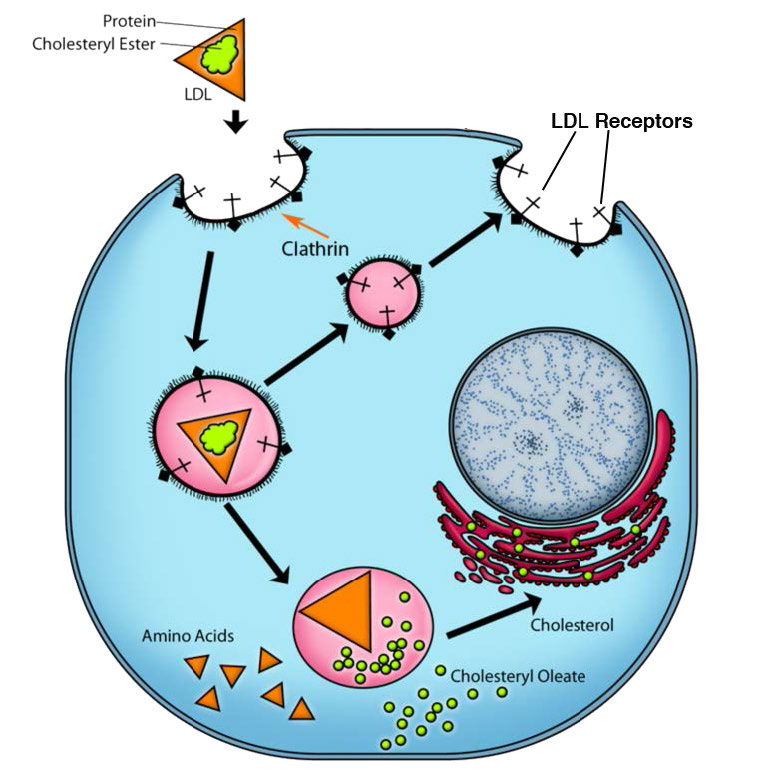
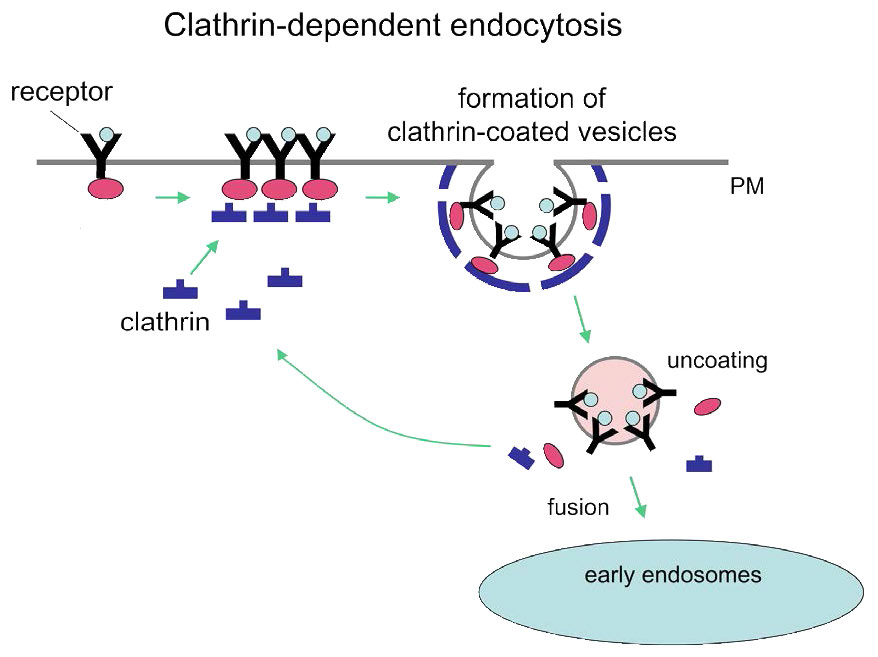
Los componentes de la vesícula recubierta se reciclan a la membrana plasmática para acciones adicionales. La endocitosis mediada por receptores también puede desempeñar un papel en la internalización de receptores celulares que funcionan en el proceso de señalización. Aquí, un receptor unido a un ligando se lleva a la célula y finalmente puede generar una respuesta en el núcleo.
Si bien la endocitosis mediada por receptores de receptores puede tener el efecto de comunicar una señal hacia adentro a la célula, también puede reducir la cantidad total de señalización que se produce, ya que el número de receptores en la superficie celular disminuye por el proceso.
Endocitosis no clatrina
Hay tres tipos de endocitosis que ocurren en células que no involucran clatrina. Son 1) endocitosis a base de caveola, 2) macropinocitosis y 3) fagocitosis. La endocitosis basada en caveola se basa en una molécula receptora conocida como caveolina. Las caveolinas son una clase de proteínas integrales de membrana que compartimentalizan y concentran moléculas de señalización en el proceso de endocitosis. Se llaman así por las estructuras de caveolas en forma de cueva de la membrana plasmática donde se encuentran.
Caveolines
Las caveolinas tienen afinidad por el colesterol y se asocian con él en la membrana de las células, provocando la formación de invaginaciones de membrana de aproximadamente 50 nm. Las proteínas caveolina pueden oligomerizarse y esto es importante para el recubrimiento y la formación de las estructuras tipo cueva.
Hay tres genes de caveolina que se encuentran en las células de vertebrados, CAV1, CAV2 y CAV3. La regulación a la baja de la caveolina-1 da como resultado una migración celular menos eficiente in vitro. Las caveolinas están implicadas tanto en la formación como en la supresión de tumores. La alta expresión de ellos inhibe las vías de señalización del factor de crecimiento relacionadas con el cáncer, pero algunas células cancerosas que expresan caveolina son más agresivas y metastásicas, posible debido a una mayor capacidad de crecimiento independiente del anclaje.
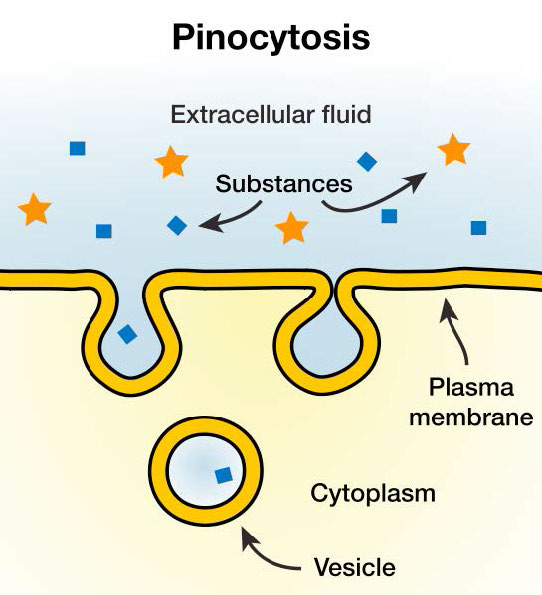
Macropinocitosis
Un fenómeno conocido como “consumo de células”, la macropinocitosis implica literalmente que una célula “toma un trago” del líquido extracelular. Lo hace, como se muestra en la Figura 3.56, por una simple invaginación de las características superficiales con volantes de la membrana plasmática. El resultado es una bolsa, que se pellizca internamente para crear una vesícula que contiene fluido extracelular y moléculas disueltas. Dentro del citosol, esta vesícula internalizada se fusionará con endosomas y lisosomas. El proceso es inespecífico para materiales internalizados.
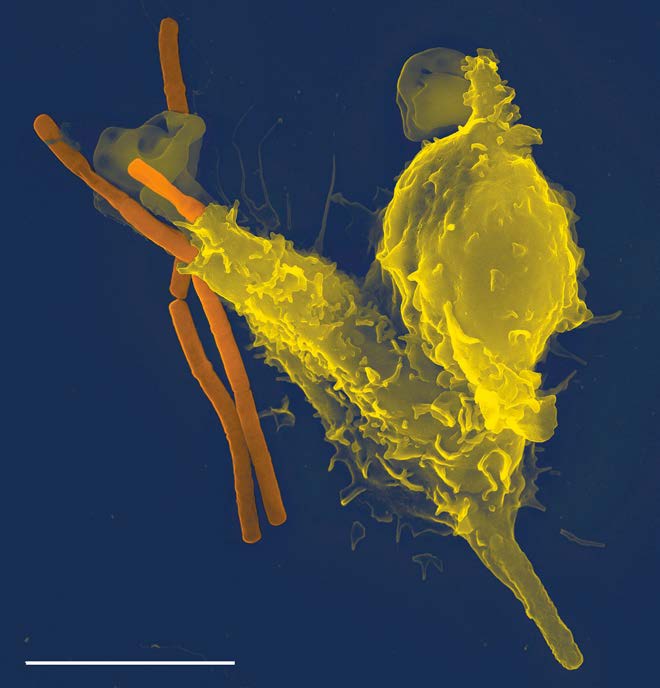
Fagocitosis
La fagocitosis es un proceso mediante el cual se intenalizan partículas relativamente grandes (0.75 µm de diámetro). Las células del sistema inmune, como neutrófilos, macrófagos y otras, utilizan la fagocitosis para internalizar los desechos celulares, las células apoptóticas y los microorganismos.
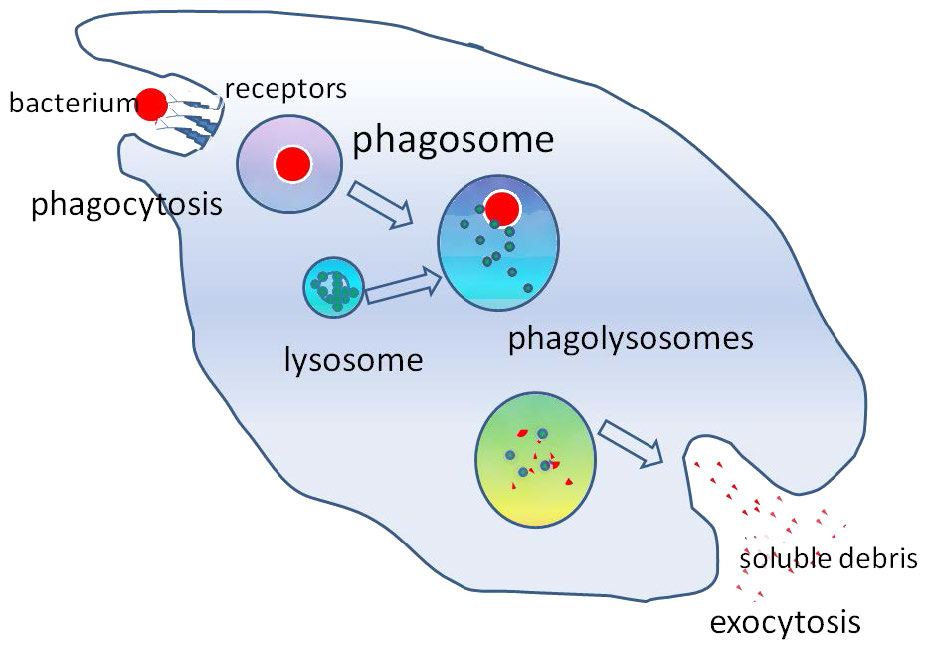
El proceso opera a través de receptores específicos en la superficie de la célula y la célula fagocitante envuelve su diana al crecer a su alrededor. A la estructura internalizada se le conoce como un fagosoma, que se fusiona rápidamente con un lisosoma para crear un fagolisosoma (Figura 3.58), que somete la partícula engullida a condiciones tóxicas para matarla, si es una célula, y/o para digerirla en trozos más pequeños. En algunos casos, como se muestra en la figura, los desechos solubles pueden ser liberados por la célula fagocitante.
Endosomas
El material internalizado de endocitosis que no implica fagocitosis pasa a través de una estructura internalizada llamada endosoma. Los endosomas son estructuras unidas por membrana dentro de células eucariotas que juegan un papel en la endocitosis (Figura 3.59). Tienen una función de clasificación para el material internalizado en la célula, proporcionando la recuperación de materiales no destinados a la destrucción en los lisosomas. Los LDL, por ejemplo, se dirigen después de la endocitosis a los endosomas para su procesamiento antes de que parte de ellos se administre al lisosoma. Los endosomas también pueden recibir moléculas de la red trans-Golgi. Estos pueden ser entregados a los lisosomas, también, o redirigidos de nuevo al Golgi. Los endosomas vienen en tres formas: 1) temprano, 2) tardío y 3) reciclaje.
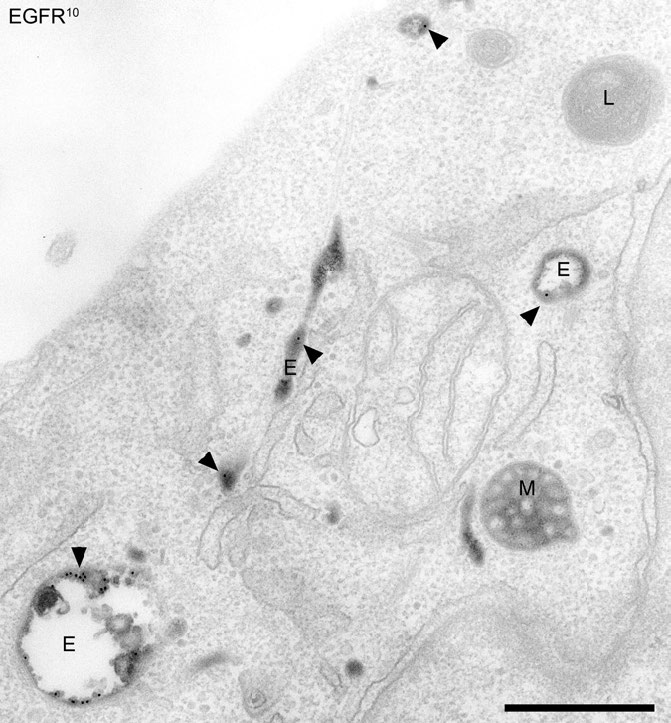
Figura 3.59 - Internalización del receptor del factor de crecimiento epidérmico (EGFR) en endosomas. Los endosomas tempranos (E) y tardíos (M) y los lisosomas (L) están etiquetados. - Wikipedia
Exocitosis
El proceso de exocitosis es utilizado por las células para exportar moléculas fuera de células que de otra manera no pasarían fácilmente a través de la membrana plasmática. En el proceso, las vesículas secretoras se fusionan con la membrana plasmática y liberan su contenido extracelularmente. Los materiales, como las proteínas y los lípidos incrustados en las membranas de las vesículas, se convierten en parte de la membrana plasmática cuando se produce la fusión entre ésta y las vesículas.
Fusión de membrana
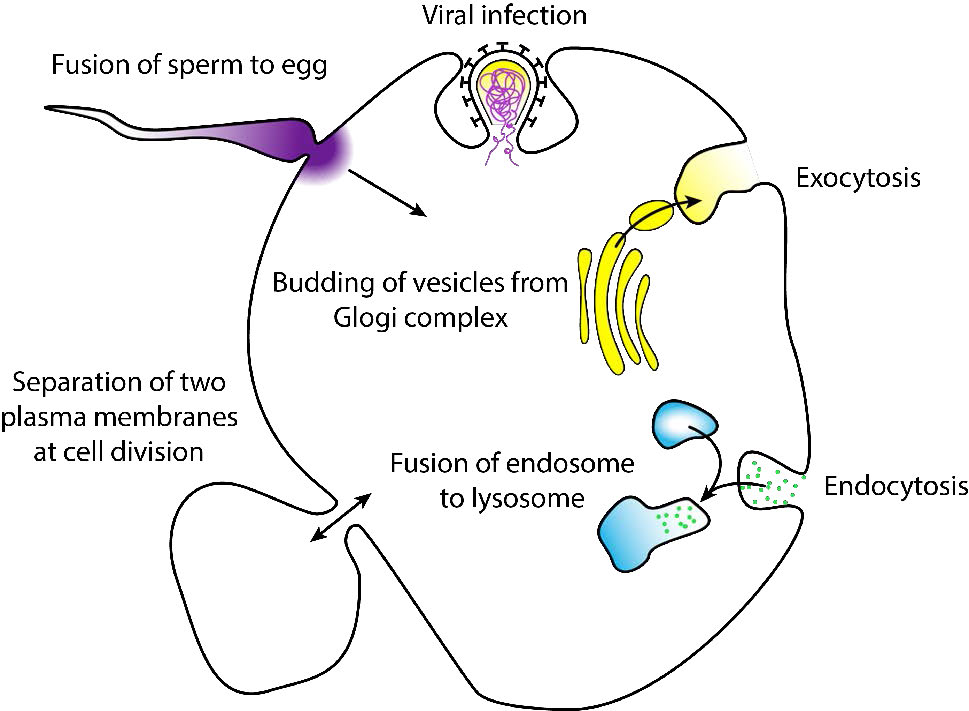
La fusión es un proceso de membrana donde dos bicapas lipídicas distintas fusionan sus núcleos hidrófobos, produciendo una estructura interconectada. La fusión de membrana que involucra vesículas es el mecanismo por el cual ocurren los procesos de endocitosis y exocitosis.
Cuando la fusión avanza a través de ambos folíolos de ambas bicapas, se produce un puente acuoso y se mezclan los contenidos de las dos estructuras. Los procesos comunes que implican fusión de membrana (Figura 3.60) incluyen la fertilización de un óvulo por un espermatozoide, la separación de membranas en la división celular, el transporte de productos de desecho y la liberación de neurotransmisores (Figura 3.61). Las membranas artificiales como los liposomas también pueden fusionarse con las membranas celulares. La fusión también es importante para transportar los lípidos desde el punto de síntesis dentro de la célula hasta la membrana donde se utilizan. La entrada de patógenos también puede regirse por la fusión, ya que muchos virus recubiertos de bicapa utilizan proteínas de fusión para ingresar a las células hospedadoras.
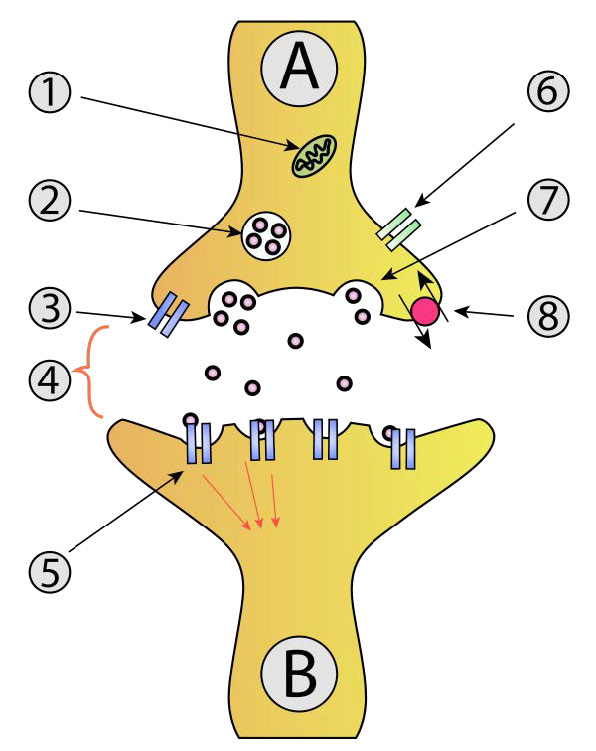
Proteínas SNARE
La mediación de la fusión de vesículas en la exocitosis se lleva a cabo por proteínas conocidas como SNARes (Soluble NSF Attachment Protein Receptor). Esta gran superfamilia de proteínas abarca una amplia gama biológica, desde levaduras hasta mamíferos. Las fusiones de vesículas comunes ocurren cuando las vesículas sinápticas se acoplan con neuronas (Figura 3.61) y liberan neurotransmisores. Estos están bien estudiados. Las SNARs involucradas en este proceso pueden ser escindidas proteolíticamente por neurotoxinas bacterianas que dan lugar a las condiciones de botulismo y tétanos.
Las SNAR se encuentran en dos localizaciones, las V-snares se encuentran en las membranas de las vesículas de transporte durante el proceso de gemación, mientras que las T-snares se pueden encontrar en las membranas de los compartimentos objetivo.
El acto de fusión de vesículas coincide con aumentos de calcio intracelular. La fusión de vesículas sinápticas en la neurotransmisión da como resultado la activación de canales de calcio dependientes de voltaje en la célula diana. La afluencia de calcio ayuda a estimular la fusión de vesículas. En el sistema endocrino, la unión de hormonas a receptores acoplados a proteína G activa el sistema IP3/DAG para aumentar los niveles de calcio.
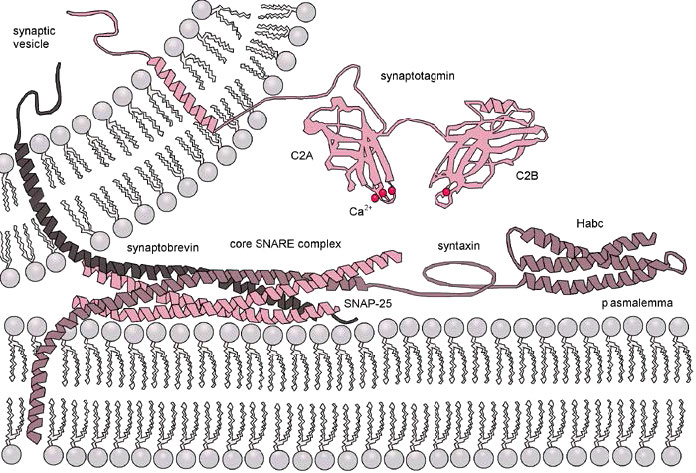
En el proceso de fusión de membrana (Figura 3.62), los lazos en V de una vesícula secretora (superior izquierda) interactúan con los lazos T de una membrana diana (parte inferior). Los lazos en V y T se “cierran” para acercar la vesícula de la membrana y la membrana objetivo.
La cremallera también provoca aplanamiento y tensión lateral de las superficies curvadas de la membrana, favoreciendo la hemifusión de las capas externas de cada membrana. La tensión continua también da como resultado la posterior fusión de las membranas internas, produciendo la apertura del contenido de la cámara vesicular a su objetivo (generalmente fuera de la célula).
Shuttles
Otra forma de transportar artículos a través de una membrana para la que no hay un sistema de transporte específico disponible es el uso de lanzaderas. Las lanzaderas son importantes cuando no hay un mecanismo de transporte para mover material a través de una membrana para la que no existe ningún sistema de transporte.
Un gran ejemplo es el NADH. El NADH es un importante portador de electrones que se produce en el citoplasma y las mitocondrias de la célula. El NADH producido en la mitocondria va directamente al sistema de transporte de electrones y entrega electrones al Complejo I. El NADH producido en el citoplasma (como por ejemplo de la glucólisis) no tiene esta opción, ya que la membrana interna de la mitocondria es impermeable a la molécula y no existe ningún transportador para moverse a través. La parte importante del NADH es su carga de electrones, por lo que las células han evolucionado de dos maneras de mover los electrones a la matriz mitocondrial aparte del NADH.
Ambos métodos involucran lanzaderas. En cada caso, una molécula aceptora recibe electrones del NADH y se transporta la forma reducida de la molécula aceptora. Se transporta a la matriz donde se oxida (se pierden electrones) y luego se dona al sistema de transporte de electrones.
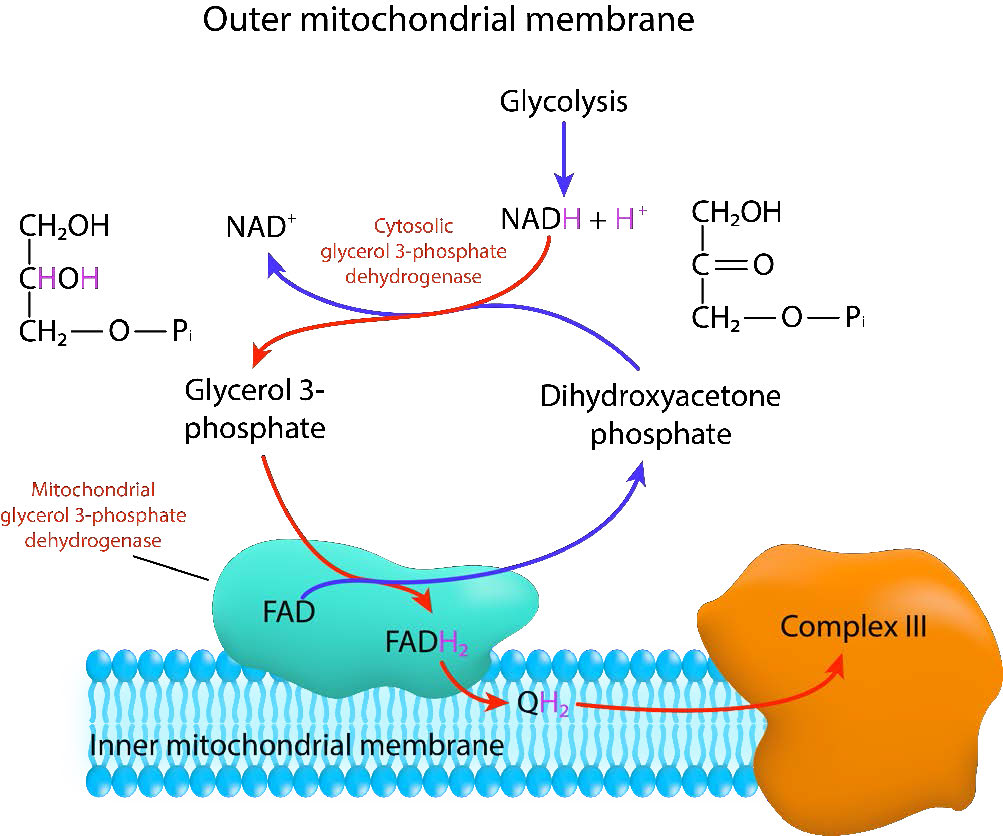
lanzadera de fosfato de glicerol
El primero de estos métodos es el menos eficiente, pero es rápido. Se encuentra comúnmente en músculos que tienen necesidades de energía rápida y tejido cerebral. Esta lanzadera se denomina lanzadera de fosfato de glicerol y se muestra en la Figura 3.63. Opera en el espacio intermembranario entre las membranas mitocondriales interna y externa. La membrana mitocondrial externa es muy porosa, permitiendo que muchos materiales pasen libremente a través de ella. En el espacio intermembrana, la enzima citoplasmática, gliceraldehído-3-fosfato deshidrogenasa (CgPD) cataliza la transferencia de electrones de NADH a fosfato de dididroxiacetona (#2 en la figura), produciendo NAD+ y gliceraldehído-3-fosfato (#1 en la figura). El gliceraldehído-3-fosfato luego se une a una gliceraldehído-3-fosfato deshidrogenasa (MgPd) incrustada en la porción externa de la membrana mitocondrial interna. MgPd cataliza la transferencia de electrones de gliceraldehído-3-fosfato a FAD, produciendo dihidroxiacetona fosfato y FADH2. FADH2 luego transfiere sus electrones al sistema de transporte de electrones a través de CoQ (Q anterior), formando CoQH2 (QH2 anterior). Como se discutirá en la sección sobre transporte de electrones, este no es un sistema lanzadera eficiente porque no da como resultado la producción de tanto ATP como ocurre cuando los electrones son transferidos a NAD+ en lugar de FAD.
Transbordador malato-aspartato
Un sistema más eficiente de transferencia de electrones es el lanzadera malato-aspartato y se muestra en la Figura 3.64. Como es evidente en la figura, esta lanzadera implica más pasos que la lanzadera de fosfato de glicerol, pero la ventaja de la lanzadera de malato-aspartato es que es más eficiente. El NADH fuera de la mitocondria transfiere sus electrones a la lanzadera y luego el NADH se vuelve a hacer en el interior de la lanzadera. No se gasta energía en el proceso.
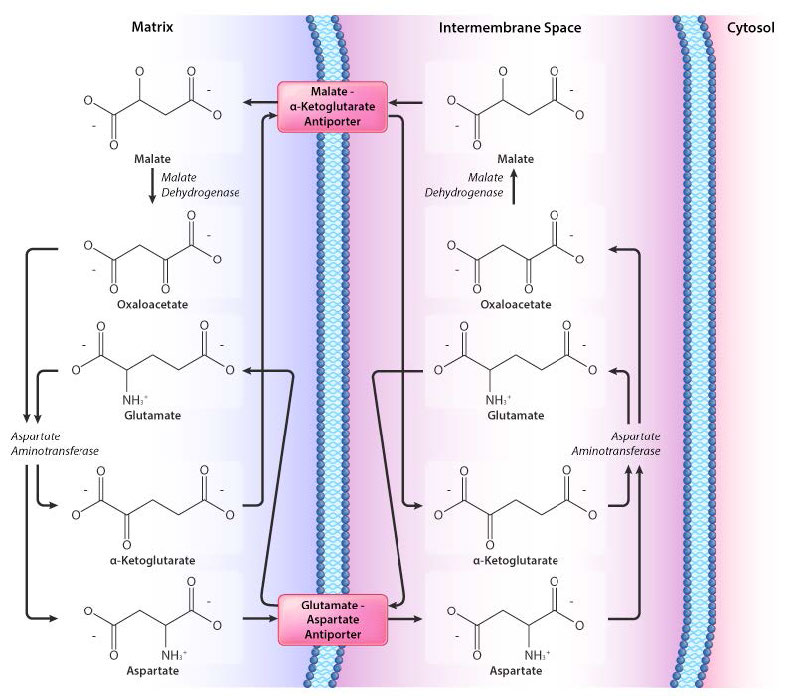
Cuando el NADH se acumula en el citoplasma, se mueve al espacio intermembrana donde la enzima malato deshidrogenasa cataliza la transferencia de electrones al oxaloacetato para producir NAD+ y malato. Un sistema de transporte de malato mueve el malato a la matriz mitocondrial a cambio de α-cetoglutarato.
Dentro de la mitocondria, el malato se reoxida a oxaloacetato y se le dan electrones al NAD+ para recrear el NADH. Luego, el NADH dona electrones al Complejo I del sistema de transporte de electrones. Eso es realmente todo lo que hay para el transbordador. Los pasos restantes son simplemente equilibrar la ecuación del proceso. El oxaloacetato acepta un grupo amina del ácido glutámico para producir ácido aspártico y α-cetoglutarato. El aspartato luego sale de la mitocondria a través de una proteína de transporte antiport que lo cambia por glutamato. Una serie de reacciones en el espacio intermembrana equilibran la ecuación.
Es fácil perderse en el lío de equilibrar ecuaciones. Lo más importante a entender aquí es que el oxaloacetato acepta electrones en el exterior para convertirse en malato que es el portador de electrones a través de la membrana. Una vez dentro de la matriz, el malato se convierte de nuevo en oxaloacetato y sus electrones se dan a NAD+, formando NADH. Todo lo demás es simple equilibrio de ecuaciones.
Transbordador acetil-CoA
Otro tipo de lanzadera también involucra a la mitocondria y en este caso, el elemento que se mueve es una molécula, no un par de electrones. La molécula de interés aquí es acetil-CoA, para la cual no opera ningún sistema de transporte, pero que es necesaria en el citoplasma para la síntesis de ácidos grasos cuando la célula tiene abundante energía.
El acetil-CoA se encuentra principalmente en la mitocondria y mientras el ciclo del ácido cítrico esté operando de manera eficiente, su concentración es relativamente estable. Sin embargo, cuando el ciclo del ácido cítrico se ralentiza, comienzan a acumularse acetil-CoA y el citrato elaborado a partir de él en el ciclo.
Existe un sistema de transporte de membrana para el citrato, por lo que se mueve hacia el citoplasma. En el citoplasma, una enzima conocida como citrato liasa escinde citrato en acetil-CoA y oxaloacetato. El oxaloacetato puede reducirse a malato y trasladarse de nuevo a la mitocondria.
En cuanto al acetil-CoA, cuanto más tengan esas células en el citoplasma, más probabilidades habrá de comenzar a producir ácidos grasos y grasas, ya que el acetil-CoA es el material de partida para la síntesis de ácidos grasos, que ocurre en el citoplasma. ¿Cuándo ocurre este proceso? Como se señaló anteriormente, ocurre cuando el ciclo del ácido cítrico se detiene y esto ocurre cuando aumentan los niveles de NADH y FADH2. Estos, por supuesto, aumentan cuando uno no está quemando tantas calorías como se está consumiendo como subproducto del control respiratorio. La falta de ejercicio conduce a niveles más altos de portadores de electrones reducidos.
Cruces celulares
Las células de los organismos multicelulares están en estrecho contacto entre sí y los vínculos entre ellas se denominan uniones. En los organismos vertebrados, existen tres tipos principales de uniones celulares y una de ellas (uniones gap) es importante para el movimiento de materiales entre células. Los tres tipos son
- Cruces de separación
- Uniones adherentes, (Uniones de anclaje, desmosomas y hemidesmosomas)
- Cruces apretados
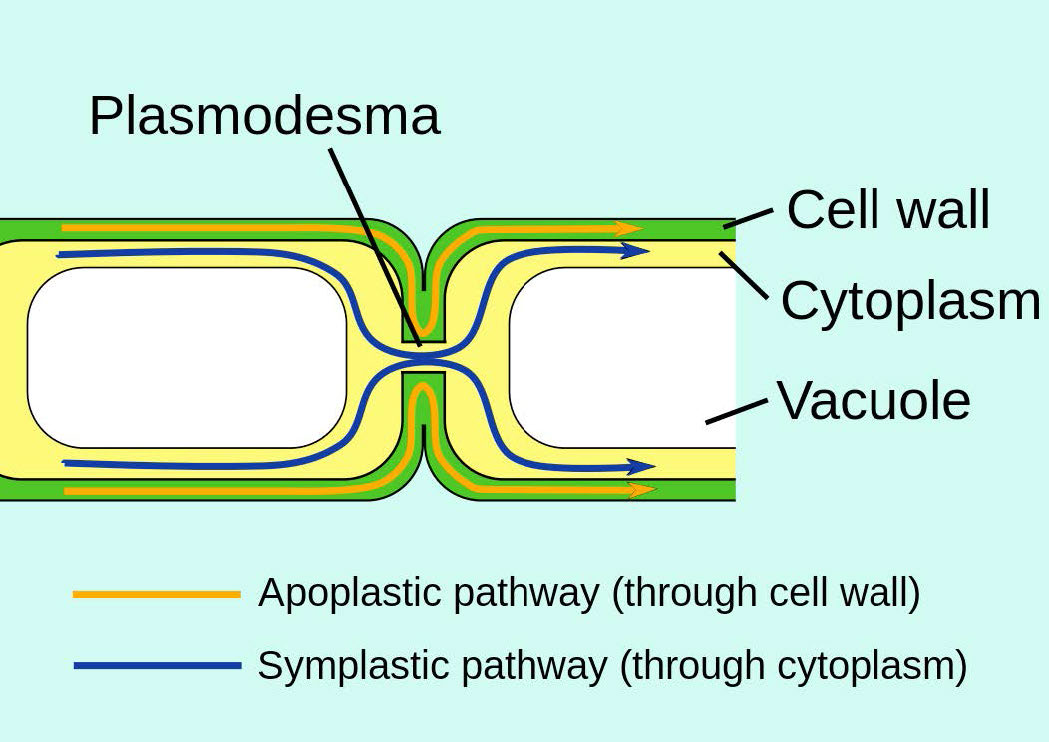
Las uniones celulares en plantas multicelulares están estructuradas de manera diferente a las de los vertebrados y se denominan plasmodesmas. Ellos también funcionan en intercambio de materiales entre células individuales.
Cruces de separación
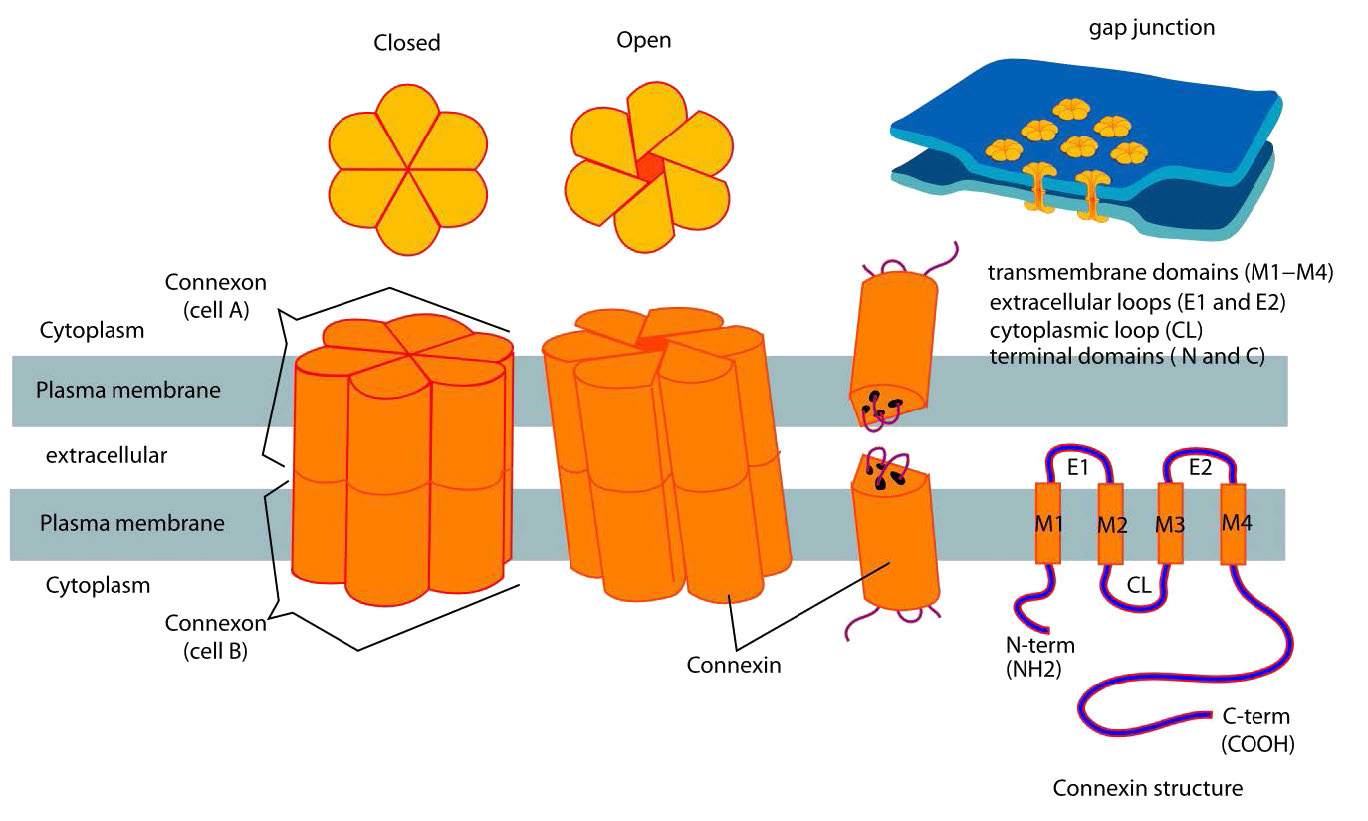
Las uniones gap son estructuras especializadas compuestas por dos conjuntos de estructuras llamadas conexones (una de cada célula - ver Figura 3.65) enlazan directamente los citoplasmas de las células conectadas. Las uniones de brecha se regulan para controlar el flujo de moléculas, iones e impulsos eléctricos entre las células. En las plantas, estructuras similares conocidas como plasmodesmas atraviesan la pared celular (Figura 3.66) y realizan funciones similares.
Adhiere uniones
Las uniones adherentes (Figura 3.67) son complejos proteicos en el lado citoplásmico de las membranas celulares de tejidos epiteliales y endoteliales que enlazan las células entre sí o con la matriz extracelular. Corresponden a los adherentes de fascia encontrados en células no epiteliales/no endoteliales.
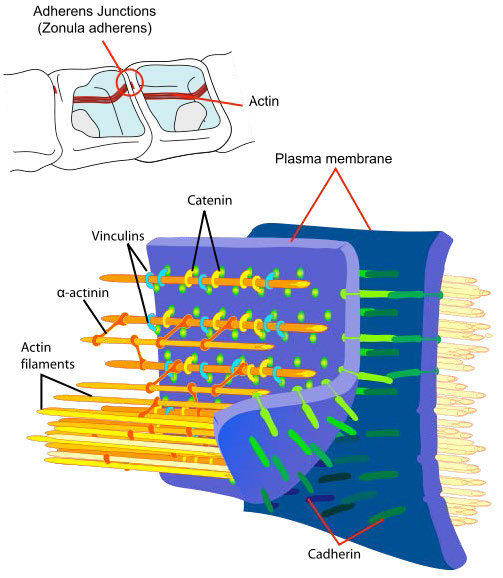
Las uniones adherentes contienen las siguientes proteínas: 1) α-catenina (se une a cadherina a través de β-catenina); 2) β-catenina (unión de α-catenina a cadherina; 3) γ-catenina (se une a cadherina); 4) cadherinas (grupo de proteínas transmembrana que dimerizan con cadherinas en células adyacentes; 5) p120 (también llamado δ-catenina - se une a cadherina); 6) plakoglobina (proteína de la familia catenina homóloga y que actúa como β-catenina); 7) actina; 8) actinina; y 9) vinculina. Las uniones adherentes pueden ayudar a mantener el anillo contráctil de actina que se forma en el proceso de citocinesis.
Cruces apretados
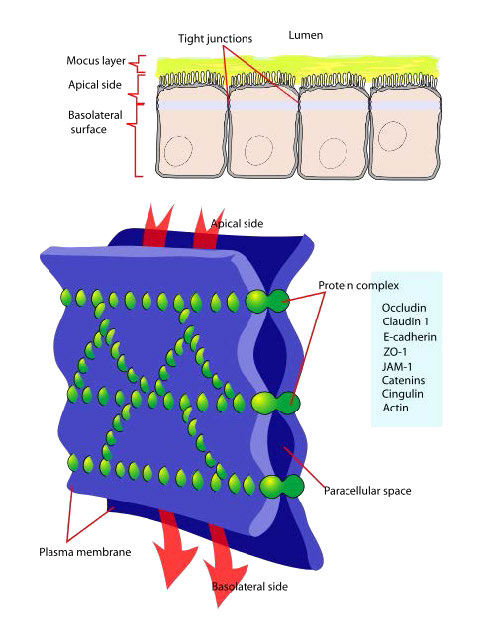
Las uniones estrechas (Figura 3.68) son una red de cadenas proteicas que sellan las células entre sí y restringen el flujo de iones en los espacios entre ellas. El efecto de su estructura es restringir el movimiento de los materiales a través de los tejidos exigiéndoles que pasen a través de las células en lugar de alrededor de ellos. Las uniones estrechas unen los citoesqueletos de las células y a través de su estructura mantienen su polaridad apical y basolateral.
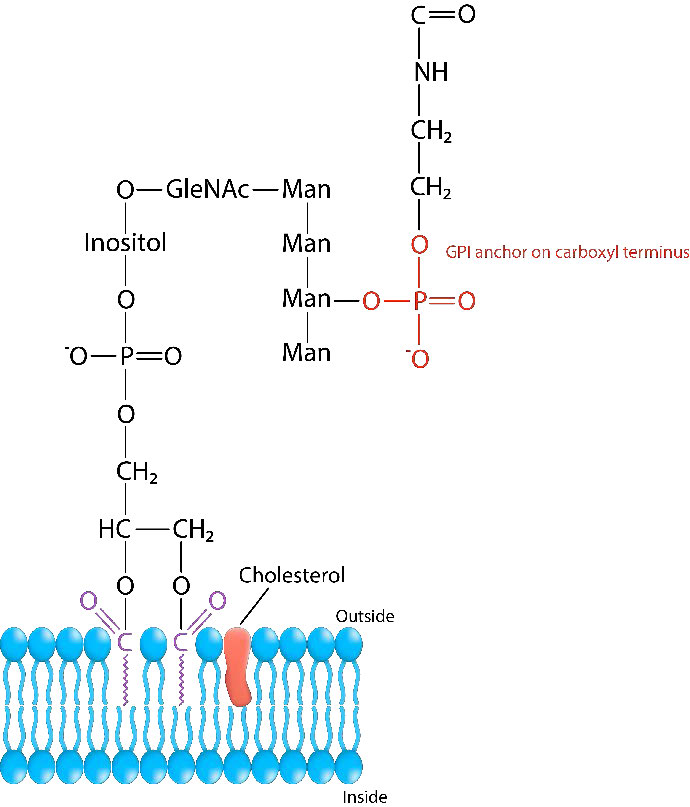
Anclajes GPI
Las proteínas de membrana unidas al glicosilfosfatidilinositol (también conocido como anclaje GPI) se denominan glipiadas. Las proteínas, que desempeñan un papel importante en muchos procesos bioquímicos, están unidas al anclaje GPI en su extremo carboxilo. Las fosfolipasas, como la fosfolipasa C pueden cortar el enlace entre la proteína y el GPI, liberando la proteína de la membrana celular externa. Las proteínas destinadas a ser glipiadas tienen dos secuencias señal. Son 1) Una secuencia señal N-terminal y 2) Una secuencia señal C-terminal que es reconocida por una transamidasa GPI (GPIT). Las secuencias señal N-terminales son responsables de dirigir el transporte co-traduccional al retículo endoplásmico. La secuencia C-terminal es reconocida por la transamidasa GPI, que une el extremo carboxi de una proteína con el anclaje GPI.
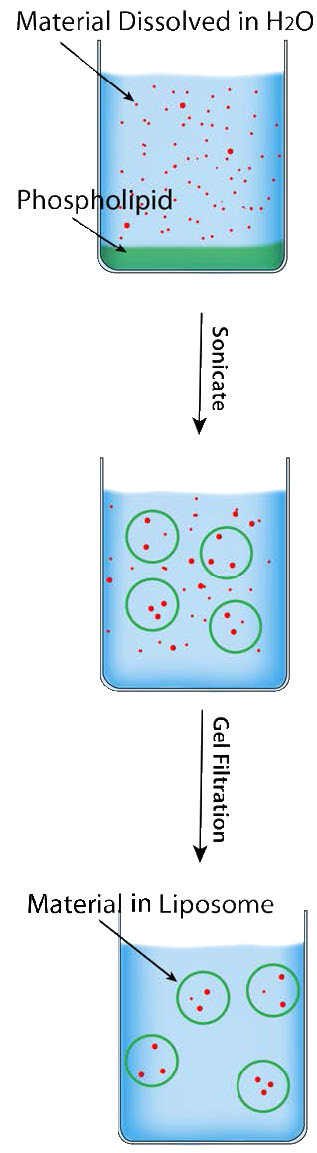
Liposomas
La capacidad espontánea de los compuestos fosfoglicerolípidos y esfingolípidos para formar bicapas lipídicas se explota en la formación de estructuras membranosas artificiales llamadas liposomas (Figura 3.69). Los liposomas son útiles para entregar su contenido a las células a través de la fusión de membrana. En la figura, los ítems dirigidos para la entrega a las células se encerrarían en la región circular media del liposomas y cuando el liposomas se fusiona con la membrana celular, entregará el contenido directamente al citoplasma.
Índice de hidropatía
La porción interior de la bicapa lipídica es muy hidrofóbica, lo que la hace muy restrictiva al movimiento de iones y sustancias polares a través de ella. Esta propiedad también pone limitaciones en los tipos de aminoácidos que interactuarán con ella también. Debido a esto, los dominios proteicos transmembrana que se encuentran en las proteínas integrales de membrana están sesgados en los aminoácidos que interactúan con la bicapa lipídica o el material acuoso a cada lado de la misma.
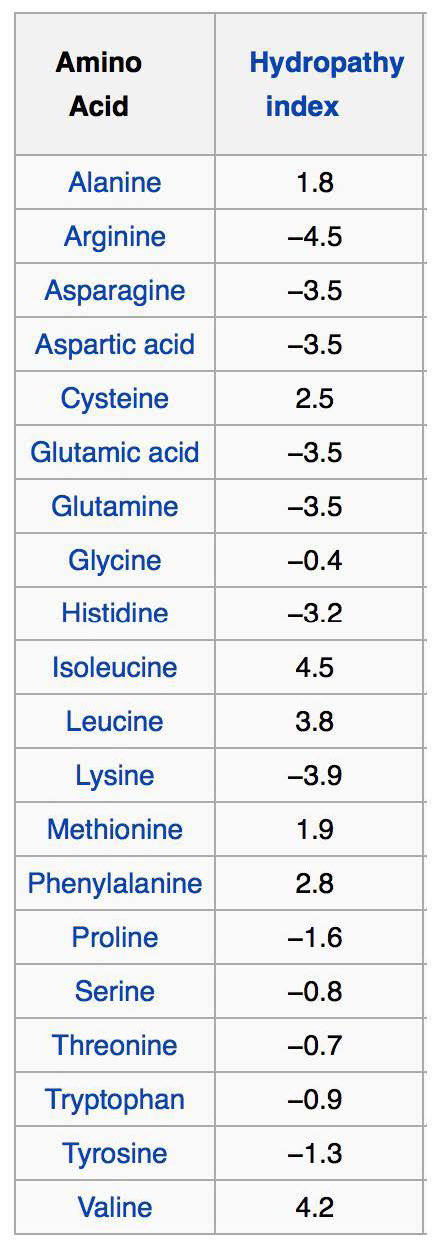
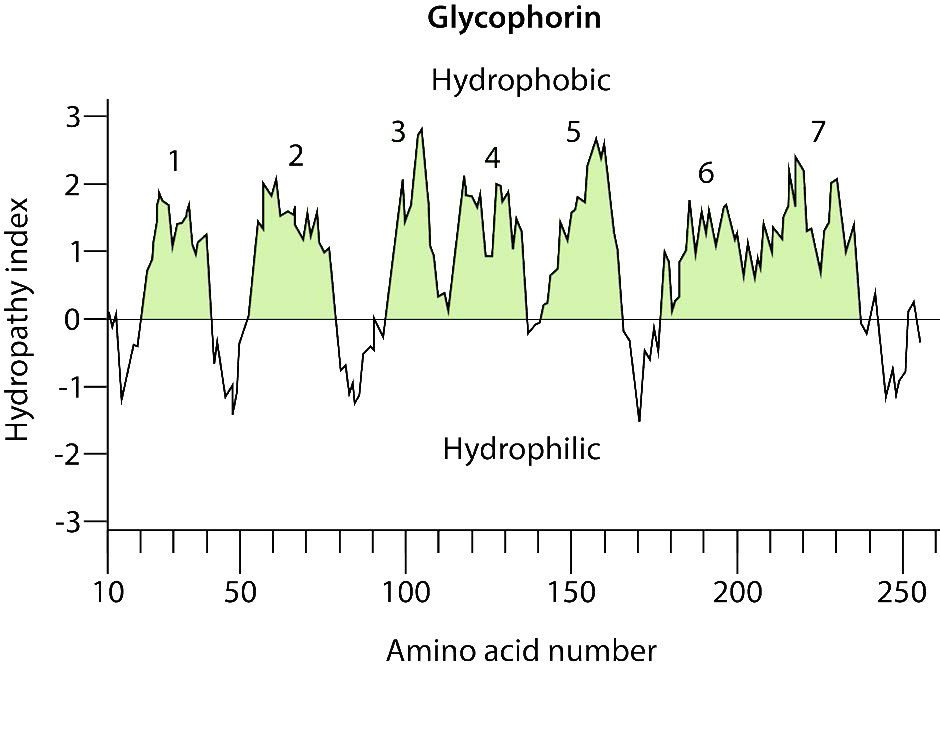
Los aminoácidos hidrófobos se encuentran dentro de la bicapa, mientras que los aminoácidos hidrófilos se encuentran predominantemente en las superficies. Una pista adicional para identificar regiones de cruce de membrana de una proteína es que el triptófano o tirosina se posiciona comúnmente en las interfases no polares/polares de la bicapa lipídica para proteínas integrales. Tal organización de aminoácidos puede reconocerse mediante análisis por computadora de secuencias de aminoácidos usando lo que se llama un índice/ puntuación de hidropatía (Figura 3.71). Aunque los nombres y las puntuaciones varían, la idea es asignar un número (generalmente positivo) a las cadenas laterales de aminoácidos con mayor hidrofobicidad y negativo a las que son iónicas. Con estas puntuaciones, un programa de computadora puede encontrar fácilmente las puntuaciones promedio de segmentos cortos de aminoácidos (digamos 3 aminoácidos de largo) y luego graficar esos valores en una gráfica del índice de hidrofobicidad versus posición en la cadena polipeptídica. Hacer eso para una proteína transmembrana como la glicoforina da como resultado la gráfica que se muestra en la Figura 3.72. Es evidente en el análisis que se trata de una proteína transmembrana que tiene siete dominios cruzando la bicapa lipídica, tal como está marcada.
Paredes celulares
Las paredes celulares se encuentran en muchas células, incluyendo plantas, hongos y bacterias, pero no se encuentran en las células animales. Están diseñados para proporcionar resistencia e integridad y al menos alguna protección contra el estallido de la presión osmótica (Figuras 3.73-3.75).

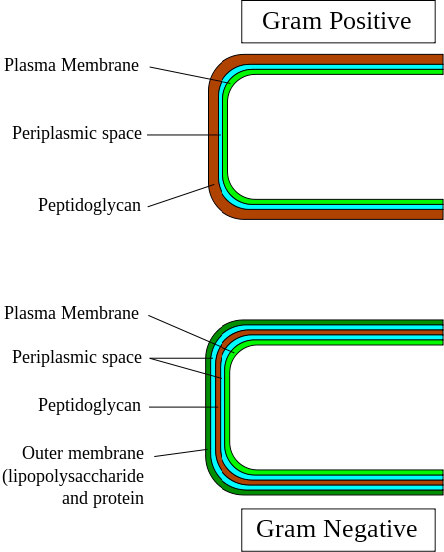
Las bacterias Gram positivas (Figura 3.75) tienen el diseño de pared celular más simple. Moviéndose desde el exterior de la célula hacia el citoplasma hay una capa externa de peptidoglicano para la pared celular seguida de un espacio periplásmico, una membrana plasmática y luego el citoplasma. Las bacterias Gram negativas agregan una segunda capa protectora externa a todo esto, por lo que para ellas, comenzando por el exterior y moviéndose hacia adentro, se encuentra una capa externa de lipopolisacárido, un espacio periplásmico, la pared celular del peptidoglicano, un segundo espacio periplásmico, una membrana plasmática y luego el citoplasma.
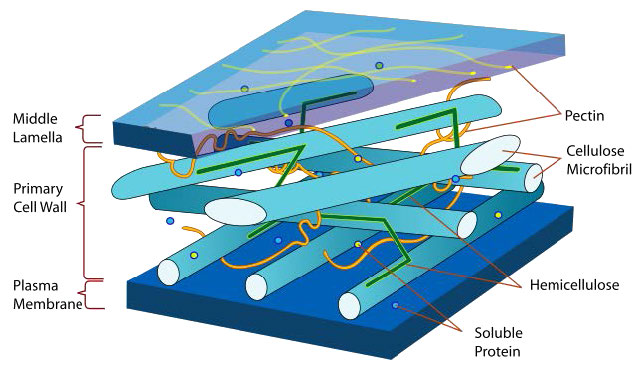
Las plantas herbáceas tienen una pared celular externa rígida (compuesta principalmente de celulosa, hemicelulosa y pectina) y una membrana plasmática interna. Las plantas leñosas agregan un segundo nivel de pared con lignina entre la pared celulósica y la membrana plasmática de las plantas herbáceas.
BB Wonderland
Al ritmo de “Winter Wonderland”
Melodías metabólicas Sitio web AQUÍ
Salón Milam - Son las 12:30
Y Ahern se está poniendo prolijo
Él camina hacia y desde '
Mientras no se habla lento
Dándolo a B-B-4-5-0
Yo estaba feliz cuando empezó el término
Apuntes de conferencias y videos en gran cantidad
Se agregaron MP3 a mi iPod
Pero las recitaciones a veces eran aburridas
Y los exámenes me mordieron más o menos
Cuando la curva resultó fea
No creo que sea así
Mis puntuaciones son demasiado bajas
Slidin' por en B-B-4-5-0
Por último, hay un examen
El 9 de diciembre a las 6:00pm
Voy a tener mi tarjeta llena de información
Entonces no tengo que memorizarlo
Y me sentiré como un sabelotodo
Con mi cardy de notas atasco
Sólo uno más para ir
Y luego ho-ho-ho
Terminaré con B-B-4-5-0
Grabación de David Simmons
Letras de Kevin Ahern
Recording por David Simmons Letras por Kevin Ahern
334
Gracias a Dios Hay un Video
A la melodía de “Gracias a Dios soy un chico de campo”
Melodías metabólicas Sitio web AQUÍ
Hay un paquete de cosas que un estudiante debería saber
Y la charla de Ahern no es realmente muy lenta
Aprenderno' no es fácil/las conferencias un poco golpe
Gracias a Dios hay un video
Bueno hemos pasado por los ciclos y sus enzimas también
Estudiando la regulación todo es nuevo
tengo que admitir que no tengo ni idea
¿Qué voy a hacer?
Entonces me conseguí una tarjeta de nota y me compré un Stryer
Me bajaron las enzimas y los nombres que requiere
espero poder reunir un poco más de deseo
Gracias a Dios hay un video
Acabo de ponerse al día sobre los
protones N-A-D que se mueven a través de Complex Vee
Electrons bailan en el citocromo C
Tengo que escuchar el MP3
La oxidación de ácidos grasos hace acetil-CoA
Dentro de la matriz interna de la mitocondria-ay
Es muy complicado, supongo que tengo que decir
Gracias a Dios hay un video
Entonces me conseguí una tarjeta de nota y me compré un Stryer
Me bajaron las enzimas y los nombres que requiere
espero poder reunir un poco más de deseo
Gracias a Dios hay un video
La replicación es algo fácil de una manera simple Copiar las bases
en los ADN plasmídicos
Gs va con Cs y Ts van con As
Gracias a la polimerasa
Y el ADN es un molde para las
hélices de ARN que se desenrollan en T-A-T-A La
terminación ocurre, luego la enzima desaparece
No olvides el poli-A
Entonces me conseguí una tarjeta de nota y me compré un Stryer
Me bajaron las enzimas y los nombres que requiere
creo que puedo reunir un poco más de deseo
Gracias a Dios hay un video
Grabación de David Simmons
Letras de Kevin Ahern
Recording por David Simmons Letras por Kevin Ahern


