8.9: FRET
- Page ID
- 53303
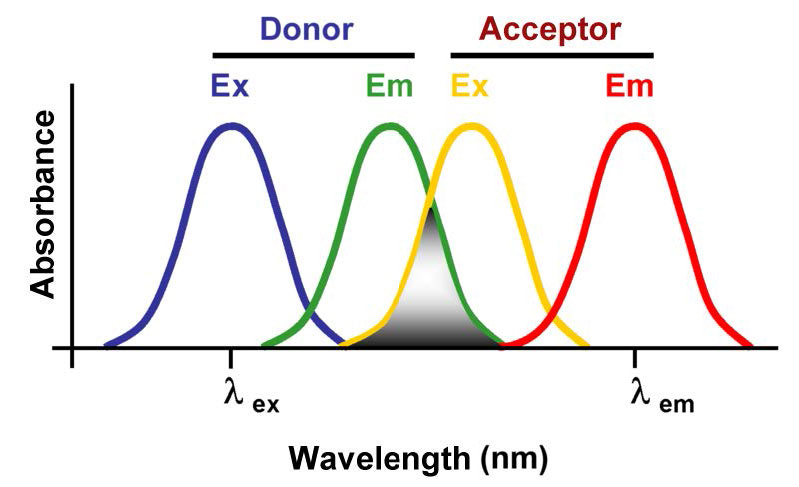
Otro método para detectar interacciones moleculares es la transferencia de energía por resonancia de fluorescencia (FRET), también llamada transferencia de energía de resonancia de Förster, transferencia de energía de resonancia (RET) o transferencia electrónica de energía (EET). La técnica se basa en la observación de que una molécula excitada por la absorción de luz puede transferir energía a una molécula cercana si el espectro de emisión de la primera molécula se solapa con el espectro de excitación de la segunda (Figura\(\PageIndex{1}\)) Esta transferencia de energía solo puede tener lugar si las dos las moléculas están suficientemente juntas (no más de unos pocos nanómetros de distancia).
En la técnica, un fluoróforo donante o un fluoróforo aceptor se une covalentemente a dos moléculas de interés. El fluoróforo aceptor está diseñado para aceptar energía de la molécula donadora (línea punteada naranja en la Figura\(\PageIndex{2}\)) y fluorescer a una longitud de onda única (flecha roja) cuando recibe esa energía del donante.
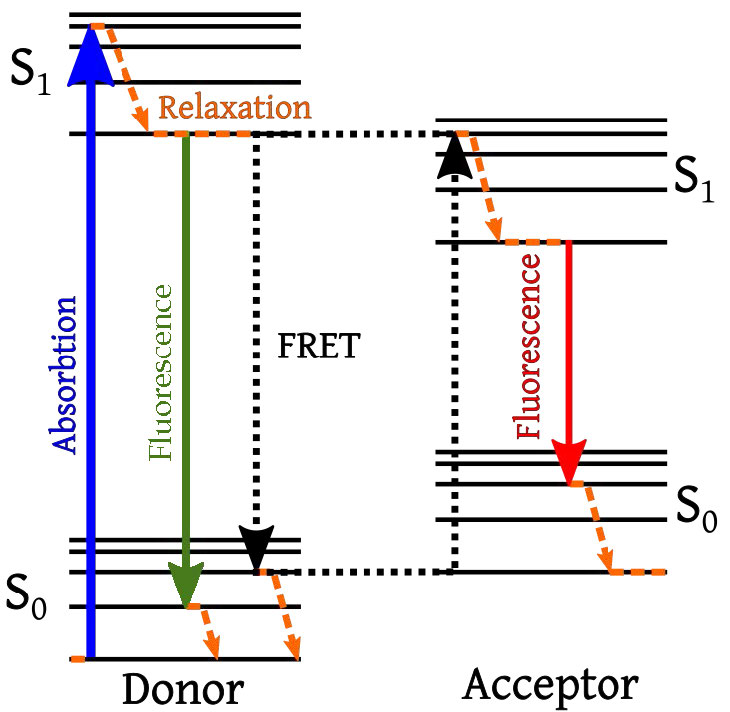
Figura\(\PageIndex{2}\): Transferencia de energía por resonancia de fluorescencia entre cromóforos donador y aceptor. Imagen de Pehr Jacobson
Además, la longitud de onda de la luz que absorbe el donador se adapta de manera única para el fluoróforo donante y no tiene ningún efecto sobre el fluoróforo aceptor. La única forma en que el aceptor puede fluorescer es si está lo suficientemente cerca como para recibir la energía transferida del donante (flecha roja). Esta fluorescencia tendrá una longitud de onda única, también. Si el donante y el aceptor no están lo suficientemente cercanos entre sí, el donante emite fluorescencia y emite luz correspondiente a la flecha verde o negra. Estas son longitudes de onda diferentes a las de la flecha roja.
El experimento comienza en la célula con una proteína con un fluoróforo donante y la otra proteína con un fluoróforo aceptor. La luz de una longitud de onda que excita al fluoróforo donante se resplandece sobre la célula. Si una proteína con un donante interactúa con la proteína portadora de un aceptor, entonces se produce la transferencia de energía del fluoróforo donante al aceptor y se detecta la fluorescencia única (línea roja) del aceptor. Si las dos proteínas no interactúan, entonces se detecta poca o ninguna fluorescencia del aceptor.


