4.11: Inhibición enzimática
- Page ID
- 53516
Sin efecto en\(V_{MAX}\)
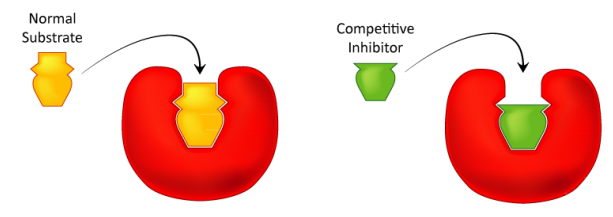
Cómo estudiamos la inhibición competitiva. Normalmente se realiza de la siguiente manera. En primer lugar se realiza un conjunto de reacciones V vs [S] sin inhibidor (aproximadamente 20 tubos, con tampón y cantidades constantes de enzima, cantidades variables de sustrato, tiempos de reacción iguales). Se grafica V vs. [S], así como 1/V vs. 1/ [S], si se desea. A continuación, se realiza un segundo conjunto de reacciones de la misma manera que antes, excepto que se agrega una cantidad fija del inhibidor de metotrexato a cada tubo. A bajas concentraciones de sustrato, el inhibidor compite por la enzima de manera efectiva, pero a altas concentraciones de sustrato, el inhibidor tendrá un efecto muy reducido, ya que el sustrato lo supera, debido a su mayor concentración (recuerde que el inhibidor está a concentración fija). Gráficamente, los resultados de estos experimentos se muestran arriba. Observe que a altas concentraciones de sustrato, el inhibidor competitivo esencialmente no tiene ningún efecto, provocando que el Vmax para la enzima permanezca sin cambios. Para reiterar, esto se debe a que a altas concentraciones de sustrato, el inhibidor no compite bien. Sin embargo, a concentraciones de sustrato más bajas lo hace.
Aumento de KM
Obsérvese que la KM aparente de la enzima para el sustrato aumenta (-1/KM se acerca a cero - línea roja anterior) cuando el inhibidor está presente, ilustrando así la mejor competencia del inhibidor a concentraciones de sustrato más bajas. Puede que no sea obvio por qué llamamos al KM cambiado el KM aparente de la enzima. La razón es que el inhibidor en realidad no cambia la afinidad de la enzima por el sustrato de folato. Sólo parece hacerlo. Esto se debe a la forma en que funciona la inhibición competitiva. Cuando el inhibidor competitivo se une a la enzima, efectivamente se 'saca de acción'. Las enzimas inactivas no tienen afinidad por el sustrato y tampoco tienen actividad. No podemos medir KM para una enzima inactiva.
Las moléculas enzimáticas que no están unidas por metotrexato pueden, de hecho, unirse al folato y son activas. El metotrexato no tiene ningún efecto sobre ellos y sus valores de KM no cambian. ¿Por qué entonces, el KM aparece más alto en presencia de un inhibidor competitivo? La razón es que el inhibidor competitivo está reduciendo la cantidad de enzima activa a menores concentraciones de sustrato. Cuando se reduce la cantidad de enzima, se debe tener más sustrato para suministrar la cantidad reducida de enzima suficientemente para llegar a Vmax/2.
Cabe señalar que en la inhibición competitiva, el porcentaje de enzimas
inactivas cambia drásticamente en el rango de valores [S]
utilizados. Para comenzar, a valores bajos de [S], se inhibe el mayor porcentaje de la
enzima. A alta [S], no se inhibe ningún porcentaje significativo de
enzima. Esto no siempre es así, como veremos
en la inhibición no competitiva.
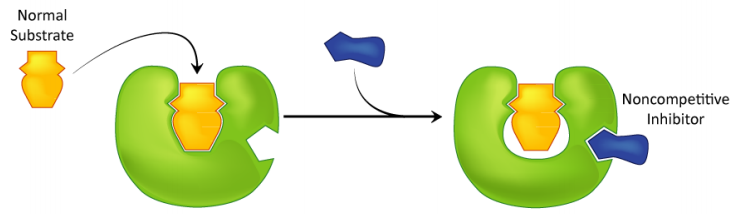
Inhibición no competitiva