6.3: Glicólisis
- Page ID
- 53919
La glucólisis, que literalmente significa “descomposición del azúcar”, es un proceso catabólico en el que los azúcares de seis carbonos (hexosas) se oxidan y se descomponen en moléculas de piruvato. La vía anabólica correspondiente por la que se sintetiza la glucosa se denomina gluconeogénesis. Tanto la glucólisis como la gluconeogénesis no son procesos oxidativos/reductores importantes por sí mismos, con un paso en cada uno involucrando pérdida/ganancia de electrones, pero el producto de la glucólisis, el piruvato, puede oxidarse completamente a dióxido de carbono. De hecho, sin la producción de piruvato a partir de glucosa en la glucólisis, no se dispone de una fuente de energía importante para la célula. Por el contrario, la gluconeogénesis puede sintetizar glucosa reductivamente a partir de materiales muy simples, como piruvato y acetil-CoA/ glioxilato (al menos en plantas). Por estas razones incluimos estas vías en la colección roja/buey.
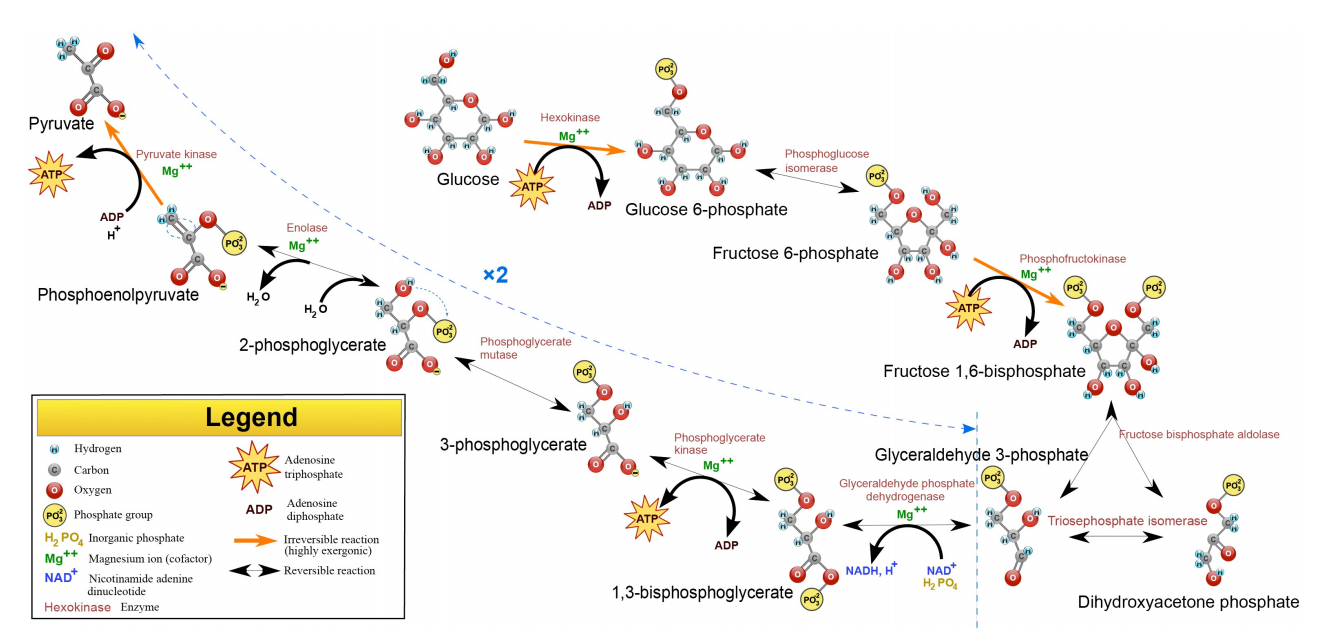
La glucosa es la hexosa más abundante en la naturaleza y es la que las personas suelen asociar con la glucólisis, pero la fructosa (en forma de fructosa-6-fosfato) se metaboliza en la célula y la galactosa puede convertirse fácilmente en glucosa para catabolismo en la vía también. Los productos metabólicos finales de la vía son dos moléculas de ATP, dos moléculas de NADH y dos moléculas de piruvato, que, a su vez, pueden oxidarse aún más en el ciclo del ácido cítrico.
Intermedios
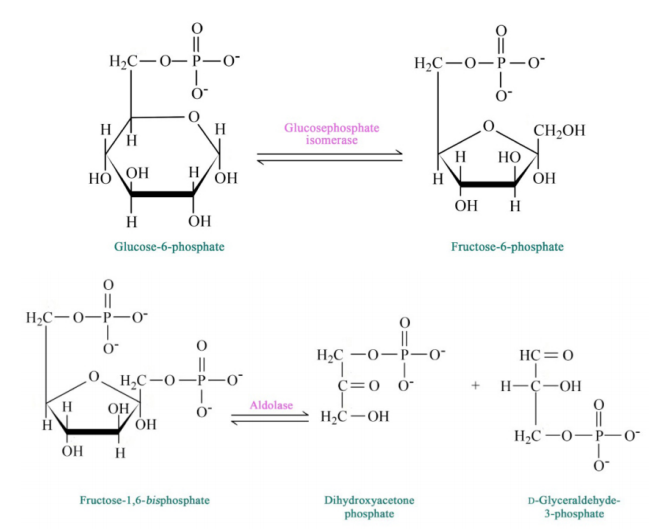
La glucosa y la fructosa son los 'embudos' de azúcar que sirven como puntos de entrada a la vía glucolítica. Otros azúcares deben ser convertidos a cualquiera de estas formas para ser metabolizados directamente. Algunas vías, incluyendo el Ciclo Calvino y la Vía de Pentosa Fosfato (PPP, ver más adelante) contienen intermedios en común con la glucólisis, por lo que en ese sentido, casi cualquier azúcar celular puede metabolizarse aquí. Los intermedios de glucólisis que son comunes a otras vías incluyen glucosa-6-fosfato (PPP, metabolismo del glucógeno), F6P (PPP), G3P (Calvin, PPP), DHAP (PPP, metabolismo del glicerol, Calvin), 3PG (Calvin, PPP), PEP (metabolismo vegetal C4, Calvino) y piruvato (fermentación, acetil-CoA génesis, metabolismo de aminoácidos).
Reacciones
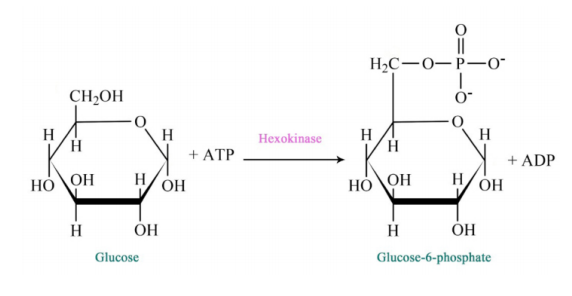
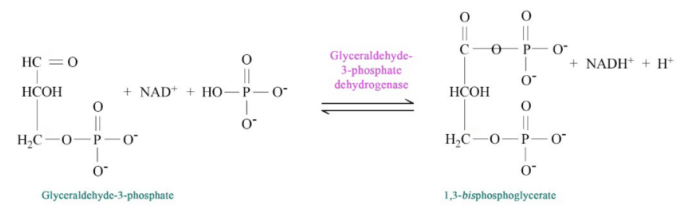
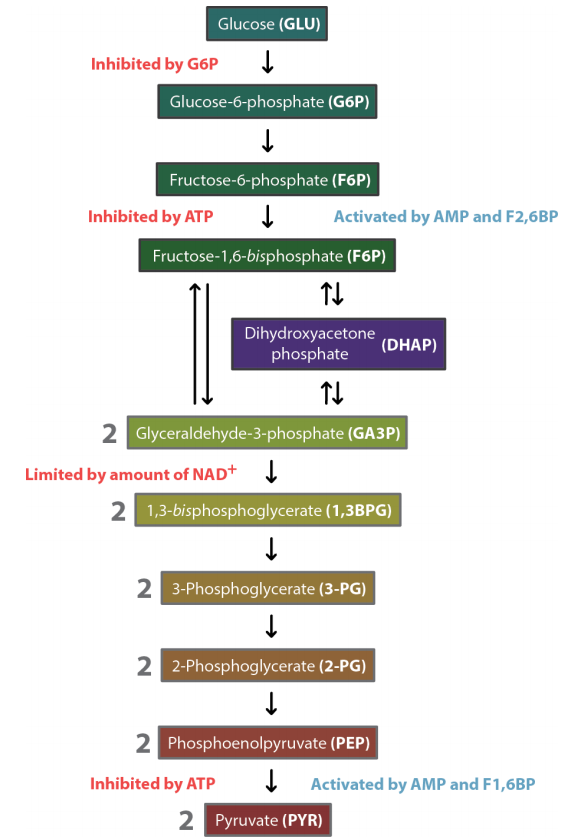
La vía de la glucólisis comienza con dos entradas de energía. Primero, la glucosa obtiene un fosfato del ATP para producir glucosa-6-fosfato (G6P) y posteriormente la fructosa-6-fosfato (F6P) obtiene otro fosfato del ATP para producir fructosa-1,6-bisfosfato (F1,6BP). Con la bomba así cebada, la vía procede primero para dividir el F1,6BP en dos intermedios de 3 carbonos. Posteriormente se produce el único paso de oxidación en toda la ruta. En esa reacción, el gliceraldehído-3-fosfato (G3P) se oxida y se agrega un fosfato, creando 1,3-bisfosfoglicerato (1,3 BPG).
La adición del fosfato a veces oculta la oxidación que se produjo. El G3P fue un aldehído. 1,3 BGP es un ácido esterificado a fosfato. Los dos fosfatos en la diminuta molécula de 1,3BPG se repelen entre sí y le dan a la molécula alta energía. Utiliza esta energía para fosforilar ADP para producir ATP.
Dado que hay dos 1,3 BPGs producidos por cada glucosa, los dos ATP producidos reponen los dos ATP utilizados para iniciar el ciclo.
La síntesis de ATP directamente a partir de una reacción metabólica se conoce como fosforilación a nivel de sustrato, aunque no es una fuente significativa de ATP. La glucólisis tiene dos reacciones durante las cuales se produce la fosforilación a nivel de sustrato.

La transferencia de fosfato de 1,3BPG a ATP crea 3-fosfoglicerato (3-PG). La conversión de 3-PG a 2-PG ocurre por un mecanismo importante. Un intermedio en la reacción (catalizado por foshogly cerato mutasa) es 2,3 BPG. Este intermedio, que es estable, es liberado con baja frecuencia por la enzima en lugar de convertirse en 2-PG. 2,3BPG es importante porque se une a la hemoglobina y estimula la liberación de oxígeno. Así, las células que están metabolizando la glucosa liberan rápidamente más 2,3BPG y, como resultado, estimulan la liberación de más oxígeno, apoyando sus necesidades.
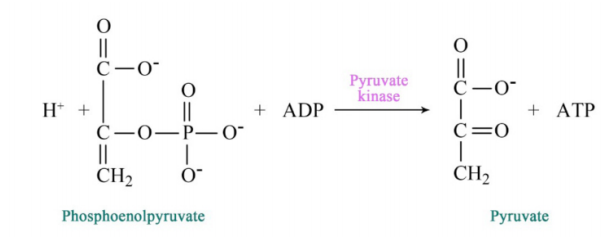
El 2-PG se convierte en fosfoenolpiruvato (PEP) mediante la eliminación de agua, creando un intermedio de muy alta energía. La conversión de PEP a piruvato es el segundo nivel de fosforilación de sustrato de la glucólisis, creando ATP. Hay casi suficiente energía en PEP para estimular la producción de un segundo ATP, pero no se utiliza. En consecuencia, la energía se pierde como calor. Si te preguntas por qué te pones caliente cuando haces ejercicio, la reacción que convierte PEP en piruvato es una de las principales culpables.
Enzimas/Control
El control de la glucólisis es inusual para una vía metabólica, ya que la regulación ocurre en tres puntos enzimáticos:
\[\underbrace{ \ce{Glucose <=> G6P}}_{\text{hexokinase} }\]
\[\underbrace{ \ce{F6P <=> F1,6BP}}_{\text{phosphofructokinase (PFK)} }\]
y
\[\underbrace{ \ce{PEP <=> pyruvate}}_{\text{pyruvate kinase} }.\]
La glucólisis está regulada de manera recíproca en comparación con su vía anabólica correspondiente, la gluconeogénesis. La regulación recíproca ocurre cuando la misma molécula o tratamiento (fosforilación, por ejemplo) tiene efectos opuestos sobre las vías catabólicas y anabólicas. La regulación recíproca es importante cuando las vías anabólicas y catabólicas correspondientes ocurren en la misma ubicación celular.
Como ejemplo, considere la regulación de PFK. Se activa por varias moléculas, lo que es más importante fructosa-2,6- bisfosfato (F2,6BP). Esta molécula tiene un efecto inhibitorio sobre la enzima gluconeogénesis correspondiente, la fructosa-1,6-bisfosfatasa (F1,6BPasa).
Quizás te preguntes por qué la piruvato quinasa, la última enzima de la ruta, está regulada. La respuesta es sencilla. La piruvato quinasa cataliza la reacción más rica energéticamente de la glucólisis. La reacción se ve favorecida tan fuertemente en la dirección hacia adelante que las células deben hacer un 'dos pasos' alrededor de ella en la dirección inversa al producir glucosa. En otras palabras, se necesitan dos enzimas, dos reacciones y dos trifosfatos para pasar de piruvato a PEP en la gluconeogénesis. Cuando las células necesitan producir glucosa, no se pueden desviar al hacer que el PEP que han hecho en la gluconeogénesis se convierta directamente de nuevo en piruvato por la piruvato quinasa. En consecuencia, la piruvato quinasa se inhibe durante la gluconeogénesis, para que no se produzca un “ciclo inútil”.
Otro mecanismo de control interesante llamado activación feedforward involucra piruvato quinasa. La piruvato quinasa es activada alostéricamente por F1,6BP. Esta molécula es un producto de la reacción PFK y un sustrato para la reacción de aldolasa. Cabe señalar que la reacción de aldolasa es energéticamente desfavorable (alto +\(\Delta\) G°'), permitiendo así que se acumule F1,6BP. Cuando esto sucede, parte del exceso de F1,6BP activa la piruvato quinasa, lo que pone en marcha la conversión de PEP en piruvato. La caída resultante en los niveles de PEP tiene el efecto de “tirar” sobre las reacciones que preceden a la piruvato quinasa. Como consecuencia, las concentraciones de G3P y DHAP disminuyen, ayudando a avanzar la reacción de la aldolasa.
Metabolismo del piruvato
Como se señaló, el piruvato producido en la glucólisis puede oxidarse a acetil-CoA, que a su vez se oxida en el ciclo del ácido cítrico a dióxido de carbono. Sin embargo, ese no es el único destino metabólico del piruvato.
El piruvato es un punto de “partida” para la gluconeogénesis, convirtiéndose en oxaloacetato en la mitocondria en el primer paso. El piruvato en animales también se puede reducir a lactato cuando el oxígeno es limitante. Esta reacción, que requiere NADH produce\(\text{NAD}^+\) y es crítica para generar esta última molécula para mantener la reacción de gliceraldehído-3-fosfato deshidrogenasa de glucólisis yendo cuando no hay oxígeno.
El oxígeno es necesario para que el sistema de transporte de electrones funcione y esto, a su vez, es lo que oxida al NADH\(\text{NAD}^+\). En ausencia de oxígeno, por lo tanto,\(\text{NAD}^+\) es necesario un medio alternativo de elaboración, o de lo contrario se detendrá la glucólisis. Las bacterias y levaduras tienen NADH que requieren reacciones que se regeneran\(\text{NAD}^+\) mientras producen etanol a partir de piruvato en condiciones anaerobias, en lugar de ácido láctico. Por lo tanto, la fermentación del piruvato es necesaria para mantener la glucólisis operativa cuando el oxígeno es limitante. También es por estas razones que la elaboración de cerveza (usando levadura) implica el agotamiento de oxígeno y los músculos bajos en oxígeno producen ácido láctico (animales).
El piruvato es un precursor de la alanina que se puede sintetizar fácilmente mediante la transferencia de un nitrógeno de un donante de amina, como el ácido glutámico. El piruvato también se puede convertir en oxaloacetato por carboxilación en el proceso de gluconeogénesis (ver Figura 6.3.8).
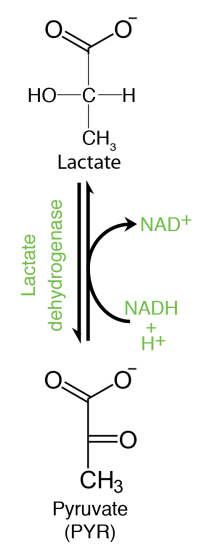
Las enzimas involucradas en el metabolismo del piruvato incluyen piruvato deshidrogenasa (produce acetil-CoA), lactato deshidrogenasa (produce lactato), transaminasas (produce alanina), una
piruvato carboxilasa (produce oxaloacetato).


