7.1: Almacenamiento y Descomposición de Carbohidratos
- Page ID
- 53716
Los carbohidratos son importantes fuentes de energía celular. Proporcionan energía rápidamente a través de la glucólisis y el paso de intermedios a vías, como el ciclo del ácido cítrico, el metabolismo de los aminoácidos (indirectamente) y la vía del fosfato de pentosa. Es importante, por lo tanto, entender cómo se hacen estas moléculas importantes.
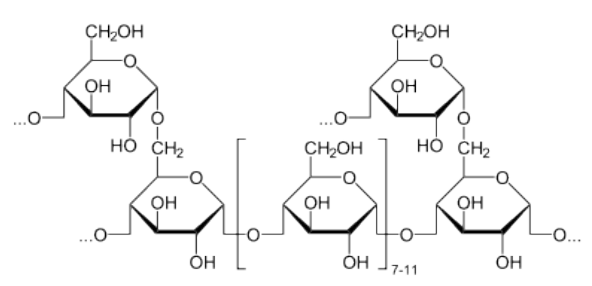
Las plantas son notables en el almacenamiento de glucosa para obtener energía en forma de amilosa y amilopectina (ver y para la integridad estructural en forma de celulosa. Estas estructuras difieren en que la celulosa contiene glucosas unidas únicamente por enlaces beta-1,4, mientras que la amilosa solo tiene enlaces alfa-1,4 y la amilopectina tiene enlaces alfa 1,4 y alfa 1,6. Los animales almacenan glucosa primaria en hígado y músculo en forma de un compuesto relacionado con la amilopectina conocido como glucógeno. Las diferencias estructurales entre glucógeno y amilopectina se deben únicamente a la frecuencia de las ramas alfa 1,6 de las glucosas. En glucógeno ocurren aproximadamente cada 10 residuos en lugar de cada 30-50, como en la amilopectina.
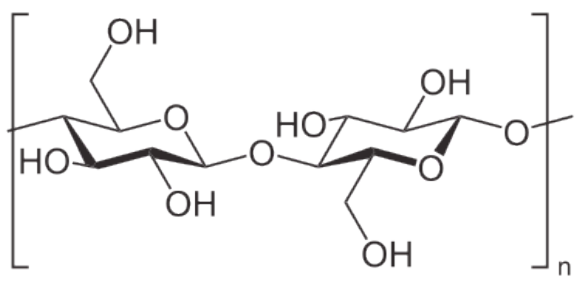
El glucógeno proporciona una fuente adicional de glucosa además de la producida a través de la gluconeogénesis. Debido a que el glucógeno contiene tantas glucosas, actúa como una batería de respaldo para el cuerpo, proporcionando una fuente rápida de glucosa cuando es necesario y proporcionando un lugar para almacenar el exceso de glucosa cuando las concentraciones de glucosa en la sangre suben. La ramificación del glucógeno también es una característica importante de la molécula metabólicamente. Dado que el glucógeno se descompone de los “extremos” de la molécula, más ramas se traducen a más extremos, y más glucosa que se puede liberar a la vez. La descomposición del glucógeno implica
- liberación de glucosa-1-fosfato (G1P),
- reorganizar el glucógeno restante (según sea necesario) para permitir la descomposición continua, y
- conversión de G1P a G6P para su posterior metabolismo. La G6P puede ser 1) descompuesta en glucólisis, 2) convertida en glucosa por gluconeogénesis y 3) oxidada en la vía de pentosa fosfato.
Al igual que en la gluconeogénesis, la célula tiene un mecanismo separado para la síntesis de glucógeno que es distinto de la descomposición del glucógeno. Como se señaló anteriormente, esto permite que la célula controle por separado las reacciones, evitando ciclos inútiles, y permitiendo que se produzca de manera eficiente un proceso (síntesis de glucógeno) que no ocurriría si se tratara simplemente de la reversión de la descomposición del glucógeno.
La síntesis de glucógeno comienza con G1P, que se convierte en un intermedio 'activado', UDP-glucosa. Este intermedio activado es lo que 'agrega' la glucosa a la cadena de glucógeno en crecimiento en una reacción catalizada por la enzima conocida como glucógeno sintasa. Una vez que la glucosa se agrega al glucógeno, la molécula de glucógeno puede necesitar tener ramas insertadas en ella por la enzima conocida como enzima de ramificación.
Desglose del glicógeno
La glucógeno fosforilasa (a veces llamada simplemente fosforilasa) cataliza la descomposición del glucógeno en Glucosa-1-Fosfato (G1P). La reacción, (ver arriba a la derecha) que produce G1P a partir del glucógeno es una fosforólisis, no una reacción de hidrólisis. La distinción es que las reacciones de hidrólisis utilizan agua para escindir moléculas más grandes en otras más pequeñas, pero las reacciones de fosforólisis usan fosfato para el mismo propósito. Tenga en cuenta que el fosfato es solo eso - NO proviene del ATP. Dado que el ATP no se usa para poner fosfato en G1P, la reacción ahorra energía celular.
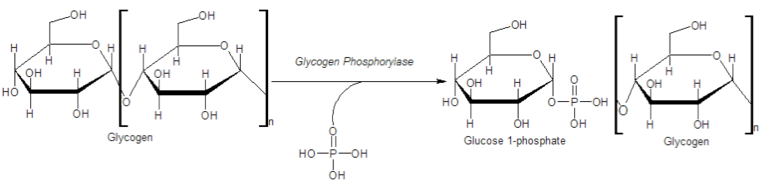
La glucógeno fosforilasa solo actuará sobre los extremos no reductores de una cadena de glucógeno que estén al menos a 5 glucosas de un punto de ramificación. Por lo tanto, se necesita una segunda enzima, la Enzima Desramificadora de Glucógeno (GDE), para convertir las ramas alfa (1-6) en ramas alfa (1-4). El GDE actúa sobre las ramas de glucógeno que han alcanzado su límite de hidrólisis con glucógeno fosforilasa. GDE actúa para transferir un trisacárido de una rama 1,6 a una rama 1,4 adyacente, dejando una sola glucosa en la rama 1,6. Tenga en cuenta que la enzima también cataliza la hidrólisis de la glucosa restante en el punto de ramificación 1,6. Así, los productos de descomposición del glucógeno son G1P y glucosa (en su mayoría G1P, sin embargo). La glucosa puede, por supuesto, convertirse en Glucosa-6-Fosfato (G6P) como primer paso en la glucólisis por hexoquinasa o bien hexocinasa. G1P se puede convertir en G6P por acción de una enzima llamada fosfoglucomutasa. Esta reacción es fácilmente reversible, permitiendo que G6P y G1P se interconviertan a medida que aumenta la concentración de uno u otro. Esto es importante, porque se necesita fosfoglucomutasa para formar G1P para la biosíntesis de glucógeno.
Regulación del Metabolismo Glucógeno
La regulación del metabolismo del glucógeno es compleja, ocurriendo tanto alostéricamente como a través de eventos controlados por hormona-receptor que resultan en fosforilación o desfosforilación de proteínas. Con el fin de evitar un ciclo inútil de síntesis y descomposición de glucógeno simultáneamente, las células han desarrollado un conjunto elaborado de controles que aseguran que solo una vía está principalmente activa a la vez.
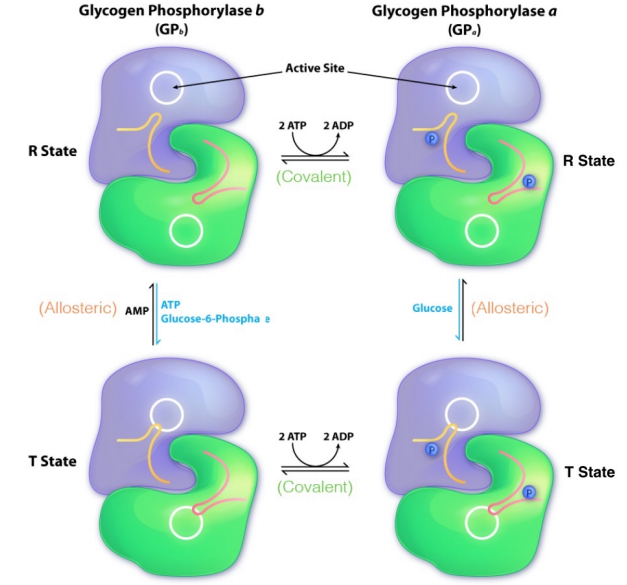
La regulación del metabolismo del glucógeno es manejada por las enzimas glucógeno fosforilasa y glucógeno sintasa. La glucógeno fosforilasa está regulada tanto por factores alostéricos (ATP, G6P, AMP y glucosa) como por modificación covalente (fosforilación/desfosforilación). Su regulación es consistente con las necesidades energéticas de la célula. Los sustratos de alta energía (ATP, G6P, glucosa) inhiben alostéricamente la GP, mientras que los sustratos de baja energía (AMP, otros) la activan alostéricamente.
Regulación alostérica GPa/GPB
La glucógeno fosforilasa existe en dos formas covalentes diferentes: una forma con fosfato (llamada GPa aquí) y una forma que carece de fosfato (GpB aquí). Gpb se convierte en GpA por fosforilación por una enzima conocida como fosforilasa quinasa. GPa y GPB pueden existir cada uno en un estado 'R' y un estado 'T'. Tanto para GPa como para GpB, el estado R es la forma más activa de la enzima. El efector alostérico negativo de GPa (glucosa) generalmente no es abundante en las células, por lo que GPa no entra en el estado T. No hay un efector alostérico positivo de GPa, por lo que cuando la glucosa está ausente, el GPa se voltea automáticamente al estado R (más activo).
GPB puede convertir del estado T al estado GpB R vinculando AMP. A menos que una célula sea baja en energía, la concentración de AMP es baja. Por lo tanto, GPB no se convierte al estado R muy a menudo. Por otro lado, el ATP y/o G6P suelen estar presentes a una concentración lo suficientemente alta en las células como para que GpB sea fácilmente volteado al estado T.
Conversión Covalente GPA/GPB
Debido a que las cantidades relativas de GPa y GpB gobiernan en gran medida el proceso general de descomposición del glucógeno, es importante comprender los controles de las enzimas que interconvierten GpA y GpB. Esto se logra mediante la enzima Fosforilasa Cinasa, que transfiere fosfatos de 2 ATPs a GPB para formar GPa. La fosforilasa quinasa tiene dos formas covalentes: fosforilada (activa) y desfosforilada (inactiva). Se fosforila por la enzima Proteína Kinasa A (PKA). Otra forma de activar la enzima es con calcio. La fosforilasa quinasa es desfosforilada por la misma enzima, la fosfoproteína fosfatasa, que elimina el fosfato de GPa.
La PKA es activada por AMPc, que es, a su vez, producida por la adenilato ciclasa después de la activación por una proteína G. Las proteínas G se activan en última instancia mediante la unión de ligandos a receptores 7-TM específicos, también conocidos como receptores acoplados a proteínas G. Estos se discuten con mayor detalle en el Capítulo 8. Los ligandos comunes para estos receptores incluyen epinefrina (se une al receptor beta-adrenérgico) y glucagón (se une al receptor de glucagón). La epinefrina ejerce sus mayores efectos sobre el músculo y el glucagón funciona preferentemente en el hígado.
Desactivación de la descomposición del glucógeno
Apagar las señales es tan importante, si no más, que encenderlas. Los pasos en la vía reguladora de la descomposición del glucógeno se pueden revertir en varios niveles. Primero, el ligando puede abandonar el receptor. Segundo, las proteínas G tienen una actividad GTPasa inherente que sirve para apagarlas con el tiempo. En tercer lugar, las células tienen fosfodiesterasa (inhibida por la cafeína) para descomponer el AMPc. Cuarto, una enzima conocida como fosfoproteína fosfatasa puede eliminar los fosfatos de la fosforilasa quinasa (inactivándola) Y de GPa, convirtiéndola en la GpB mucho menos activa.
Síntesis de glucógeno
La vía anabólica que contrasta con la descomposición del glucógeno es la de la síntesis de glucó Así como las células regulan recíprocamente la glucólisis y la gluconeogénesis para prevenir un ciclo inútil, también las células utilizan esquemas recíprocos para regular la descomposición y síntesis del glucógeno. Consideremos primero los pasos en la síntesis de glucógeno.1) La síntesis de glucógeno a partir de glucosa implica fosforilación para formar G6P, e isomerización para formar G1P (usando fosfoglucomutasa común a la descomposición del glucógeno). G1P se hace reaccionar con UTP para formar UDP-glucosa en una reacción catalizada por UDP-glucosa pirofosforilasa. La glucógeno sintasa cataliza la síntesis de glucógeno uniendo el carbono #1 de la glucosa derivada de UDPG en el carbono #4 del extremo no reductor de una cadena de glucógeno para formar los enlaces alfa (1,4) glucógeno familiares. Otro producto de la reacción es UDP.
También vale la pena señalar de pasada que la glucógeno sintasa solo agregará unidades de glucosa de UDPG a una cadena de glucógeno preexistente que tenga al menos cuatro residuos de glucosa. La unión de las primeras unidades de glucosa para formar el “cebador” mínimo necesario para el reconocimiento de glucógeno sintasa es catalizada por una proteína llamada glucogenina, que se une a la primera glucosa y cataliza el enlace de las primeras ocho glucosas por enlaces alfa (1,4). 3) Las ramas alfa (1,6) características del glucógeno son los productos de una enzima conocida como Enzima de Ramificación. Ramificación Enzima rompe las cadenas alfa (1,4) y lleva la cadena rota al carbono #6 y forma un enlace alfa (1,6).
Regulación de la Síntesis de Glucógeno
La regulación de la biosíntesis de glucógeno es recíproca a la de la descomposición del glucógeno. También tiene un sistema de modificación covalente en cascada similar al sistema de descomposición de glucógeno descrito anteriormente. De hecho, parte del sistema es idéntica a la descomposición del glucógeno. La señalización de epinefrina o glucagón puede estimular la adenilato ciclasa para producir AMPc, que activa PKA, que activa la fosforilasa quinasa.
En la descomposición del glucógeno, la fosforilasa quinasa fosforila GpB a la forma más activa, GPa. En la síntesis de glucógeno, la proteína quinasa A fosforila la forma activa de la glucógeno sintasa (GsA), y la convierte en la forma b generalmente inactiva (llamada GsB). Tenga en cuenta las convenciones para glucógeno sintasa y glucógeno fosforilasa. Para ambas enzimas, las formas más activas se denominan formas 'a' (GpA y GsA) y las formas menos activas se denominan formas 'b' (Gpb y GsB). La diferencia principal, sin embargo, es que GPa tiene un fosfato, pero GsA no y Gpb no tiene fosfato, pero GsB sí. Así, la fosforilación y la desfosforilación tienen efectos opuestos sobre las enzimas del metabolismo del glucógeno. Este es el sello distintivo de la regulación recíproca. Es de destacar que la forma menos activa de glucógeno sintasa, GsB, puede ser activada por G6P. Recordemos que G6P tuvo el efecto exactamente opuesto en GPB.
La glucógeno sintasa, la glucógeno fosforilasa (y la fosforilasa quinasa) pueden ser desfosforiladas por varias enzimas llamadas fosfatasas. Una de ellas se llama Proteína Fosfatasa y se activa cuando la insulina se une a un receptor en la membrana celular. Hace que el PP se active, estimulando la desfosforilación, activando así la síntesis de glucógeno e inhibiendo la descomposición del glucógeno. Nuevamente, existe una regulación recíproca de la síntesis y degradación del glucógeno.

Mantener los niveles de glucosa en sangre
Después de una comida, los niveles de glucosa en sangre suben y se libera insulina. Simultáneamente estimula la captación de glucosa por las células y su incorporación al glucógeno por activación de glucógeno sintasa e inactivación de glucógeno fosforilasa. Cuando los niveles de glucosa en sangre bajan, el GPa se activa (estimulando la descomposición del glucógeno para elevar la glucosa en la sangre) y se forma GsB (deteniendo la síntesis de


