10.4: Recuerda
- Page ID
- 53026
Retiradas - Medicamentos, Productos Biológicos, Dispositivos y Alimentos
Un retiro es la retirada voluntaria de un producto por parte de un fabricante o a petición de la FDA. Los retiros son casi siempre voluntarios. La FDA solo puede emitir un retiro cuando tienen el poder obligatorio para hacerlo. La FDA no puede recordar un medicamento, o biológico, pero puede recordar un dispositivo médico, algunos cosméticos y alimentos. Cuando sí tienen autoridad de revocación, solo pueden hacerlo cuando existe un riesgo sustancial para la salud pública y la seguridad. https://www.fda.gov/consumers/consumer-updates/fda-101-product-recalls
Recursos del retiro del mercado: https://www.fda.gov/safety/recalls-m...call-resources
Alimentos
La FDA puede emitir un retiro de alimentos. En 2011, la FDA obtuvo mayor autoridad para regular y responder a la contaminación de productos alimenticios a través de la nueva Ley de Modernización de la Seguridad Alimentaria (FSMA). La FSMA permite a la FDA suspender los servicios y producción de distribuidores de alimentos si se sospecha contaminación. No es necesario que haya prueba alguna de la fuente de la contaminación. Para mayor información sobre la FSMA: http://www.foodsafety.gov/news/fsma.html
Dispositivo médico
La FDA puede emitir un retiro del dispositivo. En 2012, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA) anunció que buscaba implementar la autoridad de retiro de dispositivos médicos bajo el § 518 (e) de la Ley FD&C y el Capítulo 21, Sección 810 del CFR. La autoridad de retirada de dispositivos médicos permitiría a la FDA ordenar a los fabricantes que cesen la distribución de un dispositivo y notificar a los profesionales de la salud si la FDA encuentra una probabilidad razonable de que el dispositivo cause reacciones adversas graves para la salud o la muerte (fda.gov). Un retiro no significa necesariamente que el producto deba ser devuelto, a veces solo necesita ser ajustado, o instrucciones de seguridad de aclaración proporcionadas. 21 CFR 7 proporciona orientación para llevar a cabo un retiro voluntario eficiente.
Ejemplos de los tipos de acciones que pueden considerarse retiradas de dispositivos:
- Inspeccionar el dispositivo en busca de problemas
- Reparar el dispositivo
- Ajustar los ajustes en el dispositivo
- Volver a etiquetar el dispositivo
- Destruir dispositivo
- Notificar a los pacientes de un problema
- Seguimiento de pacientes por problemas de salud
Un retiro de un dispositivo médico es una corrección o extracción. A Corrección aborda un problema con un dispositivo médico en el lugar donde se vende. A Removal aborda el problema quitando el dispositivo de donde se vende. En la mayoría de los casos, una empresa retira voluntariamente un dispositivo por su cuenta. Cuando la compañía haya violado una ley de la FDA, la compañía debe retirar el dispositivo (corrección o extracción) y notificar a la FDA. Legalmente, la FDA puede exigir a una compañía que retire un dispositivo si una organización se niega a hacerlo bajo 21 CFR 810, Autoridad de retirada de dispositivos médicos. 21 CFR 810 describe los procedimientos que sigue la FDA para ejercer su autoridad de retiro de dispositivos médicos bajo el artículo 518 (e) de la Ley FD&C.
Un retiro no incluye un retiro de mercado o una recuperación de acciones. Un retiro de mercado es la eliminación o corrección por parte de una empresa de un producto distribuido que implica una infracción menor que no estaría sujeta a acciones legales por parte de la FDA o que no implica ninguna violación, por ejemplo, prácticas normales de rotación de existencias, ajustes rutinarios de equipos y reparaciones (fda.gov). Al final, casi todas las retiradas son realizadas voluntariamente por el fabricante. https://www.fda.gov/safety/recalls-market-withdrawals-safety-alerts
¡Explora!
Una base de datos integral y con capacidad de búsqueda de retiros de dispositivos médicos: www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfres/res.cfm
Para obtener más información sobre el retiro del mercado de dispositivos, visite la página web de retirada de dispositivos de la FDA https://www.fda.gov/medicaldevices/safety/listofrecalls/ y también, vea el Video de la FDA aquí http://fda.yorkcast.com/webcast/Play/1b95461f64be40ecbe3415195cb394911d
Recuerdos de dispositivos siguiendo el mismo procedimiento general de retiro, como se discutió anteriormente para medicamentos. Esto incluye la clasificación de retiro (I, II o III) desarrollando una estrategia de retiro y proporcionando a la FDA informes de estado de retiro.
Alerta de seguridad de dispositivos médicos: emitida en situaciones en las que un dispositivo médico pueda presentar un riesgo irrazonable de daño sustancial. En algunos casos, estas situaciones también se consideran retiros (fda.gov)
La retirada del mercado ocurre cuando un producto tiene una infracción menor que no estaría sujeta a acciones legales de la FDA. La firma retira el producto del mercado o corrige la infracción. Por ejemplo, un producto retirado del mercado por manipulación, sin evidencia de problemas de fabricación o distribución sería una retirada del mercado. (fda.gov)
Seguridad y disponibilidad de medicamentos
La FDA ofrece muchos sitios web que abordan específicamente la seguridad de los medicamentos y la disponibilidad para comunicarse con los clientes. Aquí hay algunos que quizás desee explorar. https://www.fda.gov/drugs/drug-safety-and-availability
- Comunicaciones de Seguridad de Medicamentos: https://www.fda.gov/drugs/drug-safety-and-availability/drug-safety-communications
- Seguridad de Medicamentos Post-Mercado: https://www.fda.gov/drugs/drug-safety-and-availability/postmarket-drug-safety-information-patients-and-providers
- Novedades — Drogas Humanas: https://www.fda.gov/drugs/news-events-human-drugs
- Reporte de Eventos Adversos: https://www.fda.gov/drugs/surveillance/questions-and-answers-fdas-adverse-event-reporting-system-faers
Retiro de medicamentos
Un retiro de medicamentos es una acción voluntaria tomada por una empresa. www.fda.gov/drogas/drug recall s/fdas-roledrugs recalls. No todos los retiros se anuncian en FDA.gov o en los medios de comunicación. La notificación pública generalmente se emite cuando se recuerda un producto que ha sido ampliamente distribuido o que representa un riesgo grave para la salud. Sin embargo, si una empresa no emite una notificación pública de un retiro, la FDA puede hacerlo si la agencia determina que es necesario proteger a los pacientes. La FDA evalúa la efectividad de un retiro evaluando los esfuerzos de una compañía para notificar adecuadamente a los clientes y eliminar el producto defectuoso del mercado. Si se determina que un retiro del mercado es ineficaz, la FDA solicitará a la compañía que tome medidas adicionales.
Informes de ejecución: https://www.fda.gov/safety/recalls-market-withdrawals-safety-alerts/enforcement-reports
Retiradas de clase I, II y III
- Recuerdo Clase I: “Una probabilidad razonable de que el uso o la exposición a un producto violador cause graves consecuencias adversas para la salud o la muerte”. (fda.gov)
- Recordación Clase II: “el uso o la exposición a un producto violador puede causar consecuencias adversas para la salud temporales o médicamente reversibles o cuando la probabilidad de consecuencias adversas graves para la salud sea remota”. (fda.gov)
- Recordación Clase III: “El uso o la exposición a un producto violador no es probable que cause consecuencias adversas para la salud”. (fda.gov)
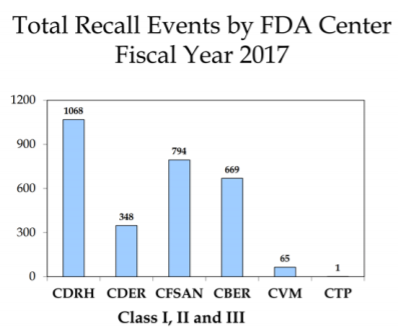
¡Pon a prueba tus conocimientos!
Lea el artículo y vea el video “FDA 101: retiradas de productos: desde la primera alerta hasta las comprobaciones de efectividad” y lea las preguntas frecuentes de la FDA:
- ¿Cómo aprende primero la FDA sobre un problema con un producto?
- ¿Cómo alerta la FDA al producto sobre un retiro del producto?
- Discuta un ejemplo de un retiro, y exponga qué clase de recuerdo es y por qué.
¡Explora!
Los Podcast de Seguridad de Medicamentos de la FDA son producidos por el CDER de la FDA y proporcionan información emergente de seguridad sobre medicamentos junto con la publicación de Avisos de Salud Pública y otros problemas de seguridad de los medicamentos. (fda.gov).


