2.4: Tinción de especímenes microscópicos
- Page ID
- 54810
Objetivos de aprendizaje
- Diferenciar entre manchas simples y diferenciales
- Describir las características únicas de las manchas de uso común
- Explicar los procedimientos y nombrar aplicaciones clínicas para la tinción de Gram, endospore, ácido-resistente, cápsula negativa y flagelos
En su estado natural, la mayoría de las células y microorganismos que observamos bajo el microscopio carecen de color y contraste. Esto dificulta, si no imposible, detectar estructuras celulares importantes y sus características distintivas sin tratar artificialmente a los especímenes. Ya hemos aludido a ciertas técnicas que involucran tintes y tintes fluorescentes, y en esta sección discutiremos técnicas específicas para la preparación de muestras con mayor detalle. De hecho, se han desarrollado numerosos métodos para identificar microbios específicos, estructuras celulares, secuencias de ADN o indicadores de infección en muestras de tejido, bajo el microscopio. Aquí, nos centraremos en las técnicas más relevantes desde el punto de vista clínico.
Preparación de especímenes para microscopía óptica
En entornos clínicos, los microscopios de luz son los microscopios más utilizados. Existen dos tipos básicos de preparación que se utilizan para ver especímenes con un microscopio óptico: monturas húmedas y especímenes fijos.
El tipo de preparación más simple es el montaje húmedo, en el que el espécimen se coloca sobre el portaobjetos en una gota de líquido. Algunos especímenes, como una gota de orina, ya están en forma líquida y pueden depositarse sobre el portaobjetos usando un gotero. Las muestras sólidas, como un raspado de la piel, se pueden colocar en el portaobjetos antes de agregar una gota de líquido para preparar la montura húmeda. En ocasiones el líquido utilizado es simplemente agua, pero a menudo se agregan manchas para mejorar el contraste. Una vez que se ha agregado el líquido al portaobjetos, se coloca un cubreobjetos encima y el espécimen está listo para su examen bajo el microscopio.
El segundo método de preparación de especímenes para microscopía óptica es la fijación. “La “" fijación "” de una muestra se refiere al proceso de unir celdas a un portaobjetos.” La fijación a menudo se logra ya sea calentando (fijación por calor) o tratando químicamente el espécimen. Además de unir el espécimen al portaobjetos, la fijación también mata los microorganismos en el espécimen, deteniendo su movimiento y metabolismo al tiempo que preserva la integridad de sus componentes celulares para su observación.
Para fijar con calor una muestra, una capa delgada de la muestra se extiende sobre el portaobjetos (llamada frotis), y luego el portaobjetos se calienta brevemente sobre una fuente de calor (Figura\(\PageIndex{1}\)). Los fijadores químicos a menudo son preferibles al calor para especímenes de tejido. Los agentes químicos como ácido acético, etanol, metanol, formaldehído (formalina) y glutaraldehído pueden desnaturalizar proteínas, detener reacciones bioquímicas y estabilizar estructuras celulares en muestras de tejido (Figura\(\PageIndex{1}\)).

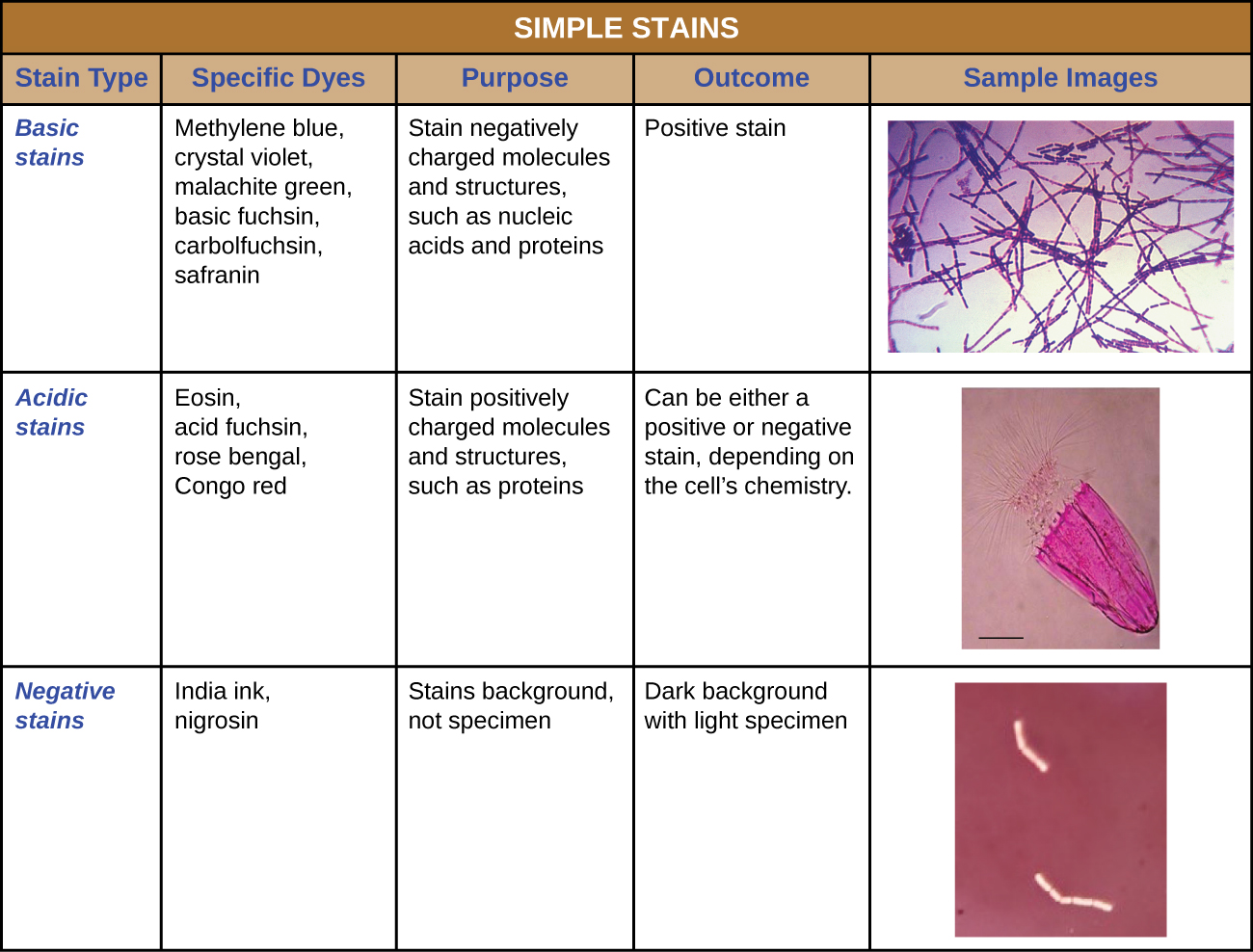
Además de la fijación, la tinción casi siempre se aplica para colorear ciertas características de un espécimen antes de examinarlo bajo un microscopio óptico. Las manchas, o tintes, contienen sales compuestas por un ión positivo y un ion negativo. Dependiendo del tipo de colorante, el ion positivo o el negativo puede ser el cromóforo (el ion coloreado); el otro ion no coloreado se llama contraión. Si el cromóforo es el ion cargado positivamente, la tinción se clasifica como colorante básico; si el ion negativo es el cromóforo, la tinción se considera un tinte ácido.
Los tintes se seleccionan para la tinción en base a las propiedades químicas del colorante y la muestra que se observa, las cuales determinan cómo interactuará el tinte con la muestra. En la mayoría de los casos, es preferible utilizar una tinción positiva, un tinte que será absorbido por las células u organismos que se estén observando, agregando color a los objetos de interés para que destaquen sobre el fondo. Sin embargo, existen escenarios en los que resulta ventajoso utilizar una tinción negativa, la cual es absorbida por el fondo pero no por las células u organismos en el espécimen. La tinción negativa produce un contorno o silueta de los organismos sobre un fondo colorido (Figura\(\PageIndex{2}\)).

Debido a que las células suelen tener paredes celulares cargadas negativamente, los cromóforos positivos en los tintes básicos tienden a pegarse a las paredes celulares, haciéndolas manchas positivas. Por lo tanto, los tintes básicos comúnmente utilizados como fucsina básica, violeta cristal, verde malaquita, azul de metileno y safranina típicamente sirven como manchas positivas. Por otro lado, los cromóforos cargados negativamente en los tintes ácidos son repelidos por las paredes celulares cargadas negativamente, haciéndolas manchas negativas. Los tintes ácidos comúnmente utilizados incluyen fucsina ácida, eosina y rosa de bengala. La figura\(\PageIndex{10}\) proporciona más detalle.
Algunas técnicas de tinción implican la aplicación de un solo tinte a la muestra; otras requieren más de un tinte. En la tinción simple, se utiliza un solo tinte para enfatizar estructuras particulares en el espécimen. Una simple tinción generalmente hará que todos los organismos en una muestra parezcan ser del mismo color, incluso si la muestra contiene más de un tipo de organismo. En contraste, la tinción diferencial distingue a los organismos en función de sus interacciones con múltiples manchas. En otras palabras, dos organismos en una muestra teñida diferencialmente pueden parecer de diferentes colores. Las técnicas de tinción diferencial comúnmente utilizadas en entornos clínicos incluyen tinción de Gram, tinción ácido-resistente, tinción de endoesporas, tinción de flagelos y tinción de cápsulas. La Figura\(\PageIndex{11}\) proporciona más detalles sobre estas técnicas de tinción diferencial.
Ejercicio\(\PageIndex{1}\)
- Explique por qué es importante fijar un espécimen antes de verlo bajo un microscopio óptico.
- ¿Qué tipos de especímenes deben fijarse químicamente en lugar de fijarse por calor?
- ¿Por qué un tinte ácido podría reaccionar de manera diferente con un espécimen dado que un tinte básico?
- Explicar la diferencia entre una mancha positiva y una mancha negativa.
- Explicar la diferencia entre tinción simple y diferencial.
Tinción de Gram
El procedimiento de tinción de Gram es un procedimiento de tinción diferencial que implica múltiples etapas. Fue desarrollado por el microbiólogo danés Hans Christian Gram en 1884 como un método eficaz para distinguir entre bacterias con diferentes tipos de paredes celulares, e incluso hoy en día sigue siendo una de las técnicas de tinción más utilizadas. Los pasos del procedimiento de tinción de Gram se enumeran a continuación y se ilustran en la Figura\(\PageIndex{3}\).
- Primero, se aplica violeta cristal, una tinción primaria, a un frotis fijado por calor, dando a todas las células un color púrpura.
- A continuación, se agrega yodo de Gram, un mordiente. Un mordiente es una sustancia utilizada para fijar o estabilizar manchas o tintes; en este caso, el yodo de Gram actúa como un agente de captura que se compleja con el violeta cristal, haciendo que el complejo de violeta cristal—yodo se agrupe y permanezca contenido en gruesas capas de peptidoglicano en las paredes celulares.
- A continuación, se agrega un agente decolorante, generalmente etanol o una solución de acetona/etanol. Las células que tienen capas gruesas de peptidoglicano en sus paredes celulares se ven mucho menos afectadas por el agente decolorante; generalmente retienen el tinte violeta cristalino y permanecen moradas. Sin embargo, el agente decolorante lava más fácilmente el colorante de las células con capas de peptidoglicano más delgadas, haciéndolas nuevamente incoloras.
- Finalmente, se agrega una contratinción secundaria, generalmente safranina. Esto tiñe las células decoloradas de rosa y es menos perceptible en las células que aún contienen el tinte violeta cristal.
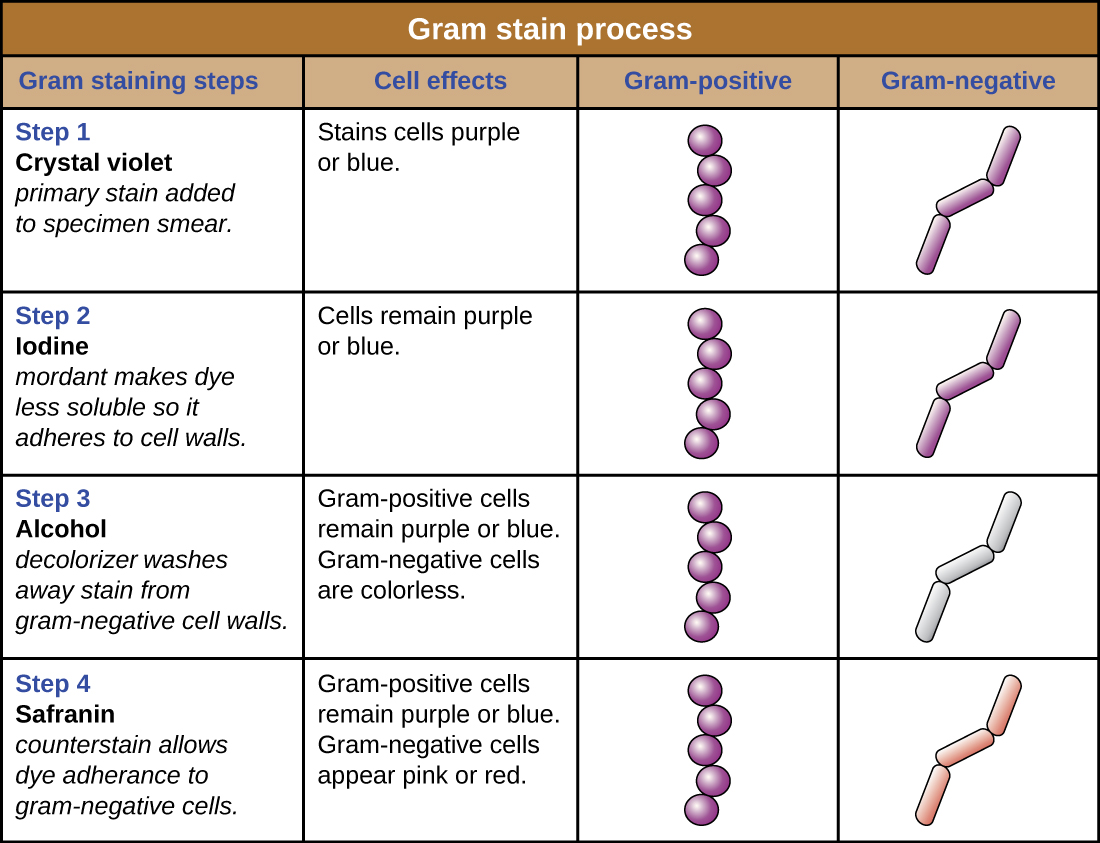
Las células teñidas de púrpura, cristal-violeta se denominan células grampositivas, mientras que las células rojas teñidas con safranina son gramnegativas (Figura\(\PageIndex{4}\)). Sin embargo, existen varias consideraciones importantes en la interpretación de los resultados de una tinción de Gram. Primero, las células bacterianas más viejas pueden tener daños en sus paredes celulares, lo que hace que aparezcan gramnegativas incluso si la especie es grampositiva. Por lo tanto, lo mejor es usar cultivos bacterianos frescos para la tinción de Gram. En segundo lugar, errores como dejar en el decolorante demasiado tiempo pueden afectar los resultados. En algunos casos, la mayoría de las células aparecerán grampositivas mientras que algunas aparecen gramnegativas (como en la Figura\(\PageIndex{4}\)). Esto sugiere daño a las células individuales o que el decolorante se dejó encendido durante demasiado tiempo; las células aún deben clasificarse como grampositivas si todas son de la misma especie en lugar de un cultivo mixto.
Además de sus diferentes interacciones con colorantes y agentes decolorantes, las diferencias químicas entre células grampositivas y gramnegativas tienen otras implicaciones con relevancia clínica. Por ejemplo, la tinción de Gram puede ayudar a los médicos a clasificar los patógenos bacterianos en una muestra en categorías asociadas con propiedades específicas. Las bacterias gramnegativas tienden a ser más resistentes a ciertos antibióticos que las bacterias grampositivas. Discutiremos esta y otras aplicaciones de la tinción de Gram con más detalle en capítulos posteriores.
Ejercicio\(\PageIndex{2}\)
- Explicar el papel del yodo de Gram en el procedimiento de tinción de Gram.
- Explicar el papel del alcohol en el procedimiento de tinción de Gram.
- ¿De qué color son las células grampositivas y gramnegativas, respectivamente, después del procedimiento de tinción de Gram?
Enfoque Clínico: Parte 3
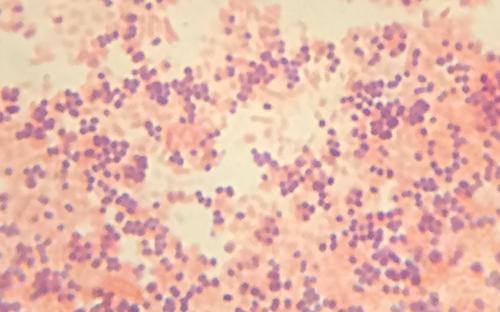
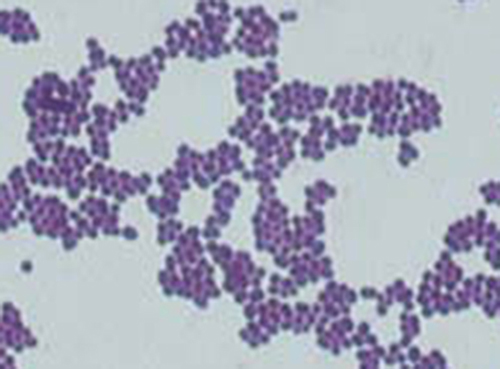
Ver el espécimen de Cindy bajo el microscopio de campo oscuro ha proporcionado al técnico algunas pistas importantes sobre la identidad del microbio causante de su infección. Sin embargo, se necesita más información para hacer un diagnóstico concluyente. El técnico decide hacer una mancha Gram del espécimen. Esta técnica es comúnmente utilizada como un paso temprano en la identificación de bacterias patógenas. Después de completar el procedimiento de tinción de Gram, el técnico ve el portaobjetos bajo el microscopio de campo claro y ve racimos de células esféricas de color púrpura, en forma de uva (Figura\(\PageIndex{5}\)).
Ejercicio\(\PageIndex{3}\)
- ¿Estas bacterias son grampositivas o gramnegativas?
- ¿Qué revela esto sobre sus paredes celulares?
Manchas ácido-resistentes
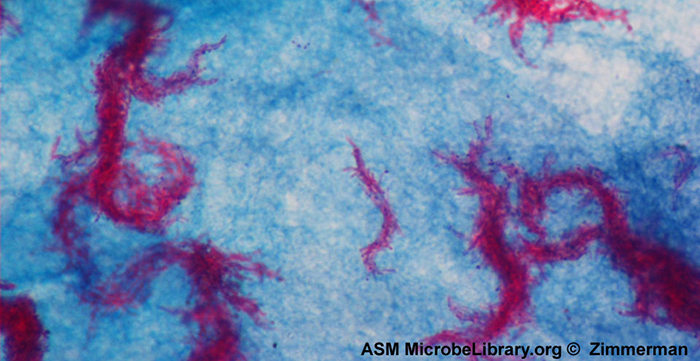
La tinción ácido-rápida es otra técnica de tinción diferencial de uso común que puede ser una herramienta de diagnóstico importante. Una tinción ácido-resistente es capaz de diferenciar dos tipos de células grampositivas: las que tienen ácidos micólicos cerosos en sus paredes celulares, y las que no. Dos métodos diferentes para la tinción ácido-rápida son la técnica de Ziehl-Neelsen y la técnica de Kinyoun. Ambos usan carbolfucsina como mancha primaria. Las células cerosas y ácido-resistentes retienen la carbolfucsina incluso después de aplicar un agente decolorante (una solución ácido-alcohol). Luego se aplica una contratinción secundaria, azul de metileno, que vuelve azules las células no ácido-resistentes.
La diferencia fundamental entre los dos métodos basados en carbolfucsina es si se usa calor durante el proceso de tinción primaria. El método Ziehl-Neelsen utiliza calor para infundir la carbolfucsina en las células ácido-resistentes, mientras que el método Kinyoun no utiliza calor. Ambas técnicas son importantes herramientas de diagnóstico porque una serie de enfermedades específicas son causadas por bacterias ácido-resistentes (AFB). Si los AFB están presentes en una muestra de tejido, su color rojo o rosa se puede ver claramente contra el fondo azul de las células del tejido circundante (Figura\(\PageIndex{6}\)).
Ejercicio\(\PageIndex{4}\)
¿Por qué son útiles las manchas ácido-resistentes?
Mycobacterium tuberculosis, la bacteria causante de la tuberculosis, puede detectarse en especímenes basados en la presencia de bacilos ácido-resistentes. A menudo, se prepara un frotis a partir de una muestra del esputo del paciente y luego se tiñe mediante la técnica de Ziehl-Neelsen (Figura\(\PageIndex{6}\)). Si se confirman las bacterias ácido-resistentes, generalmente se cultivan para hacer una identificación positiva. Las variaciones de este enfoque pueden ser utilizadas como un primer paso para determinar si M. tuberculosis u otras bacterias ácido-resistentes están presentes, aunque muestras de otras partes del cuerpo (como orina) pueden contener otras especies de Mycobacterium.
Un enfoque alternativo para determinar la presencia de M. tuberculosis es la inmunofluorescencia. En esta técnica, los anticuerpos marcados con fluorocromo se unen a M. tuberculosis, si están presentes. Se pueden usar tintes fluorescentes específicos de anticuerpos para ver las micobacterias con un microscopio de fluorescencia.
Tinción de cápsulas
Ciertas bacterias y levaduras tienen una estructura externa protectora llamada cápsula. Dado que la presencia de una cápsula está directamente relacionada con la virulencia de un microbio (su capacidad de causar enfermedad), la capacidad de determinar si las células de una muestra tienen cápsulas es una herramienta de diagnóstico importante. Las cápsulas no absorben la mayoría de los colorantes básicos; por lo tanto, se suele utilizar una técnica de tinción negativa (tinción alrededor de las células) para la tinción de las cápsulas. El tinte tiñe el fondo pero no penetra en las cápsulas, las cuales aparecen como halos alrededor de los bordes de la célula. El espécimen no necesita ser fijado por calor antes de la tinción negativa.
Una técnica común de tinción negativa para identificar levaduras y bacterias encapsuladas es agregar unas gotas de tinta india o nigrosina a un espécimen. También se pueden usar otras manchas capsulares para teñir negativamente las células encapsuladas (Figura\(\PageIndex{7}\)). Alternativamente, se pueden combinar técnicas de tinción positiva y negativa para visualizar las cápsulas: La tinción positiva colorea el cuerpo de la célula, y la tinción negativa colorea el fondo pero no la cápsula, dejando halo alrededor de cada célula.
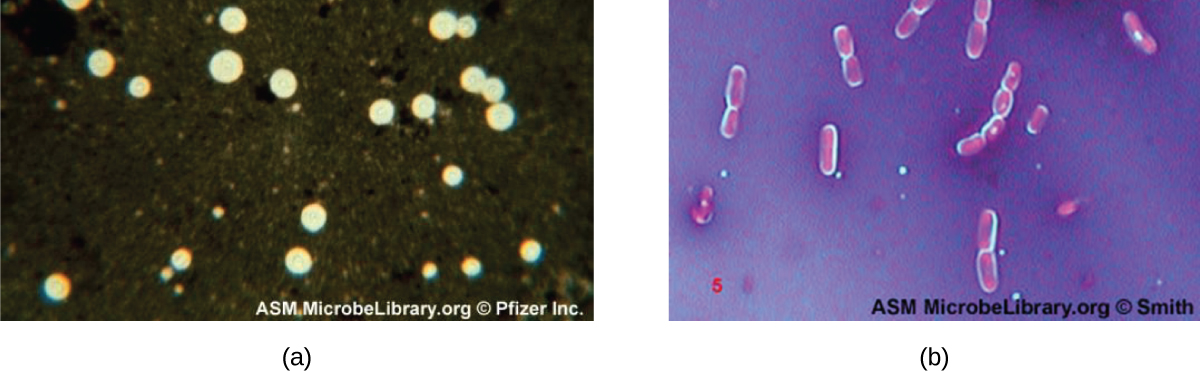
Ejercicio\(\PageIndex{5}\)
¿Cómo nos ayuda la tinción negativa a visualizar las cápsulas?
Tinción de endosporas
Las endosporas son estructuras producidas dentro de ciertas células bacterianas que les permiten sobrevivir a condiciones duras. La tinción de Gram por sí sola no puede usarse para visualizar las endoesporas, que aparecen claras cuando se ven las células teñidas con Gram. La tinción de endosporas utiliza dos tinciones para diferenciar las endosporas del resto de la célula. El método de Schaeffer-Fulton (la técnica de tinción de endosporas más utilizada) utiliza calor para empujar la tinción primaria (verde de malaquita) hacia la endospora. El lavado con agua decolora la célula, pero la endospora retiene la mancha verde. A continuación, la célula se contrateñe de color rosa con safranina. La imagen resultante revela la forma y ubicación de las endosporas, si están presentes. Las endosporas verdes aparecerán ya sea dentro de las células vegetativas rosadas o separadas de las células rosadas en conjunto. Si no hay endosporas presentes, entonces solo serán visibles las células vegetativas rosadas (Figura\(\PageIndex{8}\)).
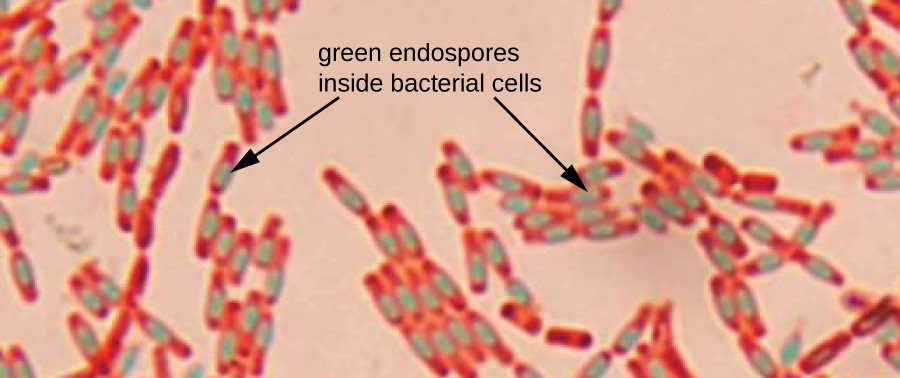
Las técnicas de tinción de endosporas son importantes para identificar Bacillus y Clostridium, dos géneros de bacterias productoras de endosporas que contienen especies clínicamente significativas. Entre otros, B. anthracis (que causa ántrax) ha sido de particular interés debido a la preocupación de que sus esporas puedan ser utilizadas como agente bioterrorista. C. difficile es una especie particularmente importante responsable de la infección típicamente adquirida en el hospital conocida como “C. diff”.
Ejercicio\(\PageIndex{6}\)
¿La tinción de endoesporas es un ejemplo de tinción positiva, negativa o diferencial?
Tinción de flagelos
Los flagelos (singular: flagelo) son estructuras celulares similares a la cola utilizadas para la locomoción por algunas bacterias, arqueas y eucariotas. Debido a que son tan delgados, los flagelos normalmente no se pueden ver bajo un microscopio óptico sin una técnica especializada de tinción de flagelos. La tinción de flagelos espesa los flagelos aplicando primero mordiente (generalmente ácido tánico, pero a veces alumbre potásico), que recubre los flagelos; luego el espécimen se tiñe con pararosanilina (más comúnmente) o fucsina básica (Figura\(\PageIndex{9}\)).
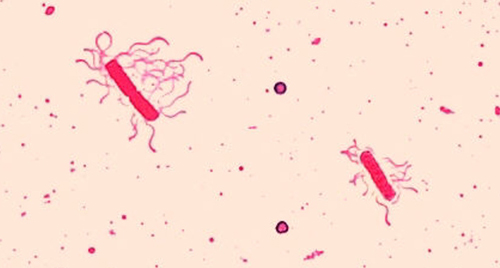
Aunque la tinción de flagelos es poco común en entornos clínicos, la técnica es comúnmente utilizada por los microbiólogos, ya que la ubicación y el número de flagelos pueden ser útiles para clasificar e identificar bacterias en una muestra. Al usar esta técnica, es importante manejar el espécimen con mucho cuidado; los flagelos son estructuras delicadas que pueden dañarse o arrancarse fácilmente, comprometiendo los intentos de localizar y contar con precisión el número de flagelos.
Preparación de especímenes para microscopía electrónica
Las muestras a analizar usando un TEM deben tener secciones muy delgadas. Pero las celdas son demasiado blandas para cortarlas finas, incluso con cuchillos de diamante. Para cortar las células sin daño, las células deben embeberse en resina plástica y luego deshidratarse a través de una serie de remojos en soluciones de etanol (50%, 60%, 70%, etc.). El etanol reemplaza el agua en las celdas, y la resina se disuelve en etanol y entra en la celda, donde se solidifica. A continuación, se cortan secciones delgadas utilizando un dispositivo especializado llamado ultramicrotomo (Figura\(\PageIndex{12}\)). Finalmente, las muestras se fijan a redes finas de alambre de cobre o fibra de carbono y se tiñen, no con tintes coloreados, sino con sustancias como acetato de uranilo o tetraóxido de osmio, que contienen átomos de metales pesados densos en electrones.

Cuando las muestras se preparan para su visualización usando un SEM, también deben deshidratarse usando una serie de etanol. Sin embargo, deben estar incluso más secos de lo necesario para un TEM. El secado en punto crítico con dióxido de carbono líquido inerte bajo presión se utiliza para desplazar el agua de la muestra. Después del secado, los especímenes se recubren por pulverización catódica con metal al eliminar átomos de un blanco de paladio, con partículas energéticas. El recubrimiento por pulverización catódica evita que las muestras se carguen por el haz de electrones del SEM.
Ejercicio\(\PageIndex{7}\)
- ¿Por qué es importante deshidratar las células antes de examinarlas bajo un microscopio electrónico?
- Nombra el dispositivo que se utiliza para crear secciones delgadas de especímenes para microscopía electrónica.
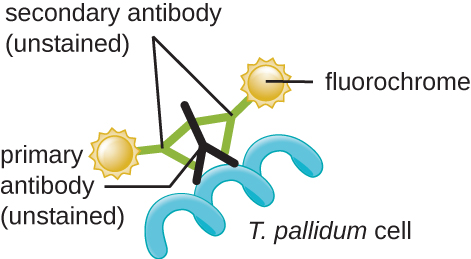
El agente causante de la sífilis es Treponema pallidum, una célula flexible en espiral (espiroqueta) que puede ser muy delgada (<0.15 μm) y coincidir con el índice de refracción del medio, dificultando la visualización mediante microscopía de campo claro. Adicionalmente, esta especie no ha sido cultivada con éxito en el laboratorio en un medio artificial; por lo tanto, el diagnóstico depende de una identificación exitosa mediante técnicas microscópicas y serología (análisis de fluidos corporales, a menudo buscando anticuerpos contra un patógeno). Dado que la fijación y la tinción matarían las células, la microscopía de campo oscuro se usa típicamente para observar especímenes vivos y ver sus movimientos. Sin embargo, también se pueden utilizar otros enfoques. Por ejemplo, las células pueden espesarse con partículas de plata (en secciones de tejido) y observarse usando un microscopio óptico. También es posible utilizar microscopía de fluorescencia o electrónica para visualizar Treponema (Figura\(\PageIndex{13}\)).

En entornos clínicos, la inmunofluorescencia indirecta se utiliza a menudo para identificar Treponema. Un anticuerpo primario no teñido se une directamente a la superficie del patógeno, y los anticuerpos secundarios “etiquetados” con una tinción fluorescente se unen al anticuerpo primario. Múltiples anticuerpos secundarios pueden unirse a cada anticuerpo primario, amplificando la cantidad de tinción unida a cada célula de Treponema, haciéndolos más fáciles de detectar (Figura\(\PageIndex{14}\)).
Preparación y Tinción para Otros Microscopios
Las muestras para microscopía de fluorescencia y confocal se preparan de manera similar a las muestras para microscopía óptica, excepto que los colorantes son fluorocromos. Las manchas a menudo se diluyen en líquido antes de aplicar al portaobjetos. Algunos colorantes se adhieren a un anticuerpo para teñir proteínas específicas en tipos específicos de células (inmunofluorescencia); otros pueden unirse a moléculas de ADN en un proceso llamado hibridación fluorescente in situ (FISH), provocando que las células se tiñan en función de si tienen una secuencia de ADN específica.
La preparación de muestras para microscopía de dos fotones es similar a la microscopía de fluorescencia, excepto por el uso de tintes infrarrojos. Las muestras para STM deben estar en una superficie muy limpia y atómicamente lisa. A menudo son mica recubierta con Au (111). El vapor de tolueno es un fijador común.
Ejercicio\(\PageIndex{8}\)
¿Cuál es la principal diferencia entre preparar una muestra para microscopía de fluorescencia versus microscopía óptica?
Enlace al aprendizaje
Los estudios de caso en microscopía de la Universidad de Cornell ofrecen una serie de problemas clínicos basados en eventos de la vida real. Cada estudio de caso te guía a través de un problema clínico utilizando técnicas adecuadas en microscopía en cada paso.
Foco Clínico: Resolución
De los resultados de la tinción Gram, el técnico ahora sabe que la infección de Cindy es causada por bacterias esféricas grampositivas que forman racimos similares a la uva, lo cual es típico de las bacterias estafilocócicas. Después de algunas pruebas adicionales, el técnico determina que estas bacterias son la especie médicamente importante conocida como Staphylococcus aureus, un culpable común en las infecciones de heridas. Debido a que algunas cepas de S. aureus son resistentes a muchos antibióticos, las infecciones de la piel pueden propagarse a otras áreas del cuerpo y llegar a ser graves, a veces incluso resultando en amputaciones o la muerte si no se usan los antibióticos correctos.
Después de probar varios antibióticos, el laboratorio es capaz de identificar uno que sea efectivo contra esta cepa particular de S. aureus. El médico de Cindy le receta rápidamente el medicamento y enfatiza la importancia de tomar todo el curso de antibióticos, incluso si la infección parece desaparecer antes de la última dosis programada. Esto reduce el riesgo de que alguna bacteria especialmente resistente pueda sobrevivir, causando una segunda infección o propagándose a otra persona.
A medida que el uso de antibióticos ha proliferado en la medicina, así como en la agricultura, los microbios han evolucionado para volverse más resistentes. Cepas de bacterias como S. aureus resistente a meticilina (MRSA), que ha desarrollado un alto nivel de resistencia a muchos antibióticos, son un problema cada vez más preocupante, tanto es así que se está investigando para desarrollar antibióticos nuevos y más diversificados.
La microscopía de fluorescencia puede ser útil para probar la efectividad de nuevos antibióticos contra cepas resistentes como MRSA. En una prueba de un nuevo antibiótico derivado de una bacteria marina, MC21-A (bromofeno), los investigadores utilizaron el colorante fluorescente SYTOX Green para teñir muestras de MRSA. SYTOX Green se utiliza a menudo para distinguir las células muertas de las células vivas, con microscopía de fluorescencia. Las células vivas no absorberán el colorante, pero las células muertas por un antibiótico absorberán el colorante, ya que el antibiótico ha dañado la membrana celular bacteriana. En este caso particular, las bacterias MRSA que habían estado expuestas a MC21-A sí aparecieron, de hecho, verdes bajo el microscopio de fluorescencia, lo que llevó a los investigadores a concluir que es un antibiótico eficaz contra el MRSA.
Por supuesto, algunos argumentan que el desarrollo de nuevos antibióticos solo conducirá a microbios aún más resistentes a los antibióticos, las llamadas superbacterias que podrían engendrar epidemias antes de que se puedan desarrollar nuevos tratamientos. Por esta razón, muchos profesionales de la salud están empezando a ejercer más discreción en la prescripción de antibióticos. Mientras que alguna vez se prescribieron antibióticos de manera rutinaria para enfermedades comunes sin un diagnóstico definitivo, los médicos y hospitales son mucho más propensos a realizar pruebas adicionales para determinar si un antibiótico es necesario y apropiado antes de recetarlo.
Un paciente enfermo podría objetar razonablemente este enfoque tacaño para recetar antibióticos. Para el paciente que simplemente quiere sentirse mejor lo más rápido posible, los beneficios potenciales de tomar un antibiótico pueden parecer mayores que cualquier riesgo inmediato para la salud que pueda ocurrir si el antibiótico es ineficaz. Pero, ¿en qué momento los riesgos del uso generalizado de antibióticos reemplazan el deseo de usarlos en casos individuales?
Conceptos clave y resumen
- Las muestras deben estar debidamente preparadas para microscopía. Esto puede implicar manchar, fijar y/o cortar secciones delgadas.
- Se puede usar una variedad de técnicas de tinción con microscopía óptica, incluyendo tinción de Gram, tinción ácido-resistente, tinción de cápsulas, tinción de endoesporas y tinción de flagelos.
- Las muestras para TEM requieren secciones muy delgadas, mientras que las muestras para SEM requieren recubrimiento por pulverización catódica.
- La preparación para microscopía de fluorescencia es similar a la de la microscopía óptica, excepto que se utilizan fluorocromos.


