13.2: Uso de métodos físicos para controlar microorganismos
- Page ID
- 54390
Objetivos de aprendizaje
- Comprender y comparar diversos métodos físicos para controlar el crecimiento microbiano, incluyendo calefacción, refrigeración, congelación, tratamiento a alta presión, desecación, liofilización, irradiación y filtración
Durante miles de años, los humanos han utilizado diversos métodos físicos de control microbiano para la conservación de alimentos. Los métodos comunes de control incluyen la aplicación de altas temperaturas, radiación, filtración y desecación (secado), entre otros. Muchos de estos métodos destruyen células de forma no específica al romper membranas, cambiar la permeabilidad de la membrana o dañar proteínas y ácidos nucleicos por desnaturalización, degradación o modificación química. En esta sección se describen diversos métodos físicos utilizados para el control microbiano.
Calor
El calentamiento es una de las formas más comunes y antiguas de control microbiano. Se utiliza en técnicas simples como cocinar y enlatar. El calor puede matar microbios alterando sus membranas y desnaturalizando las proteínas. El punto de muerte térmica (TDP) de un microorganismo es la temperatura más baja a la que todos los microbios se matan en una exposición de 10 minutos. Diferentes microorganismos responderán de manera diferente a las altas temperaturas, siendo algunos (por ejemplo, formadores de endosporas como C. botulinum) más tolerantes al calor. Un parámetro similar, el tiempo de muerte térmica (TDT), es el tiempo necesario para matar todos los microorganismos en una muestra a una temperatura dada. Estos parámetros se utilizan a menudo para describir procedimientos de esterilización que utilizan calor alto, como el autoclave. La ebullición es uno de los métodos más antiguos de control humedad-calor de los microbios, y por lo general es bastante efectivo para matar las células vegetativas y algunos virus. Sin embargo, la ebullición es menos efectiva para matar endosporas; algunas endosporas pueden sobrevivir hasta 20 horas de ebullición. Adicionalmente, la ebullición puede ser menos efectiva a altitudes más altas, donde el punto de ebullición del agua es menor y el tiempo de ebullición necesario para matar microbios es por lo tanto más largo. Por estas razones, la ebullición no se considera una técnica de esterilización útil en el laboratorio o entorno clínico.
Se pueden usar muchos protocolos de calentamiento diferentes para la esterilización en el laboratorio o la clínica, y estos protocolos se pueden desglosar en dos categorías principales: esterilización por calor seco y esterilización por calor húmedo. La técnica aséptica en el laboratorio suele implicar algunos protocolos de esterilización por calor seco utilizando la aplicación directa de calor alto, como la esterilización de bucles de inoculación (Figura\(\PageIndex{1}\)). La incineración a temperaturas muy altas destruye todos los microorganismos. El calor seco también se puede aplicar por períodos de tiempo relativamente largos (al menos 2 horas) a temperaturas de hasta 170 °C mediante el uso de un esterilizador de calor seco, como un horno. Sin embargo, la esterilización por calor húmedo es típicamente el protocolo más efectivo porque penetra en las células mejor que el calor seco.

Autoclaves
Los autoclaves se basan en la esterilización por calor húmedo. Se utilizan para elevar temperaturas por encima del punto de ebullición del agua para esterilizar artículos como equipo quirúrgico de células vegetativas, virus, y especialmente endosporas, que se sabe que sobreviven a las temperaturas de ebullición, sin dañar los artículos. Charles Chamberland (1851—1908) diseñó el moderno autoclave en 1879 mientras trabajaba en el laboratorio de Louis Pasteur. El autoclave aún se considera el método de esterilización más efectivo (Figura\(\PageIndex{2}\)). Fuera de los entornos clínicos y de laboratorio, los grandes autoclaves industriales llamados retortas permiten la esterilización con calor húmedo a gran escala.
En general, el aire en la cámara de un autoclave se retira y se reemplaza con cantidades crecientes de vapor atrapado dentro de la cámara cerrada, resultando en un aumento de la presión interior y temperaturas por encima del punto de ebullición del agua. Los dos tipos principales de autoclaves difieren en la forma en que se elimina el aire de la cámara. En los autoclaves de desplazamiento por gravedad, el vapor se introduce en la cámara desde la parte superior o los lados. El aire, que es más pesado que el vapor, se hunde hasta el fondo de la cámara, donde es forzado a salir a través de un respiradero. El desplazamiento completo del aire es difícil, especialmente en cargas más grandes, por lo que es posible que se requieran ciclos más largos para tales cargas. En los esterilizadores de prevacío, el aire se elimina completamente usando un vacío de alta velocidad antes de introducir vapor en la cámara. Debido a que el aire se elimina más completamente, el vapor puede penetrar más fácilmente en los artículos envueltos. Muchos autoclaves son capaces tanto de ciclos de gravedad como de prevacío, utilizando los primeros para la descontaminación de residuos y esterilización de medios y cristalería sin envolver, y los segundos para la esterilización de instrumentos envasados.
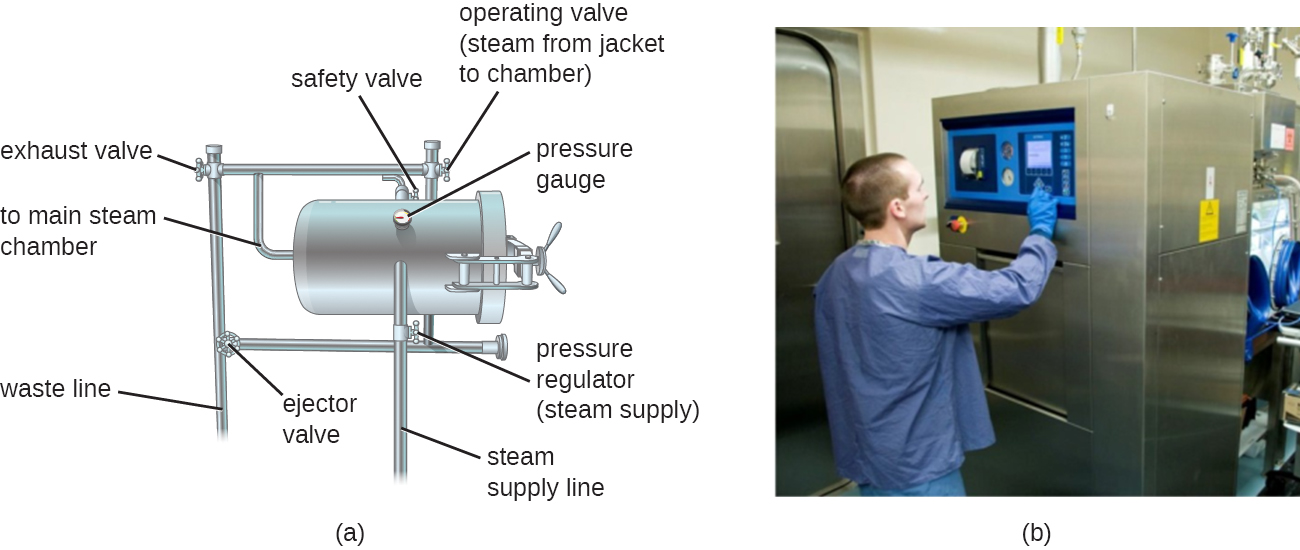
Las temperaturas de operación estándar para los autoclaves son 121 °C o, en algunos casos, 132 °C, típicamente a una presión de 15 a 20 libras por pulgada cuadrada (psi). La duración de la exposición depende del volumen y la naturaleza del material que se esteriliza, pero normalmente es de 20 minutos o más, con volúmenes mayores que requieren tiempos de exposición más largos para garantizar una transferencia de calor suficiente a los materiales que se esterilizan. El vapor debe contactar directamente con los líquidos o materiales secos que se esterilizan, por lo que los recipientes se dejan sin apretar y los instrumentos se envuelven sueltos en papel o papel de aluminio. La clave para el autoclave es que la temperatura debe ser lo suficientemente alta como para matar las endosporas y lograr una esterilización completa.
Debido a que la esterilización es tan importante para los protocolos médicos y de laboratorio seguros, el control de calidad es esencial. Los autoclaves pueden estar equipados con registradores para documentar las presiones y temperaturas alcanzadas durante cada carrera. Adicionalmente, los indicadores internos de diversos tipos deben ser esterilizados en autoclave junto con los materiales a esterilizar para asegurar que se ha alcanzado la temperatura de esterilización adecuada (Figura\(\PageIndex{3}\)). Un tipo común de indicador es el uso de cinta autoadhesiva termosensible, la cual tiene franjas blancas que se vuelven negras cuando se alcanza la temperatura apropiada durante un funcionamiento exitoso del autoclave. Este tipo de indicador es relativamente económico y se puede utilizar durante cada carrera. Sin embargo, la cinta autoclave no proporciona indicación de la duración de la exposición, por lo que no puede usarse como indicador de esterilidad. Otro tipo de indicador, una prueba de esporas de indicador biológico, utiliza una tira de papel o una suspensión líquida de las endosporas de Geobacillus stearothermophilus para determinar si las endoesporas son destruidas por el proceso. Las endosporas de la bacteria termófila obligada G. stearothermophilus son el estándar de oro utilizado para este propósito debido a su extrema resistencia al calor. Los indicadores biológicos de esporas también se pueden usar para probar la efectividad de otros protocolos de esterilización, incluyendo óxido de etileno, calor seco, formaldehído, radiación gamma y esterilización por plasma de peróxido de hidrógeno usando cualquiera de G. stearothermophilus, Bacillus atrophaeus, B. subtilis o esporas de B. pumilus. En el caso de validar la función de autoclave, las endosporas se incuban después del autoclave para asegurar que no queden endoesporas viables. El crecimiento bacteriano posterior a la germinación de endoesporas se puede monitorear mediante pruebas de esporas con indicadores biológicos que detectan metabolitos ácidos o fluorescencia producida por enzimas derivadas de G. stearothermophilus viable. Un tercer tipo de indicador de autoclave es el tubo Diack, una ampolla de vidrio que contiene un pellet sensible a la temperatura que se funde a la temperatura de esterilización adecuada. Periódicamente se utilizan tiras de esporas o tubos Diack para asegurar que el autoclave funcione correctamente.

Pasteurización
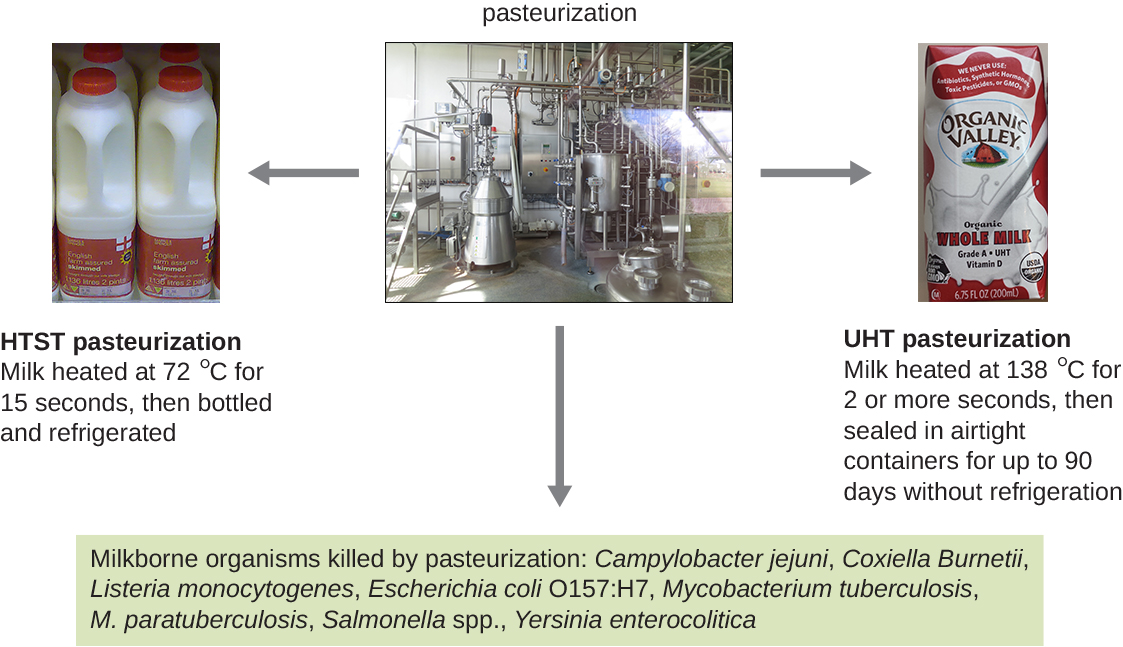
Aunque la esterilización completa es ideal para muchas aplicaciones médicas, no siempre es práctica para otras aplicaciones y también puede alterar la calidad del producto. La ebullición y el autoclave no son formas ideales de controlar el crecimiento microbiano en muchos alimentos porque estos métodos pueden arruinar la consistencia y otras cualidades organolépticas (sensoriales) de los alimentos. La pasteurización es una forma de control microbiano para los alimentos que utiliza calor pero no los vuelve estériles. La pasteurización tradicional mata patógenos y reduce el número de microbios causantes de deterioro mientras mantiene la calidad de los alimentos. El proceso de pasteurización fue desarrollado por primera vez por Louis Pasteur en la década de 1860 como un método para prevenir el deterioro de la cerveza y el vino. Hoy en día, la pasteurización se usa más comúnmente para matar patógenos sensibles al calor en la leche y otros productos alimenticios (por ejemplo, jugo de manzana y miel) (Figura\(\PageIndex{4}\)). Sin embargo, debido a que los productos alimenticios pasteurizados no son estériles, eventualmente se echarán a perder.
Los métodos utilizados para la pasteurización de la leche equilibran la temperatura y la duración del tratamiento. Un método, la pasteurización a alta temperatura a corto plazo (HTST), expone la leche a una temperatura de 72 °C durante 15 segundos, lo que disminuye el número de bacterias al tiempo que conserva la calidad de la leche. Una alternativa es la pasteurización a temperatura ultra alta (UHT), en la que la leche se expone a una temperatura de 138 °C durante 2 o más segundos. La leche pasteurizada UHT se puede almacenar durante mucho tiempo en recipientes sellados sin ser refrigerada; sin embargo, las temperaturas muy altas alteran las proteínas de la leche, provocando ligeros cambios en el sabor y el olor. Aún así, este método de pasteurización es ventajoso en regiones donde el acceso a la refrigeración es limitado.
Ejercicio\(\PageIndex{1}\)
- En un autoclave, ¿cómo se logran temperaturas por encima de la ebullición?
- ¿Cómo se compararía el inicio del deterioro entre la leche pasteurizada HTST y la pasteurizada UHT?
- ¿Por qué no se utiliza la ebullición como método de esterilización en un entorno clínico?
Refrigeración y Congelación
Así como las altas temperaturas son efectivas para controlar el crecimiento microbiano, exponer microbios a bajas temperaturas también puede ser un método fácil y efectivo de control microbiano, con la excepción de los psicrófilos, que prefieren temperaturas frías (ver Temperatura y Crecimiento Microbiano). Los refrigeradores utilizados en las cocinas domésticas o en el laboratorio mantienen temperaturas entre 0 °C y 7 °C, este rango de temperatura inhibe el metabolismo microbiano, ralentizando significativamente el crecimiento de microorganismos y ayudando a conservar productos refrigerados como alimentos o insumos médicos. Ciertos tipos de cultivos de laboratorio pueden conservarse mediante refrigeración para su uso posterior.
La congelación por debajo de −2 °C puede detener el crecimiento microbiano e incluso matar organismos susceptibles. Según el Departamento de Agricultura de Estados Unidos (USDA), las únicas formas seguras de que los alimentos congelados pueden descongelarse son en el refrigerador, sumergidos en agua fría cambiada cada 30 minutos, o en el microondas, manteniendo los alimentos a temperaturas no propicias para el crecimiento bacteriano. 1 Además, el crecimiento bacteriano detenido puede reiniciarse en los alimentos descongelados, por lo que los alimentos descongelados deben tratarse como perecederos frescos.
Los cultivos bacterianos y las muestras médicas que requieren almacenamiento o transporte a largo plazo a menudo se congelan a temperaturas ultrabajas de −70 °C o menos. Estas temperaturas ultrabaja se pueden lograr almacenando especímenes en hielo seco en un congelador ultrabajo o en tanques especiales de nitrógeno líquido, que mantienen temperaturas inferiores a −196 °C (Figura\(\PageIndex{5}\)).

Ejercicio\(\PageIndex{2}\)
¿Colocar alimentos en un refrigerador mata las bacterias en los alimentos?
Presión
La exposición a alta presión mata muchos microbios. En la industria alimentaria, el procesamiento a alta presión (también llamado pascalización) se usa para matar bacterias, levaduras, mohos, parásitos y virus en los alimentos mientras se mantiene la calidad de los alimentos y se extiende la vida útil. La aplicación de alta presión entre 100 y 800 MPa (la presión atmosférica del nivel del mar es de aproximadamente 0.1 MPa) es suficiente para matar las células vegetativas por desnaturalización de proteínas, pero las endosporas pueden sobrevivir a estas presiones. 2 3
En entornos clínicos, la oxigenoterapia hiperbárica a veces se usa para tratar infecciones. En esta forma de terapia, un paciente respira oxígeno puro a una presión superior a la presión atmosférica normal, típicamente entre 1 y 3 atmósferas (atm). Esto se logra colocando al paciente en una cámara hiperbárica o suministrando el oxígeno presurizado a través de un tubo de respiración. La oxigenoterapia hiperbárica ayuda a aumentar la saturación de oxígeno en los tejidos que se vuelven hipóxicos debido a la infección y la inflamación. Este aumento de la concentración de oxígeno potencia la respuesta inmune del organismo al aumentar las actividades de los neutrófilos y macrófagos, glóbulos blancos que combaten las infecciones. El aumento de los niveles de oxígeno también contribuye a la formación de radicales libres tóxicos que inhiben el crecimiento de bacterias sensibles al oxígeno o anaerobias como Clostridium perfringens, una causa común de gangrena gaseosa. En las infecciones por C. perfringens, la oxigenoterapia hiperbárica también puede reducir la secreción de una toxina bacteriana que causa destrucción tisular. La oxigenoterapia hiperbárica también parece mejorar la efectividad de los tratamientos con antibióticos. Desafortunadamente, algunos riesgos raros incluyen la toxicidad del oxígeno y los efectos en tejidos delicados, como los ojos, el oído medio y los pulmones, que pueden dañarse por el aumento de la presión del aire.
El procesamiento a alta presión no se usa comúnmente para la desinfección o esterilización de fomites. Si bien la aplicación de presión y vapor en un autoclave es efectiva para matar endosporas, es la alta temperatura alcanzada, y no la presión directamente, lo que resulta en la muerte de endosporas.
Un lunes de la primavera de 2015, una mujer de Ohio comenzó a experimentar visión borrosa, doble, dificultad para tragar y párpados caídos. Fue trasladada de urgencia al servicio de urgencias de su hospital local. Durante el examen, comenzó a experimentar calambres abdominales, náuseas, parálisis, sequedad de boca, debilidad de los músculos faciales y dificultad para hablar y respirar. Con base en estos síntomas, se activó el centro de mando de incidentes del hospital y se notificó a funcionarios de salud pública de Ohio de un posible caso de botulismo. En tanto, otros pacientes con síntomas similares comenzaron a presentarse en otros hospitales locales. Debido a la sospecha de botulismo, la antitoxina fue enviada durante la noche desde los CDC a estas instalaciones médicas, para ser administrada a los pacientes afectados. El primer paciente murió de insuficiencia respiratoria como consecuencia de parálisis, y aproximadamente la mitad de las víctimas restantes requirieron hospitalización adicional tras la administración de antitoxina, con al menos dos requirieron respiradores para respirar.
Funcionarios de salud pública investigaron cada uno de los casos y determinaron que todos los pacientes habían asistido a la misma comida de la iglesia el día anterior. Además, rastrearon el origen del brote hasta una ensalada de papa hecha con papas caseras enlatadas. Lo más probable es que las papas se enlataran usando agua hirviendo, un método que permite que las endosporas de Clostridium botulinum sobrevivan. C. botulinum produce toxina botulínica, una neurotoxina que a menudo es mortal una vez ingerida. Según los CDC, el caso de Ohio fue el mayor brote de botulismo en Estados Unidos en casi 40 años. 4
Matar endoesporas de C. botulinum requiere una temperatura mínima de 116 °C (240 °F), muy por encima del punto de ebullición del agua. Esta temperatura solo se puede alcanzar en una envasadora a presión, la cual se recomienda para el enlatado casero de alimentos bajos en ácido como carne, pescado, aves y verduras (Figura\(\PageIndex{6}\)). Adicionalmente, los CDC recomiendan hervir los alimentos enlatados caseros durante unos 10 minutos antes de consumirlos. Dado que la toxina botulínica es lábil al calor (lo que significa que se desnaturaliza por calor), 10 minutos de ebullición harán que no sea funcional cualquier toxina botulínica que pueda contener el alimento.

Para obtener más información sobre las técnicas adecuadas de enlatado casero, visite el sitio web de los CDC.
Desecación
El secado, también conocido como desecación o deshidratación, es un método que se ha utilizado durante milenios para conservar alimentos como pasas, ciruelas pasas y cecina. Funciona porque todas las células, incluyendo los microbios, requieren agua para su metabolismo y supervivencia. Aunque el secado controla el crecimiento microbiano, podría no matar a todos los microbios o sus endosporas, que pueden comenzar a crecer cuando las condiciones son más favorables y se restablece el contenido de agua.
En algunos casos, los alimentos se secan al sol, confiando en la evaporación para lograr la desecación. La liofilización, o liofilización, es otro método de desecación en el que un artículo se congela rápidamente (“snap-frozen”) y se coloca al vacío para que el agua se pierda por sublimación. La liofilización combina tanto la exposición a temperaturas frías como la desecación, lo que la hace bastante efectiva para controlar el crecimiento microbiano. Además, la liofilización causa menos daño a un artículo que la desecación convencional y conserva mejor las cualidades originales del artículo. Los artículos liofilizados pueden almacenarse a temperatura ambiente si se envasan adecuadamente para evitar la adquisición de humedad. La liofilización se utiliza para la conservación en la industria alimentaria y también se utiliza en el laboratorio para el almacenamiento y transporte a largo plazo de cultivos microbianos.
El contenido de agua de los alimentos y materiales, llamado la actividad del agua, se puede bajar sin secado físico mediante la adición de solutos como sales o azúcares. A concentraciones muy altas de sales o azúcares, la cantidad de agua disponible en las células microbianas se reduce drásticamente debido a que el agua se extraerá de un área de baja concentración de soluto (dentro de la célula) a un área de alta concentración de soluto (fuera de la célula) (Figura\(\PageIndex{7}\)). Muchos microorganismos no sobreviven a estas condiciones de alta presión osmótica. La miel, por ejemplo, es sacarosa al 80%, un ambiente en el que muy pocos microorganismos son capaces de crecer, eliminando así la necesidad de refrigeración. Las carnes saladas y los pescados, como el jamón y el bacalao, respectivamente, fueron alimentos de importancia crítica antes de la edad de la refrigeración. Los frutos se conservaron agregando azúcar, haciendo mermeladas y jaleas. Sin embargo, ciertos microbios, como los mohos y las levaduras, tienden a ser más tolerantes a la desecación y altas presiones osmóticas, y, por lo tanto, aún pueden contaminar este tipo de alimentos.

Ejercicio\(\PageIndex{3}\)
¿Cómo afecta la adición de sal o azúcar a los alimentos su actividad hídrica?
Radiación
La radiación en diversas formas, desde la radiación de alta energía hasta la luz solar, puede usarse para matar microbios o inhibir su crecimiento. La radiación ionizante incluye rayos X, rayos gamma y haces de electrones de alta energía. La radiación ionizante es lo suficientemente fuerte como para pasar a la célula, donde altera las estructuras moleculares y daña los componentes celulares. Por ejemplo, la radiación ionizante introduce roturas bicatenarias en las moléculas de ADN. Esto puede causar directamente mutaciones en el ADN, o pueden introducirse mutaciones cuando la célula intenta reparar el daño del ADN. A medida que estas mutaciones se acumulan, eventualmente conducen a la muerte celular.
Tanto los rayos X como los rayos gamma penetran fácilmente en papel y plástico y, por lo tanto, se pueden usar para esterilizar muchos materiales empaquetados. En el laboratorio, la radiación ionizante se usa comúnmente para esterilizar materiales que no pueden ser esterilizados en autoclave, como las placas Petri de plástico y los bucles de inoculación de plástico desechables. Para uso clínico, la radiación ionizante se utiliza para esterilizar guantes, tubos intravenosos y otros artículos de látex y plástico utilizados para la atención del paciente. La radiación ionizante también se utiliza para la esterilización de otros tipos de materiales delicados y sensibles al calor utilizados clínicamente, incluidos tejidos para trasplante, medicamentos farmacéuticos y equipos médicos.
En Europa, la irradiación gamma para la conservación de alimentos es ampliamente utilizada, aunque ha tardado en ponerse al día en Estados Unidos (ver el cuadro Micro Conexiones sobre este tema). Las especias secas envasadas también suelen ser irradiadas con rayos gamma. Debido a su capacidad para penetrar papel, plástico, láminas delgadas de madera y metal, y tejidos, se debe tener mucho cuidado al usar rayos X e irradiación gamma. Estos tipos de irradiación ionizante no pueden penetrar gruesas capas de hierro o plomo, por lo que estos metales se utilizan comúnmente para proteger a los humanos que pueden estar potencialmente expuestos.
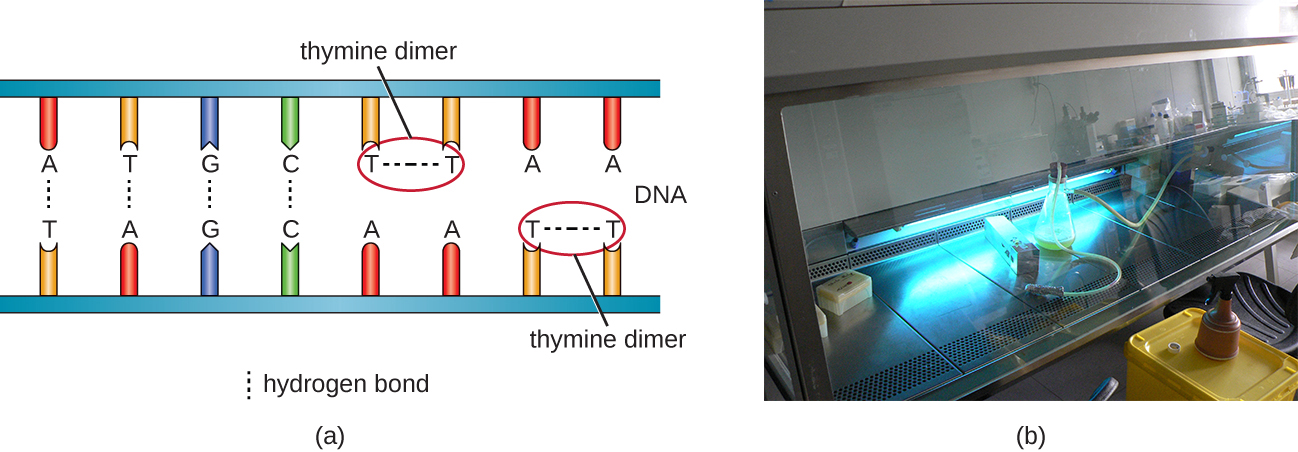
Otro tipo de radiación, la radiación no ionizante, se usa comúnmente para la esterilización y utiliza menos energía que la radiación ionizante. No penetra en las células ni en los embalajes. La luz ultravioleta (UV) es un ejemplo; provoca que se formen dímeros de timina entre timinas adyacentes dentro de una sola cadena de ADN (Figura\(\PageIndex{8}\)). Cuando la ADN polimerasa se encuentra con el dímero de timina, no siempre incorpora los nucleótidos complementarios apropiados (dos adeninas), y esto conduce a la formación de mutaciones que en última instancia pueden matar microorganismos.
La luz UV puede ser utilizada eficazmente tanto por los consumidores como por el personal del laboratorio para controlar el crecimiento microbiano. Las lámparas UV ahora se incorporan comúnmente a los sistemas de purificación de agua para su uso en hogares. Además, las pequeñas luces UV portátiles son comúnmente utilizadas por los campistas para purificar el agua de ambientes naturales antes de beber. Las lámparas germicidas también se utilizan en salas quirúrgicas, gabinetes de seguridad biológica y campanas de transferencia, que normalmente emiten luz UV a una longitud de onda de 260 nm. Debido a que la luz UV no penetra en las superficies y no pasa a través de plásticos o vidrio, las células deben exponerse directamente a la fuente de luz.
La luz solar tiene un espectro muy amplio que incluye luz UV y visible. En algunos casos, la luz solar puede ser efectiva contra ciertas bacterias debido tanto a la formación de dímeros de timina por la luz UV como por la producción de productos reactivos de oxígeno inducidos en bajas cantidades por la exposición a la luz visible.
Ejercicio\(\PageIndex{4}\)
- ¿Cuáles son las dos ventajas de la radiación ionizante como método de esterilización?
- ¿Cómo se compara la efectividad de la radiación ionizante con la de la radiación no ionizante?
Comida Irradiada: ¿Comerías Eso?
De todas las formas de prevenir el deterioro de los alimentos y las enfermedades transmitidas por los alimentos, la irradiación gamma puede ser la más poco apetitosa. Aunque la irradiación gamma es un método probado para eliminar microbios potencialmente dañinos de los alimentos, el público aún tiene que comprar. La mayor parte de sus preocupaciones, sin embargo, provienen de la desinformación y una mala comprensión de los principios básicos de la radiación.
El método más común de irradiación es exponer los alimentos a cobalto-60 o cesio-137 haciéndolos pasar a través de una cámara de radiación sobre una cinta transportadora. El alimento no entra directamente en contacto con el material radiactivo y no se vuelve radiactivo en sí mismo. Por lo tanto, no existe riesgo de exposición a material radiactivo a través del consumo de alimentos irradiados con gamma. Adicionalmente, los alimentos irradiados no se ven alterados significativamente en términos de calidad nutricional, aparte de la pérdida de ciertas vitaminas, que también se ve exacerbada por el almacenamiento prolongado. Las alteraciones en el sabor u olor pueden ocurrir en alimentos irradiados con alto contenido de grasa, como carnes grasas y productos lácteos, pero este efecto puede minimizarse mediante el uso de dosis más bajas de radiación a temperaturas más frías.
En Estados Unidos, los CDC, la Agencia de Protección Ambiental (EPA) y la Administración de Alimentos y Medicamentos (FDA) han considerado que la irradiación es segura y efectiva para diversos tipos de carnes, aves de corral, mariscos, frutas y verduras frescas, huevos con cáscaras y especias y condimentos. La irradiación gamma de alimentos también ha sido aprobada para su uso en muchos otros países, incluidos Francia, Países Bajos, Portugal, Israel, Rusia, China, Tailandia, Bélgica, Australia y Sudáfrica. Para ayudar a mejorar la preocupación de los consumidores y ayudar con los esfuerzos educativos, los alimentos irradiados ahora están claramente etiquetados y marcados con el símbolo internacional de irradiación, llamado la “radura” (Figura\(\PageIndex{9}\)). La aceptación del consumidor parece estar en aumento, como lo indican varios estudios recientes.

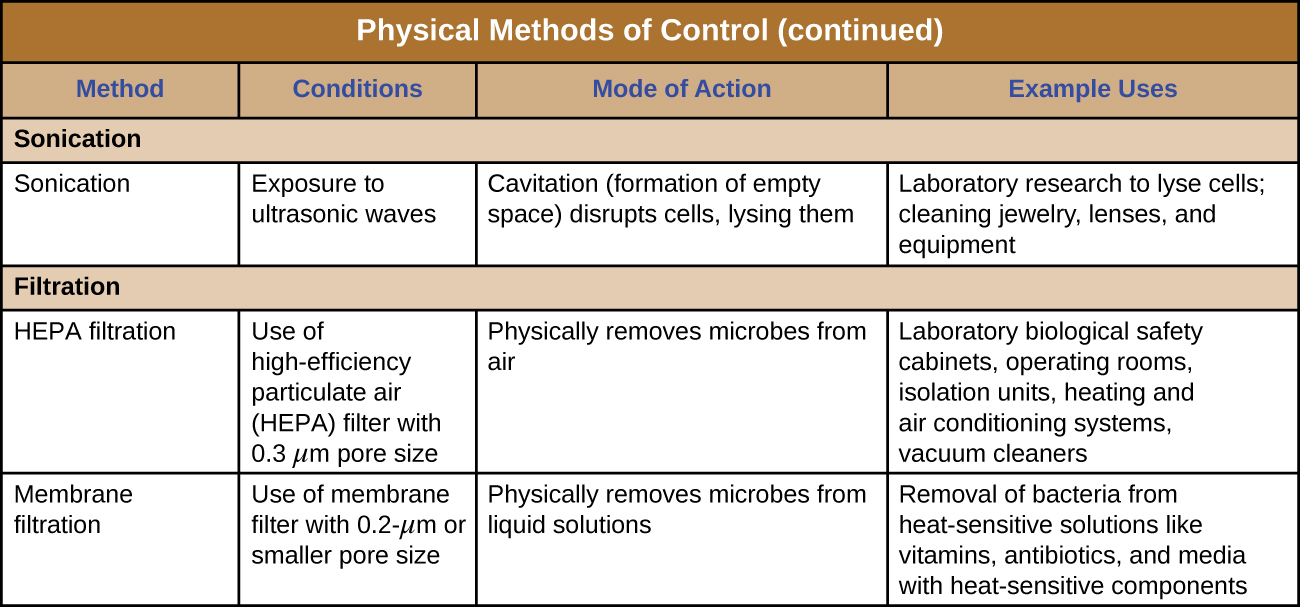
Sonicación
El uso de ondas de ultrasonido de alta frecuencia para alterar las estructuras celulares se llama sonicación. La aplicación de ondas de ultrasonido provoca cambios rápidos en la presión dentro del líquido intracelular; esto conduce a la cavitación, la formación de burbujas dentro de la célula, que pueden alterar las estructuras celulares y eventualmente hacer que la célula se lise o colapse. La sonicación es útil en el laboratorio para lisar eficientemente las células para liberar su contenido para futuras investigaciones; fuera del laboratorio, la sonicación se usa para limpiar instrumentos quirúrgicos, lentes y una variedad de otros objetos como monedas, herramientas e instrumentos musicales.
Filtración
La filtración es un método de separación física de microbios de muestras. El aire se filtra comúnmente a través de filtros de aire particulado de alta eficiencia (HEPA) (Figura\(\PageIndex{10}\)). Los filtros HEPA tienen tamaños de poro efectivos de 0.3 µm, lo suficientemente pequeños como para capturar células bacterianas, endosporas y muchos virus, ya que el aire pasa a través de estos filtros, casi esterilizando el aire en el otro lado del filtro. Los filtros HEPA tienen una variedad de aplicaciones y se utilizan ampliamente en entornos clínicos, en automóviles y aviones, e incluso en el hogar. Por ejemplo, se pueden encontrar en aspiradoras, sistemas de calefacción y aire acondicionado, y purificadores de aire.
Gabinetes de Seguridad Biológica
Los gabinetes de seguridad biológica son un buen ejemplo del uso de filtros HEPA. Los filtros HEPA en gabinetes de seguridad biológica (BSC) se utilizan para eliminar partículas en el aire, ya sea entrando en el gabinete (entrada de aire), saliendo del gabinete (escape de aire) o tratando tanto la entrada como el escape. El uso de un filtro HEPA de entrada de aire evita que los contaminantes ambientales ingresen al BSC, creando un área limpia para el manejo de materiales biológicos. El uso de un filtro HEPA de escape de aire evita que los patógenos de laboratorio contaminen el laboratorio, manteniendo así un área de trabajo segura para el personal del laboratorio.
Hay tres clases de BSC: I, II y III. Cada clase está diseñada para proporcionar un nivel diferente de protección para el personal de laboratorio y el medio ambiente; BSC II y III también están diseñados para proteger los materiales o dispositivos en el gabinete. La tabla\(\PageIndex{1}\) resume el nivel de seguridad proporcionado por cada clase de BSC para cada BSL.
| Riesgo Biológico Evaluado | Clase BSC | Protección del Personal | Protección del Medio Ambiente | Protección del Producto |
|---|---|---|---|---|
| BSL-1, BSL-2, BSL-3 | I | Sí | Sí | No |
| BSL-1, BSL-2, BSL-3 | II | Sí | Sí | Sí |
| BSL-4 | III; II cuando se usa en habitación de traje con traje | Sí | Sí | Sí |
Los BSC Clase I protegen a los trabajadores de laboratorio y al medio ambiente de un riesgo bajo a moderado de exposición a agentes biológicos utilizados en el laboratorio. El aire se introduce en el gabinete y luego se filtra antes de salir a través del sistema de escape del edificio. Los BSC Clase II utilizan sistemas de flujo de aire direccional y barrera parcial para contener agentes infecciosos. Los BSC Clase III están diseñados para trabajar con agentes altamente infecciosos como los utilizados en los laboratorios BSL-4. Son herméticos a los gases, y los materiales que entran o salen del gabinete deben pasar a través de un sistema de doble puerta, permitiendo que el espacio intermedio sea descontaminado entre usos. Todo el aire pasa a través de uno o dos filtros HEPA y un sistema de incineración de aire antes de ser expulsado directamente al exterior (no a través del sistema de escape del edificio). El personal puede manipular materiales dentro del gabinete Clase III mediante el uso de guantes largos de goma sellados al gabinete.
Este video muestra cómo se diseñan los BSC y explica cómo protegen al personal, el medio ambiente y el producto.
Filtración en Hospitales
Los filtros HEPA también se utilizan comúnmente en hospitales y salas quirúrgicas para evitar la contaminación y la propagación de microbios en el aire a través de los sistemas de ventilación. Los sistemas de filtración HEPA pueden diseñarse para edificios enteros o para habitaciones individuales. Por ejemplo, las unidades de quemadura, quirófanos o unidades de aislamiento pueden requerir sistemas especiales de filtración HEPA para eliminar patógenos oportunistas del ambiente porque los pacientes en estas habitaciones son particularmente vulnerables a la infección.
Filtros de Membrana
La filtración también se puede utilizar para eliminar microbios de muestras líquidas mediante filtración por membrana. Los filtros de membrana para líquidos funcionan de manera similar a los filtros HEPA para aire. Por lo general, los filtros de membrana que se utilizan para eliminar bacterias tienen un tamaño de poro efectivo de 0.2 µm, más pequeño que el tamaño promedio de una bacteria (1 µm), pero los filtros con tamaños de poro más pequeños están disponibles para necesidades más específicas. La filtración por membrana es útil para eliminar bacterias de varios tipos de soluciones sensibles al calor utilizadas en el laboratorio, como soluciones antibióticas y soluciones vitamínicas. Grandes volúmenes de medios de cultivo también pueden esterilizarse con filtro en lugar de esterilizarse en autoclave para proteger los componentes sensibles al calor. A menudo, cuando se filtran volúmenes pequeños, se utilizan filtros de jeringa, pero los filtros de vacío se utilizan típicamente para filtrar volúmenes más grandes (Figura\(\PageIndex{11}\)).

Ejercicio\(\PageIndex{5}\)
- ¿La filtración por membrana con un filtro de 0.2 µm probablemente eliminaría los virus de una solución? Explique.
- Nombrar al menos dos usos comunes de la filtración HEPA en entornos clínicos o de laboratorio.
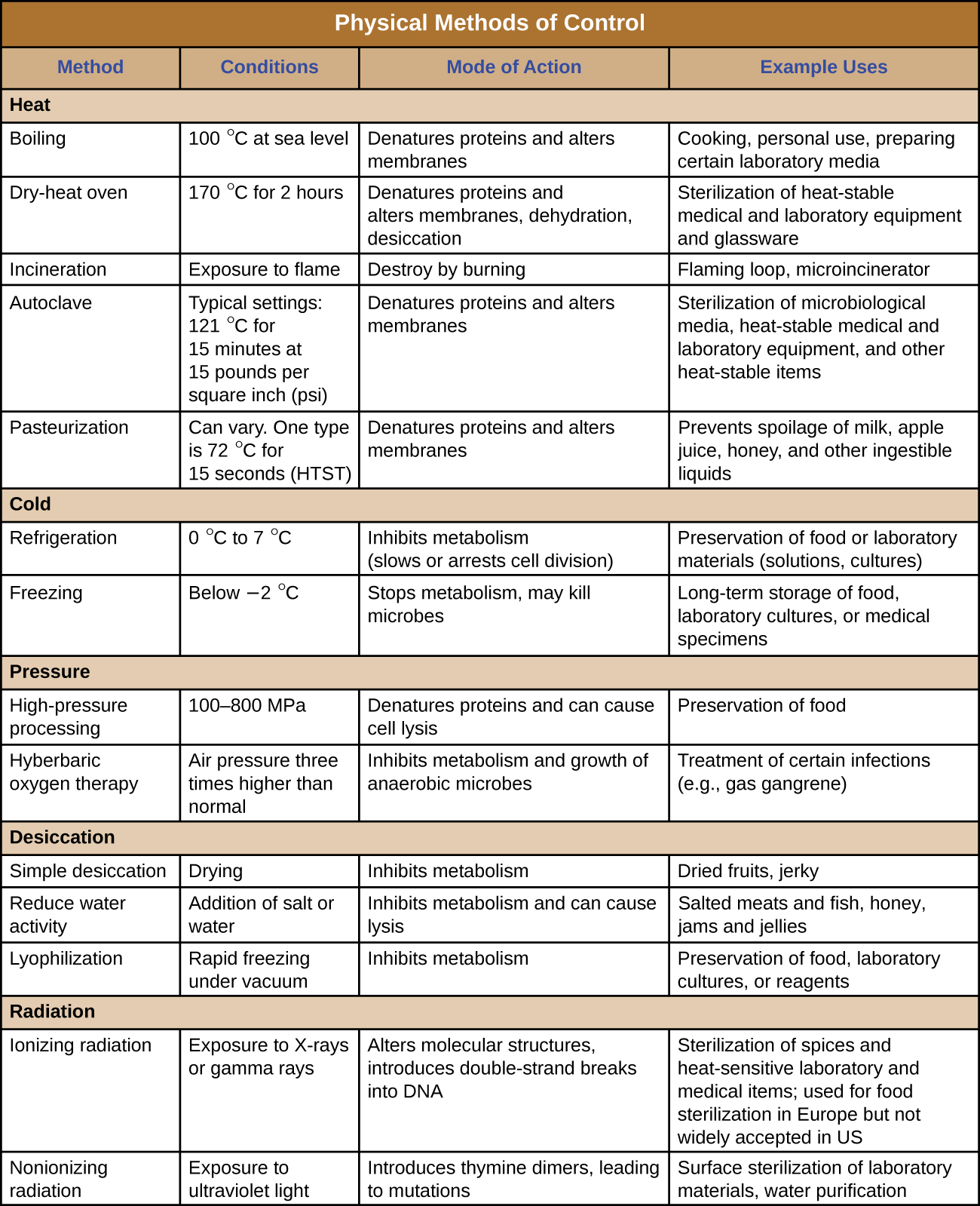
Figura\(\PageIndex{12}\) y Figura\(\PageIndex{13}\) resumen los métodos físicos de control discutidos en esta sección.
Conceptos clave y resumen
- El calor es un método ampliamente utilizado y altamente efectivo para controlar el crecimiento microbiano.
- Los protocolos de esterilización por calor seco se utilizan comúnmente en técnicas asépticas en el laboratorio. Sin embargo, la esterilización por calor húmedo es típicamente el protocolo más efectivo porque penetra en las células mejor que el calor seco.
- La pasteurización se utiliza para matar patógenos y reducir el número de microbios que causan el deterioro de los alimentos. La pasteurización a alta temperatura y a corto plazo se usa comúnmente para pasteurizar la leche que se refrigerará; la pasteurización a temperatura ultra alta se puede usar para pasteurizar la leche para almacenamiento a largo plazo sin refrigeración.
- La refrigeración ralentiza el crecimiento microbiano; la congelación detiene el crecimiento, matando algunos organismos. Los especímenes de laboratorio y médicos pueden congelarse en hielo seco o a temperaturas ultrabajas para su almacenamiento y transporte.
- El procesamiento a alta presión se puede usar para matar microbios en los alimentos. La oxigenoterapia hiperbárica para aumentar la saturación de oxígeno también se ha utilizado para tratar ciertas infecciones.
- La desecación se ha utilizado durante mucho tiempo para conservar los alimentos y se acelera a través de la adición de sal o azúcar, que disminuyen la actividad del agua en los alimentos.
- La liofilización combina la exposición al frío y la desecación para el almacenamiento a largo plazo de alimentos y materiales de laboratorio, pero los microbios permanecen y pueden rehidratarse.
- La radiación ionizante, incluida la irradiación gamma, es una manera efectiva de esterilizar materiales termosensibles y envasados. La radiación no ionizante, como la luz ultravioleta, es incapaz de penetrar en las superficies pero es útil para la esterilización de superficies.
- La filtración HEPA se usa comúnmente en sistemas de ventilación hospitalaria y gabinetes de seguridad biológica en laboratorios para evitar la transmisión de microbios aerotransportados. La filtración por membrana se usa comúnmente para eliminar bacterias de soluciones sensibles al calor.
Notas al pie
- 1 Departamento de Agricultura de Estados Unidos. “Congelación e Inocuidad Alimentaria”. 2013. http://www.fsis.usda.gov/wps/portal/...afety/CT_Index. Consultado el 8 de junio de 2016.
- 2 C. Ferstl. “Procesamiento de Alta Presión: Perspectivas sobre Tecnología y Requisitos Regulatorios”. Alimento para el Pensamiento/Libro Blanco. Serie Volumen 10. Livermore, CA: El Laboratorio Nacional de Alimentos; julio de 2013.
- 3 Administración de Alimentos y Medicamentos de Estados Unidos. “Cinética de la Inactivación Microbiana para Tecnologías Alternativas de Procesamiento de Alimentos: Procesamiento de Alta Presión.” 2000. www.Fda.gov/Food/FoodSciencer... /ucm101456.htm. Accedido el 19 de julio de 2106.
- 4 CL McCarty et al. “Gran Brote de Botulismo Asociado a una Comida de Comida de la Iglesia-Ohio, 2015”. Informe Semanal de Morbilidad y Mortalidad 64, núm. 29 (2015) :802—803.
- 5 AM Johnson et al. “Aceptación por el consumidor de carnes de aves de corral listas para comer irradiadas por haz de electrones”. Conservación de Procesamiento de Alimentos, 28 núm. 4 (2004) :302—319.


