15.2: Cómo los patógenos causan enfermedades
- Page ID
- 54620
Objetivos de aprendizaje
- Resumir los postulados de Koch y los postulados moleculares de Koch, respectivamente, y explicar su significación y limitaciones
- Explicar el concepto de patogenicidad (virulencia) en términos de dosis infecciosa y letal
- Distinguir entre patógenos primarios y oportunistas e identificar ejemplos específicos de cada
- Resumir las etapas de la patogénesis
- Explicar los roles de los portales de entrada y salida en la transmisión de enfermedades e identificar ejemplos específicos de estos portales
Para la mayoría de las enfermedades infecciosas, la capacidad de identificar con precisión el patógeno causante es un paso crítico para encontrar o prescribir tratamientos efectivos. Los médicos, pacientes e investigadores actuales tienen una deuda considerable con el médico Robert Koch (1843—1910), quien ideó un enfoque sistemático para confirmar las relaciones causales entre enfermedades y patógenos específicos.
Postulados de Koch
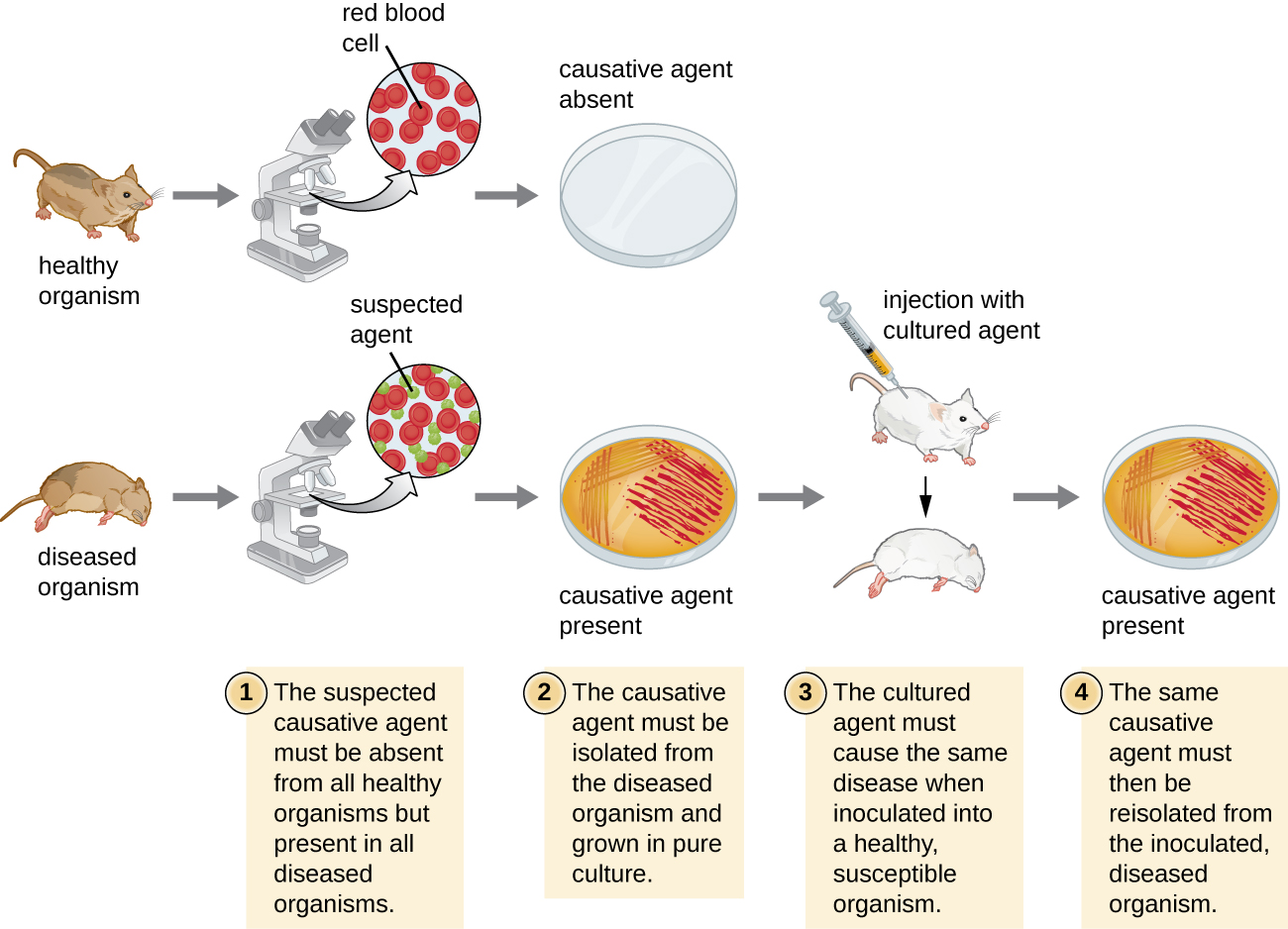
En 1884, Koch publicó cuatro postulados que resumieron su método para determinar si un microorganismo en particular era la causa de una enfermedad en particular. Cada uno de los postulados de Koch representa un criterio que debe cumplirse antes de que una enfermedad pueda vincularse positivamente con un patógeno. Para determinar si se cumplen los criterios, se realizan pruebas en animales de laboratorio y se comparan cultivos de animales sanos y enfermos (Figura\(\PageIndex{1}\)).
Postulados de Koch
- El patógeno sospechoso debe encontrarse en cada caso de enfermedad y no encontrarse en individuos sanos.
- El patógeno sospechoso puede aislarse y cultivarse en cultivo puro.
- Un sujeto de prueba sano infectado con el patógeno sospechoso debe desarrollar los mismos signos y síntomas de la enfermedad que se observan en el postulado
- El patógeno debe ser re-aislado del nuevo hospedador y debe ser idéntico al patógeno del postulado 2.
En muchos sentidos, los postulados de Koch siguen siendo fundamentales para nuestra comprensión actual de las causas de la enfermedad. Sin embargo, los avances en microbiología han revelado algunas limitaciones importantes en los criterios de Koch. Koch hizo varias suposiciones que ahora sabemos que son falsas en muchos casos. El primero se refiere al postulado 1, que asume que los patógenos solo se encuentran en individuos enfermos, no sanos. Esto no es cierto para muchos patógenos. Por ejemplo, H. pylori, descrito anteriormente en este capítulo como un patógeno causante de gastritis crónica, también forma parte de la microbiota normal del estómago en muchos humanos sanos que nunca desarrollan gastritis. Se estima que más del 50% de la población humana adquiere H. pylori temprano en la vida, manteniéndolo la mayoría como parte de la microbiota normal por el resto de su vida sin desarrollar jamás enfermedad.
La segunda suposición defectuosa de Koch fue que todos los sujetos sanos de prueba son igualmente susceptibles a la enfermedad. Ahora sabemos que los individuos no son igualmente susceptibles a la enfermedad. Los individuos son únicos en términos de su microbiota y el estado de su sistema inmunológico en un momento dado. La composición de la microbiota residente puede influir en la susceptibilidad de un individuo a una infección. Los miembros de la microbiota normal juegan un papel importante en la inmunidad al inhibir el crecimiento de patógenos transitorios. En algunos casos, la microbiota puede impedir que un patógeno establezca una infección; en otros, puede que no prevenga una infección por completo sino que puede influir en la gravedad o el tipo de signos y síntomas. En consecuencia, es posible que dos individuos con la misma enfermedad no siempre se presenten con los mismos signos y síntomas. Además, algunos individuos tienen sistemas inmunitarios más fuertes que otros. Los individuos con sistemas inmunitarios debilitados por la edad o una enfermedad no relacionada son mucho más susceptibles a ciertas infecciones que los individuos con sistemas inmunológicos fuertes.
Koch también asumió que todos los patógenos son microorganismos que pueden cultivarse en cultivo puro (postulado 2) y que los animales podrían servir como modelos confiables para enfermedades humanas. Sin embargo, ahora sabemos que no todos los patógenos pueden cultivarse en cultivo puro, y muchas enfermedades humanas no se pueden replicar de manera confiable en huéspedes animales. Los virus y ciertas bacterias, incluyendo Rickettsia y Chlamydia, son patógenos intracelulares obligados que solo pueden crecer cuando están dentro de una célula hospedadora. Si un microbio no puede ser cultivado, un investigador no puede pasar del postulado 2. Asimismo, sin un hospedador no humano adecuado, un investigador no puede evaluar el postulado 2 sin infectar deliberadamente a los humanos, lo que presenta obvias preocupaciones éticas. El SIDA es un ejemplo de tal enfermedad porque el virus de la inmunodeficiencia humana (VIH) solo causa enfermedad en humanos.
Ejercicio\(\PageIndex{1}\)
Resumir brevemente las limitaciones de los postulados de Koch.
Postulados de Koch Molecular
En 1988, Stanley Falkow (1934—) propuso una forma revisada de los postulados de Koch conocida como postulados moleculares de Koch. Estos se enumeran en la columna izquierda de la Tabla\(\PageIndex{1}\). La premisa para los postulados moleculares de Koch no está en la capacidad de aislar un patógeno en particular, sino en identificar un gen que pueda causar que el organismo sea patógeno.
Las modificaciones de Falkow a los postulados originales de Koch explican no solo infecciones causadas por patógenos intracelulares sino también la existencia de cepas patógenas de organismos que generalmente no son patógenos. Por ejemplo, la forma predominante de la bacteria Escherichia coli es miembro de la microbiota normal del intestino humano y generalmente se considera inofensiva. Sin embargo, existen cepas patógenas de E. coli como E. coli enterotoxigénica (ETEC) y E. coli enterohemorrágica (O157:H7) (EHEC). Ahora sabemos que ETEC y EHEC existen debido a la adquisición de nuevos genes por parte de la otrora inofensiva E. coli, que, en la forma de estas cepas patógenas, ahora es capaz de producir toxinas y causar enfermedades. Las formas patógenas resultaron de cambios genéticos menores. La columna derecha de la Tabla\(\PageIndex{1}\) ilustra cómo se pueden aplicar los postulados moleculares de Koch para identificar la EHEC como una bacteria patógena.
| Postulados de Koch Molecular | Aplicación a EHEC |
|---|---|
| (1) El fenotipo (signo o síntoma de enfermedad) debe asociarse únicamente con cepas patógenas de una especie. | El EHEC causa inflamación intestinal y diarrea, mientras que las cepas no patógenas de E. coli no lo hacen. |
| (2) La inactivación del (de los) gen (s) sospechoso (s) asociado (s) con patogenicidad debería dar como resultado una pérdida medible de pato | Uno de los genes en EHEC codifica para la toxina Shiga, una toxina bacteriana (veneno) que inhibe la síntesis de proteínas. La inactivación de este gen reduce la capacidad de la bacteria para causar enfermedades. |
| (3) La reversión del gen inactivo debe restaurar el fenotipo de la enfermedad. | Al agregar el gen que codifica la toxina de nuevo al genoma (por ejemplo, con un fago o plásmido), se restablece la capacidad de EHEC para causar enfermedades. |
Al igual que con los postulados originales de Koch, los postulados moleculares de Koch tienen limitaciones. Por ejemplo, la manipulación genética de algunos patógenos no es posible utilizando los métodos actuales de genética molecular. En una línea similar, algunas enfermedades no cuentan con modelos animales adecuados, lo que limita la utilidad tanto de los postulados originales como moleculares.
Ejercicio\(\PageIndex{2}\)
Explicar las diferencias entre los postulados originales de Koch y los postulados moleculares de Koch.
Patogenicidad y Virulencia
La capacidad de un agente microbiano para causar enfermedades se llama patogenicidad, y el grado en que un organismo es patógeno se llama virulencia. La virulencia es un continuo. En un extremo del espectro se encuentran organismos que son avirulentos (no dañinos) y en el otro están organismos que son altamente virulentos. Los patógenos altamente virulentos casi siempre conducirán a un estado de enfermedad cuando se introducen en el cuerpo, y algunos incluso pueden causar fallas multiorgánicas y del sistema corporal en individuos sanos. Los patógenos menos virulentos pueden causar una infección inicial, pero no siempre pueden causar enfermedades graves. Los patógenos con baja virulencia probablemente resultarían en signos y síntomas leves de enfermedad, como fiebre de bajo grado, dolor de cabeza o dolores musculares. Algunos individuos pueden incluso ser asintomáticos.
Un ejemplo de microorganismo altamente virulento es Bacillus anthracis, el patógeno responsable del ántrax. B. anthracis puede producir diferentes formas de enfermedad, dependiendo de la vía de transmisión (e.g., inyección cutánea, inhalación, ingestión). La forma más grave de ántrax es el ántrax por inhalación. Después de inhalar las esporas de B. anthracis, germinan. Se desarrolla una infección activa y las bacterias liberan potentes toxinas que causan edema (acumulación de líquido en los tejidos), hipoxia (una afección que impide que el oxígeno llegue a los tejidos) y necrosis (muerte celular e inflamación). Los signos y síntomas del ántrax por inhalación incluyen fiebre alta, dificultad para respirar, vómitos y tos con sangre, y dolores severos en el pecho que sugieren un ataque al corazón. Con el ántrax por inhalación, las toxinas y bacterias ingresan al torrente sanguíneo, lo que puede provocar insuficiencia multiorgánica y la muerte del paciente. Si se inactiva un gen (o genes) implicados en la patogénesis, la bacteria se vuelve menos virulenta o no patógena.
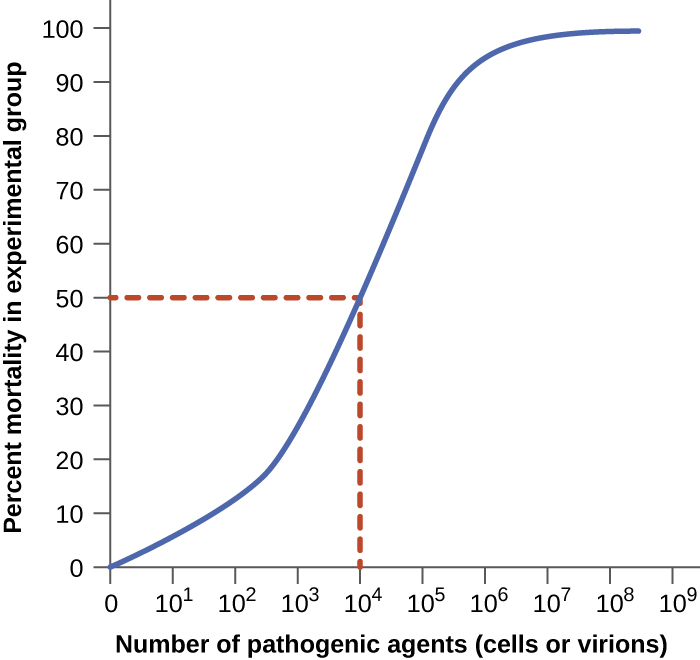
La virulencia de un patógeno puede cuantificarse mediante experimentos controlados con animales de laboratorio. Dos indicadores importantes de virulencia son la mediana de la dosis infecciosa (ID 50) y la mediana de la dosis letal (LD 50), ambas típicamente se determinan experimentalmente utilizando modelos animales. El ID 50 es el número de células patógenas o viriones requeridos para causar infección activa en el 50% de los animales inoculados. El LD 50 es el número de células patógenas, viriones o cantidad de toxina requerida para matar al 50% de los animales infectados. Para calcular estos valores, cada grupo de animales es inoculado con uno de un rango de números conocidos de células patógenas o viriones. En gráficas como la mostrada en la Figura\(\PageIndex{2}\), se grafica el porcentaje de animales que han sido infectados (para ID 50) o sacrificados (para LD 50) frente a la concentración de patógeno inoculado. La Figura\(\PageIndex{2}\) representa datos graficados de un experimento hipotético que mide la LD 50 de un patógeno. La interpretación de los datos de esta gráfica indica que la LD 50 del patógeno para los animales de prueba es de 10 4 células patógenas o viriones (dependiendo del patógeno estudiado).
La tabla\(\PageIndex{2}\) enumera patógenos transmitidos por alimentos seleccionados y sus valores de ID 50 en humanos (según lo determinado a partir de datos epidemiológicos y estudios sobre voluntarios humanos). Tenga en cuenta que estos son valores medianos. La dosis infecciosa real para un individuo puede variar ampliamente, dependiendo de factores como la vía de entrada; la edad, salud y estado inmune del huésped; y factores ambientales y específicos de patógenos como la susceptibilidad al pH ácido del estómago. También es importante señalar que la dosis infecciosa de un patógeno no necesariamente se correlaciona con la gravedad de la enfermedad. Por ejemplo, una sola célula de Salmonella enterica serotipo Typhimurium puede resultar en una infección activa. La enfermedad resultante, gastroenteritis por Salmonella o salmonelosis, puede causar náuseas, vómitos y diarrea, pero tiene una tasa de mortalidad inferior al 1% en adultos sanos. Por el contrario, el serotipo Typhi de S. enterica tiene una ID 50 mucho mayor, requiriendo típicamente hasta 1,000 células para producir infección. Sin embargo, este serotipo causa fiebre tifoidea, una enfermedad mucho más sistémica y grave que tiene una tasa de mortalidad de hasta 10% en individuos no tratados.
| Patógeno | ID 50 |
|---|---|
| Virus | |
| Virus de la hepatitis A | 10—100 |
| Norovirus | 1—10 |
| Rotavirus | 10—100 |
| Bacterias | |
| Escherichia coli, enterohemorrágica (EHEC, serotipo O157) | 10—100 |
| E. coli, enteroinvasiva (EIEC) | 200—5,000 |
| E. coli, enteropatógena (EPEC) | 10,000,000—10,000,000,000 |
| E. coli, enterotoxigénica (ETEC) | 10,000,000—10,000,000,000 |
| Salmonella enterica serovar Typhi | <1,000> |
| S. enterica serovar Typhimurium | ≥1 |
| Shigella dysenteriae | 10—200 |
| Vibrio cholerae (serotipos O139, O1) | 1,000,000 |
| V. parahemolyticus | 100,000,000 |
| Protozoos | |
| Giardia lamblia | 1 |
| Cryptosporidium parvum | 10—100 |
Ejercicio\(\PageIndex{3}\)
- ¿Cuál es la diferencia entre la dosis infecciosa de un patógeno y la dosis letal?
- ¿Cuál está más estrechamente relacionado con la gravedad de una enfermedad?
Patógenos primarios versus patógenos oportunistas
Los patógenos pueden clasificarse como patógenos primarios o patógenos oportunistas. Un patógeno primario puede causar enfermedad en un huésped independientemente de la microbiota residente del huésped o sistema inmunitario. Un patógeno oportunista, por el contrario, solo puede causar enfermedades en situaciones que comprometen las defensas del huésped, como las barreras protectoras del organismo, el sistema inmunitario o la microbiota normal. Los individuos susceptibles a infecciones oportunistas incluyen a los muy jóvenes, los ancianos, las mujeres embarazadas, los pacientes sometidos a quimioterapia, las personas con inmunodeficiencias (como el síndrome de inmunodeficiencia adquirida [SIDA]), los pacientes que se están recuperando de la cirugía y los que han tenido una violación de barreras protectoras (como una herida grave o quemadura).
Un ejemplo de un patógeno primario es E. coli enterohemorrágica (EHEC), que produce un factor de virulencia conocido como toxina Shiga. Esta toxina inhibe la síntesis de proteínas, lo que lleva a diarrea severa y sanguinolenta, inflamación e insuficiencia renal, incluso en pacientes con sistemas inmunológicos sanos. Staphylococcus epidermidis, por otro lado, es un patógeno oportunista que se encuentra entre las causas más frecuentes de enfermedad nosocomial. 2 S. epidermidis es miembro de la microbiota normal de la piel, donde generalmente es avirulenta. Sin embargo, en los hospitales, también puede crecer en biopelículas que se forman en catéteres, implantes u otros dispositivos que se insertan en el cuerpo durante los procedimientos quirúrgicos. Una vez dentro del cuerpo, S. epidermidis puede causar infecciones graves como la endocarditis, y produce factores de virulencia que promueven la persistencia de tales infecciones.
Otros miembros de la microbiota normal también pueden causar infecciones oportunistas bajo ciertas condiciones. Esto suele ocurrir cuando los microbios que residen inofensivos en una ubicación corporal terminan en un sistema corporal diferente, donde causan enfermedades. Por ejemplo, E. coli que normalmente se encuentra en el intestino grueso puede provocar una infección del tracto urinario si ingresa a la vejiga. Esta es la principal causa de infecciones del tracto urinario entre las mujeres.
Los miembros de la microbiota normal también pueden causar enfermedades cuando un cambio en el ambiente del cuerpo conduce al crecimiento excesivo de un microorganismo en particular. Por ejemplo, la levadura Candida es parte de la microbiota normal de la piel, boca, intestino y vagina, pero su población es mantenida bajo control por otros organismos de la microbiota. Sin embargo, si un individuo está tomando medicamentos antibacterianos, las bacterias que normalmente inhibirían el crecimiento de Candida pueden ser destruidas, lo que lleva a un crecimiento repentino en la población de Candida, que no se ve afectada por medicamentos antibacterianos por tratarse de un hongo. Un crecimiento excesivo de Candida puede manifestarse como candidiasis oral (crecimiento en la boca, garganta y lengua), una infección vaginal por hongos o candidiasis cutánea. Otros escenarios también pueden brindar oportunidades para infecciones por Candida. La diabetes no tratada puede resultar en una alta concentración de glucosa en la saliva, lo que proporciona un ambiente óptimo para el crecimiento de Candida, resultando en aftas. Las inmunodeficiencias como las observadas en pacientes con VIH, SIDA y cáncer también conducen a una mayor incidencia de aftas. Las infecciones vaginales por hongos pueden resultar de disminuciones en los niveles de estrógeno durante la menstruación o la menopausia. La cantidad de glucógeno disponible para los lactobacilos en la vagina está controlada por los niveles de estrógeno; cuando los niveles de estrógeno son bajos, los lactobacilos producen menos ácido láctico. El aumento resultante en el pH vaginal permite el crecimiento excesivo de Candida en la vagina.
Ejercicio\(\PageIndex{4}\)
- Explicar la diferencia entre un patógeno primario y un patógeno oportunista.
- Describir algunas condiciones bajo las cuales puede ocurrir una infección oportunista.
Etapas de la patogénesis
Para causar enfermedad, un patógeno debe alcanzar con éxito cuatro etapas o etapas de patogénesis: exposición (contacto), adhesión (colonización), invasión e infección. El patógeno debe poder ingresar al huésped, viajar al lugar donde pueda establecer una infección, evadir o superar la respuesta inmune del huésped y causar daño (es decir, enfermedad) al hospedador. En muchos casos, el ciclo se completa cuando el patógeno sale del huésped y se transmite a un nuevo huésped.
Exposición
Un encuentro con un patógeno potencial se conoce como exposición o contacto. Los alimentos que comemos y los objetos que manejamos son formas en las que podemos entrar en contacto con patógenos potenciales. Sin embargo, no todos los contactos resultan en infección y enfermedad. Para que un patógeno cause una enfermedad, necesita poder acceder al tejido huésped. Un sitio anatómico a través del cual los patógenos pueden pasar al tejido hospedador se denomina portal de entrada. Estas son ubicaciones donde las células hospedadoras están en contacto directo con el entorno externo. Los principales portales de entrada se identifican en la Figura\(\PageIndex{3}\) e incluyen la piel, las membranas mucosas y las vías parenterales.
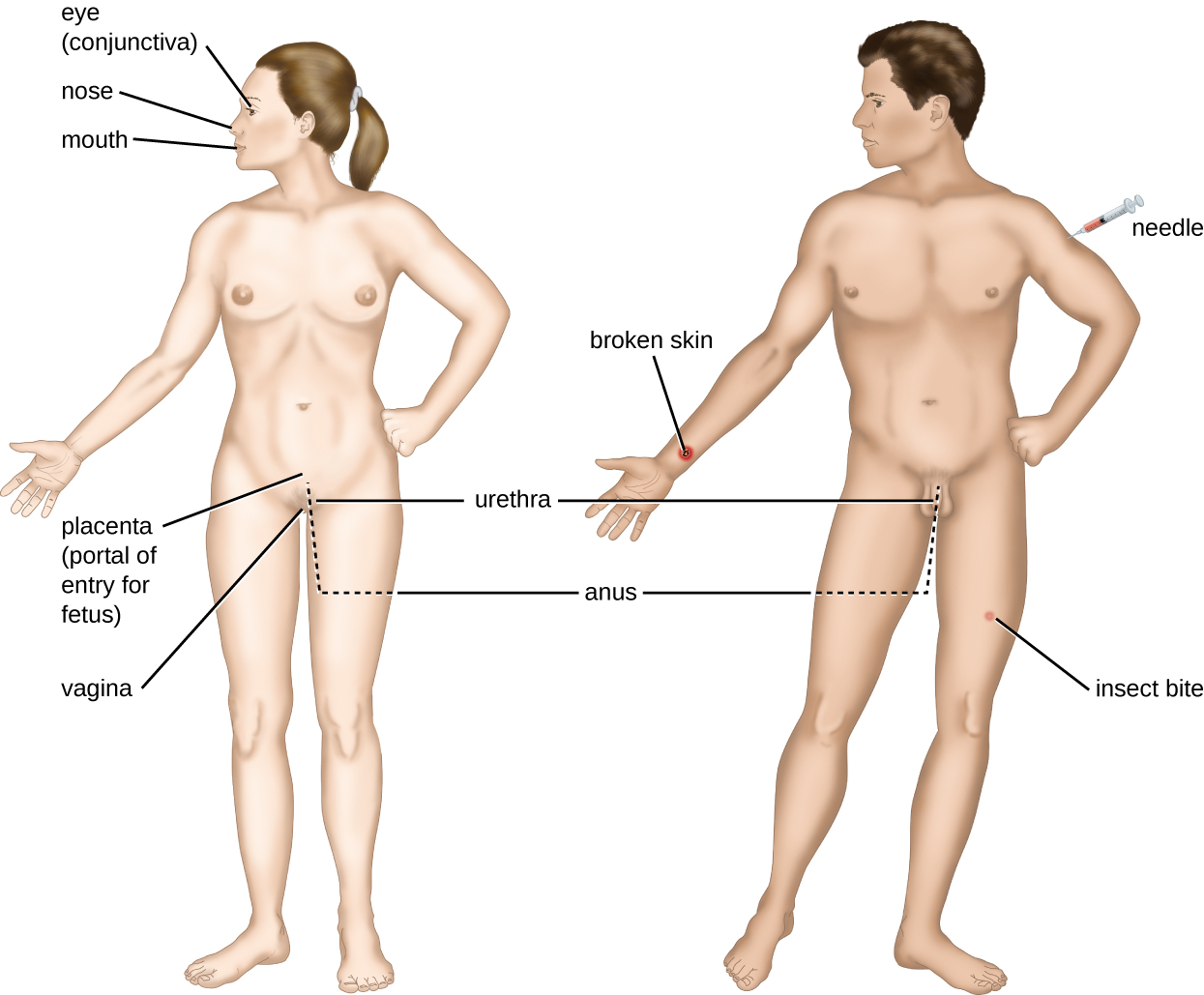
Las superficies mucosas son los portales de entrada más importantes para los microbios; estos incluyen las membranas mucosas del tracto respiratorio, el tracto gastrointestinal y el tracto genitourinario. Aunque la mayoría de las superficies mucosas se encuentran en el interior del cuerpo, algunas son contiguas a la piel externa en varias aberturas corporales, incluyendo los ojos, la nariz, la boca, la uretra y el ano.
La mayoría de los patógenos son adecuados para un portal de entrada particular. La especificidad portal de un patógeno está determinada por las adaptaciones ambientales del organismo y por las enzimas y toxinas que segregan. Los tractos respiratorio y gastrointestinal son portales de entrada particularmente vulnerables debido a que las partículas que incluyen microorganismos son constantemente inhaladas o ingeridas, respectivamente.
Los patógenos también pueden entrar a través de una brecha en las barreras protectoras de la piel y las membranas mucosas. Se dice que los patógenos que ingresan al cuerpo de esta manera ingresan por vía parenteral. Por ejemplo, la piel es una buena barrera natural para los patógenos, pero las roturas en la piel (por ejemplo, heridas, picaduras de insectos, picaduras de animales, pinchazos de aguja) pueden proporcionar un portal de entrada parenteral para microorganismos.
En mujeres embarazadas, la placenta normalmente impide que los microorganismos pasen de la madre al feto. Sin embargo, algunos patógenos son capaces de cruzar la barrera sangre-placentaria. La bacteria grampositiva Listeria monocytogenes, que causa la listeriosis de la enfermedad transmitida por los alimentos, es un ejemplo que plantea un grave riesgo para el feto y en ocasiones puede llevar al aborto espontáneo. Otros patógenos que pueden pasar la barrera placentaria para infectar al feto son conocidos colectivamente por las siglas TORCH (Tabla\(\PageIndex{3}\)).
La transmisión de enfermedades infecciosas de la madre al bebé también es una preocupación en el momento del nacimiento cuando el bebé pasa por el canal del parto. Los bebés cuyas madres tienen infecciones activas por clamidia o gonorrea pueden estar expuestos a los patógenos causantes en la vagina, lo que puede resultar en infecciones oculares que conducen a la ceguera. Para evitar esto, es una práctica estándar administrar gotas antibióticas en los ojos de los bebés poco después del nacimiento.
| Enfermedad | Patógeno | |
|---|---|---|
| T | Toxoplasmosis | Toxoplasma gondii (protozoo) |
| O 3 |
Sífilis Varicela Hepatitis B VIH Quinta enfermedad (eritema infeccioso) |
Treponema pallidum (bacteria) Virus varicela-zóster (herpesvirus humano 3) Virus de la hepatitis B (hepadnavirus) Retrovirus Parvovirus B19 |
| R | Rubéola (sarampión alemán) | Togavirus |
| C | Citomegalovirus | Herpesvirus humano 5 |
| H | Herpes | Virus del herpes simple (HSV) 1 y 2 |
Enfoque Clínico: Parte 2
En la clínica, un médico toma el historial médico de Michael y le pregunta sobre sus actividades y dieta durante la semana pasada. Al enterarse de que Michael se enfermó al día siguiente de la fiesta, el médico ordena un análisis de sangre para verificar si hay patógenos asociados con enfermedades transmitidas por los alimentos. Después de que las pruebas confirman esa presencia de una varilla grampositiva en la sangre de Michael, se le administra una inyección de un antibiótico de amplio espectro y se le envía a un hospital cercano, donde es ingresado como paciente. Ahí está para recibir antibióticos intravenosos adicionales y líquidos.
Ejercicio\(\PageIndex{5}\)
- ¿Esta bacteria en la sangre de Michael es parte de la microbiota normal?
- ¿Qué portal de entrada utilizó la bacteria para causar esta infección?
Adhesión
Tras la exposición inicial, el patógeno se adhiere en el portal de entrada. El término adhesión se refiere a la capacidad de los microbios patógenos para unirse a las células del cuerpo mediante factores de adhesión, y diferentes patógenos utilizan diversos mecanismos para adherirse a las células de los tejidos hospedadores.
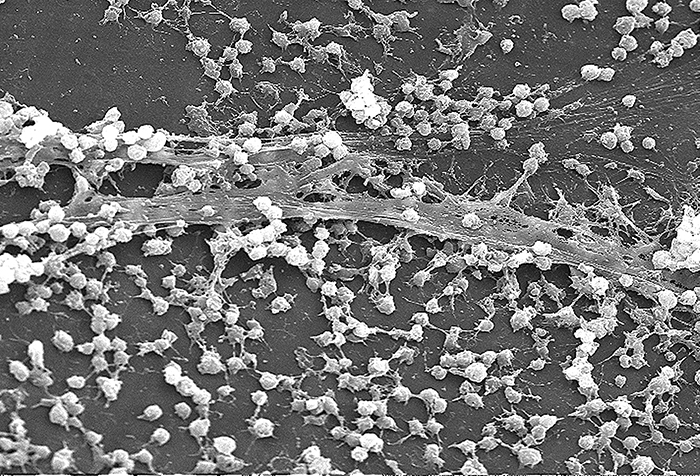
Las moléculas (ya sean proteínas o carbohidratos) llamadas adhesinas se encuentran en la superficie de ciertos patógenos y se unen a receptores específicos (glicoproteínas) en las células hospedadoras. Las adhesinas están presentes en las fimbrias y flagelos de bacterias, los cilios de los protozoos y las cápsides o membranas de virus. Los protozoos también pueden usar ganchos y púas para la adhesión; las proteínas pico en los virus también mejoran la adhesión viral. La producción de glicocálices (capas de limo y cápsulas) (Figura\(\PageIndex{4}\)), con su alto contenido de azúcar y proteína, también puede permitir que ciertos patógenos bacterianos se adhieran a las células.
El crecimiento de biopelículas también puede actuar como factor de adhesión. Una biopelícula es una comunidad de bacterias que producen un glicocáliz, conocido como sustancia extrapolímera (EPS), que permite que la biopelícula se adhiera a una superficie. Las infecciones persistentes por Pseudomonas aeruginosa son frecuentes en pacientes que padecen fibrosis quística, quemaduras e infecciones del oído medio (otitis media) porque P. aeruginosa produce una biopelícula. El EPS permite que las bacterias se adhieran a las células hospedadoras y dificulta que el huésped elimine físicamente el patógeno. El EPS no solo permite la unión sino que brinda protección contra el sistema inmunológico y los tratamientos antibióticos, evitando que los antibióticos lleguen a las células bacterianas dentro de la biopelícula. Además, no todas las bacterias en una biopelícula están creciendo rápidamente; algunas están en fase estacionaria. Dado que los antibióticos son más efectivos contra las bacterias de rápido crecimiento, porciones de bacterias en una biopelícula están protegidas contra los antibióticos. 4
Invasión
Una vez que la adhesión es exitosa, la invasión puede continuar. La invasión implica la diseminación de un patógeno a través de los tejidos locales o el cuerpo. Los patógenos pueden producir exoenzimas o toxinas, que sirven como factores de virulencia que les permiten colonizar y dañar los tejidos del huésped a medida que se propagan más profundamente en el cuerpo. Los patógenos también pueden producir factores de virulencia que los protegen contra las defensas del sistema inmune. Los factores de virulencia específicos de un patógeno determinan el grado de daño tisular que ocurre. La figura\(\PageIndex{5}\) muestra la invasión de H. pylori en los tejidos del estómago, causando daño a medida que avanza.
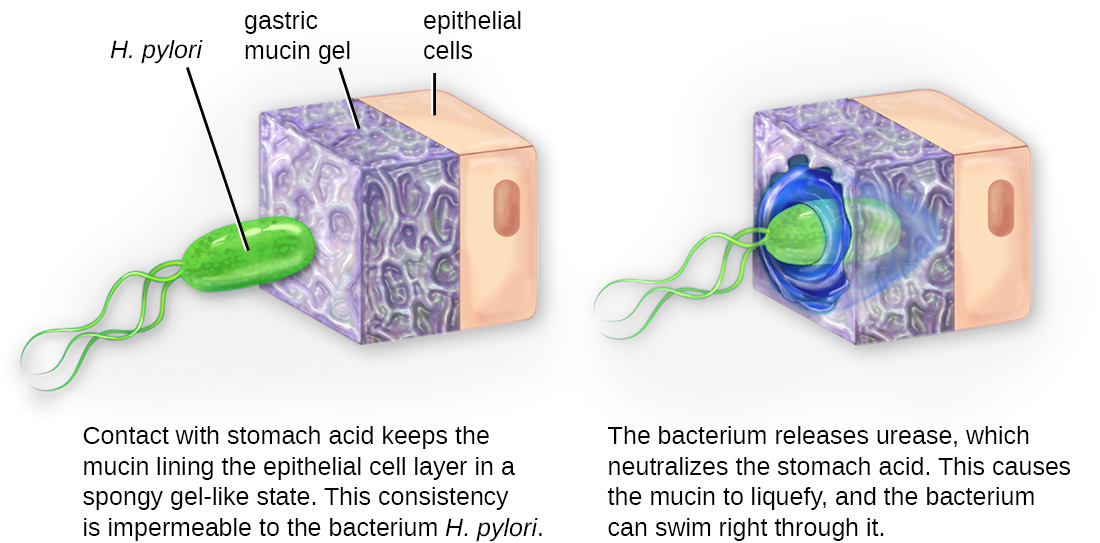
Los patógenos intracelulares logran invasión al ingresar a las células del huésped y reproducirse. Algunos son patógenos intracelulares obligados (lo que significa que solo pueden reproducirse dentro de las células hospedadoras) y otros son patógenos intracelulares facultativos (lo que significa que pueden reproducirse dentro o fuera de las células huésped). Al ingresar a las células hospedadoras, los patógenos intracelulares son capaces de evadir algunos mecanismos del sistema inmune a la vez que explotan los nutrientes en la célula hospedadora.
La entrada a una célula puede ocurrir por endocitosis. Para la mayoría de los tipos de células hospedadoras, los patógenos utilizan uno de dos mecanismos diferentes para la endocitosis y la entrada. Un mecanismo se basa en proteínas efectoras secretadas por el patógeno; estas proteínas efectoras desencadenan la entrada en la célula hospedadora. Este es el método que usan Salmonella y Shigella cuando invaden las células epiteliales intestinales. Cuando estos patógenos entran en contacto con las células epiteliales en el intestino, secretan moléculas efectoras que provocan protuberancias de volantes de membrana que traen la célula bacteriana. Este proceso se llama ruffling de membrana. El segundo mecanismo se basa en proteínas de superficie expresadas en el patógeno que se unen a receptores en la célula hospedadora, dando como resultado la entrada. Por ejemplo, Yersinia pseudotuberculosis produce una proteína de superficie conocida como invasin que se une a integrinas beta-1 expresadas en la superficie de las células hospedadoras.
Algunas células hospedadoras, como los glóbulos blancos y otros fagocitos del sistema inmune, endocitosan activamente patógenos en un proceso llamado fagocitosis. Aunque la fagocitosis permite que el patógeno ingrese a la célula hospedadora, en la mayoría de los casos, la célula hospedadora mata y degrada al patógeno mediante el uso de enzimas digestivas. Normalmente, cuando un patógeno es ingerido por un fagocito, se encierra dentro de un fagosoma en el citoplasma; el fagosoma se fusiona con un lisosoma para formar un fagolisosoma, donde las enzimas digestivas matan al patógeno (ver Reconocimiento de patógenos y fagocitosis). Sin embargo, algunos patógenos intracelulares tienen la capacidad de sobrevivir y multiplicarse dentro de los fagocitos. Los ejemplos incluyen Listeria monocytogenes y Shigella; estas bacterias producen proteínas que lisan el fagosoma antes de que se fusione con el lisosoma, permitiendo que las bacterias escapen al citoplasma del fagocito donde pueden multiplicarse. Las bacterias como Mycobacterium tuberculosis, Legionella pneumophila y las especies de Salmonella utilizan un mecanismo ligeramente diferente para evitar ser digeridos por el fagocito. Estas bacterias impiden la fusión del fagosoma con el lisosoma, permaneciendo así vivas y dividiéndose dentro del fagosoma.
Infección
Después de la invasión, la multiplicación exitosa del patógeno conduce a la infección. Las infecciones pueden describirse como locales, focales o sistémicas, dependiendo de la extensión de la infección. Una infección local se limita a una pequeña área del cuerpo, generalmente cerca del portal de entrada. Por ejemplo, un folículo piloso infectado por la infección por Staphylococcus aureus puede provocar un hervor alrededor del sitio de la infección, pero la bacteria está contenida en gran medida en esta pequeña ubicación. Otros ejemplos de infecciones locales que implican una afectación tisular más extensa incluyen infecciones del tracto urinario confinadas a la vejiga o neumonía confinada a los pulmones.
En una infección focal, un patógeno localizado, o las toxinas que produce, pueden propagarse a una ubicación secundaria. Por ejemplo, un higienista dental que mella la encía con una herramienta afilada puede provocar una infección local en la encía por bacterias Streptococcus de la microbiota oral normal. Estos Streptococcus spp. pueden entonces acceder al torrente sanguíneo y dirigirse a otras ubicaciones del cuerpo, lo que resulta en una infección secundaria.
Cuando una infección se disemina por todo el cuerpo, la llamamos infección sistémica. Por ejemplo, la infección por el virus varicela-zóster generalmente ingresa a través de una membrana mucosa del sistema respiratorio superior. Luego se propaga por todo el cuerpo, dando como resultado las clásicas lesiones cutáneas rojas asociadas a la varicela. Dado que estas lesiones no son sitios de infección inicial, son signos de una infección sistémica.
En ocasiones una infección primaria, la infección inicial causada por un patógeno, puede conducir a una infección secundaria por otro patógeno. Por ejemplo, el sistema inmunitario de un paciente con una infección primaria por VIH se ve comprometido, haciendo que el paciente sea más susceptible a enfermedades secundarias como la candidiasis oral y otras causadas por patógenos oportunistas. De igual manera, una infección primaria por Influenzavirus daña y disminuye los mecanismos de defensa de los pulmones, haciendo que los pacientes sean más susceptibles a una neumonía secundaria por un patógeno bacteriano como Haemophilus influenzae o Streptococcus pneumoniae. Algunas infecciones secundarias pueden incluso desarrollarse como resultado del tratamiento de una infección primaria. La terapia antibiótica dirigida al patógeno primario puede causar daño colateral a la microbiota normal, creando una apertura para patógenos oportunistas (ver Caso en Punto: Una Infección por Levadura Secundaria a continuación).
Una infección secundaria por levaduras
Anita, de 36 años, madre de tres hijos, acude a un centro de atención urgente quejándose de presión pélvica, micción frecuente y dolorosa, calambres abdominales y orina ocasional teñida de sangre. Al sospechar una infección del tracto urinario (ITU), el médico solicita una muestra de orina y la envía al laboratorio para un análisis de orina. Dado que tardará aproximadamente 24 horas en obtener los resultados del cultivo, el médico inmediatamente inicia Anita con el antibiótico ciprofloxacino. Al día siguiente, el laboratorio de microbiología confirma la presencia de E. coli en la orina de Anita, lo que concuerda con el diagnóstico presuntivo. Sin embargo, la prueba de susceptibilidad antimicrobiana indica que el ciprofloxacino no trataría eficazmente la ITU de Anita, por lo que el médico prescribe un antibiótico diferente.
Después de tomar sus antibióticos durante 1 semana, Anita regresa a la clínica quejándose de que la receta no está funcionando. A pesar de que el dolor al orinar ha disminuido, ahora experimenta comezón vaginal, ardor y secreción. Después de un breve examen, el médico le explica a Anita que los antibióticos probablemente tuvieron éxito en matar a la E. coli responsable de su UTI; sin embargo, en el proceso, también eliminaron muchas de las bacterias “buenas” en la microbiota normal de Anita. Los nuevos síntomas que ha reportado Anita son consistentes con una infección secundaria por levaduras por Candida albicans, un hongo oportunista que normalmente reside en la vagina pero es inhibido por las bacterias que normalmente residen en el mismo ambiente.
Para confirmar este diagnóstico, se prepara un portaobjetos de microscopio de un frotis vaginal directo a partir del flujo para verificar la presencia de levadura. Una muestra del alta acompaña este portaobjetos al laboratorio de microbiología para determinar si ha habido un incremento en la población de levaduras causantes de vaginitis. Después de que el laboratorio de microbiología confirme el diagnóstico, el médico le receta un medicamento antifúngico para que Anita lo use para eliminar su infección secundaria por levaduras.
Ejercicio\(\PageIndex{6}\)
- ¿Por qué Candida no fue asesinada por los antibióticos recetados para la UTI?
- Enumere tres padecimientos que podrían llevar a una infección secundaria.
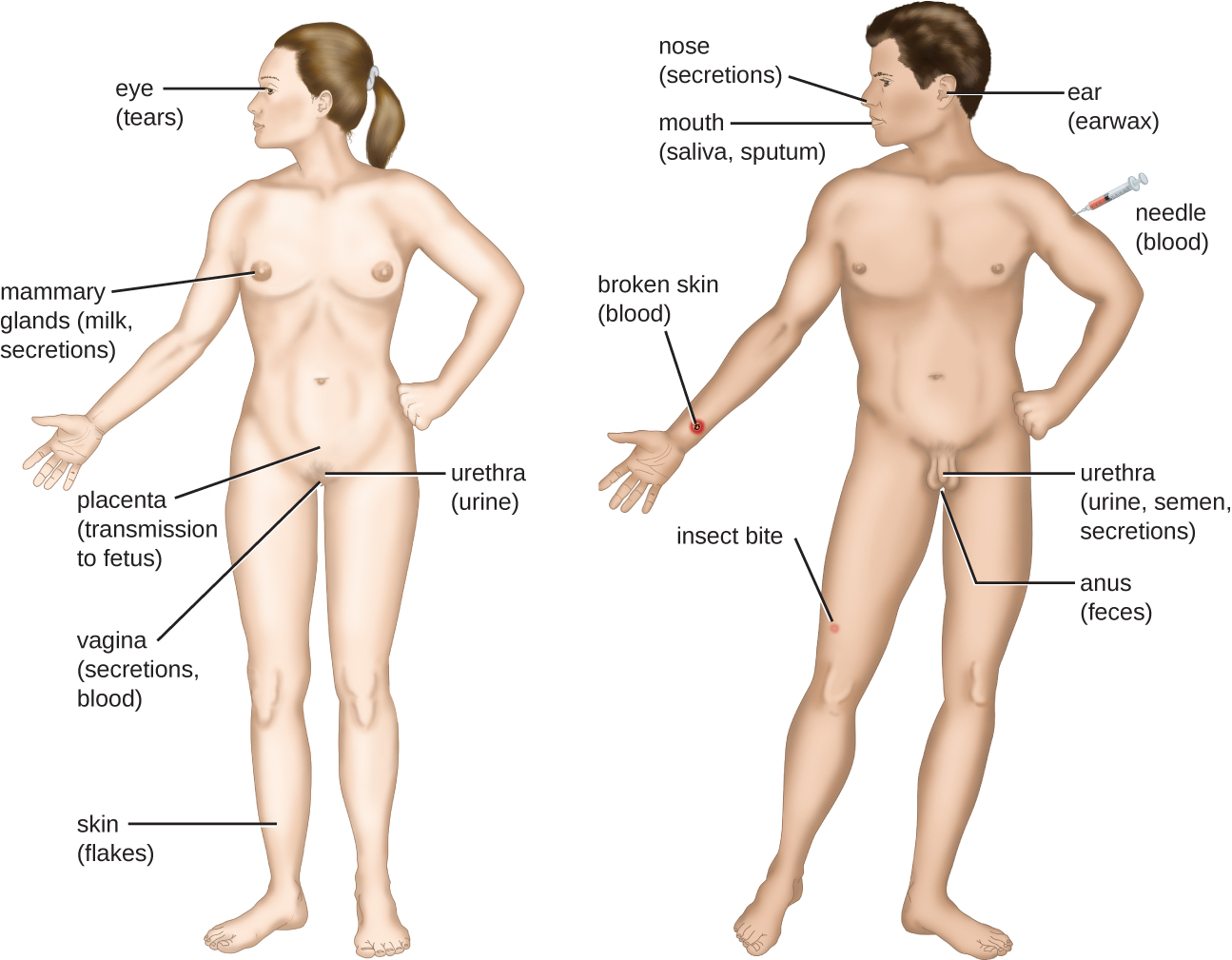
Transmisión de la enfermedad
Para que un patógeno persista, debe ponerse en condiciones de transmitirse a un nuevo huésped, dejando al hospedador infectado a través de un portal de salida (Figura\(\PageIndex{6}\)). Al igual que con los portales de entrada, muchos patógenos están adaptados para utilizar un portal de salida particular. Similar a los portales de entrada, los portales de salida más comunes incluyen la piel y los tractos respiratorios, urogenitales y gastrointestinales. La tos y los estornudos pueden expulsar patógenos de las vías respiratorias. Un solo estornudo puede enviar miles de partículas de virus al aire. Las secreciones y excreciones pueden transportar patógenos fuera de otros portales de salida. Las heces, la orina, el semen, las secreciones vaginales, las lágrimas, el sudor y las células cutáneas desprendidas pueden servir como vehículos para que un patógeno salga del cuerpo. Los patógenos que dependen de insectos vectores para su transmisión salen del cuerpo en la sangre extraída por un insecto mordedor. De igual manera, algunos patógenos salen del cuerpo en sangre extraída por agujas.
Conceptos clave y resumen
- Los postulados de Koch se utilizan para determinar si un microorganismo en particular es un patógeno. Los postulados de Molecular Koch se utilizan para determinar qué genes contribuyen a la capacidad de un patógeno para causar enfermedades.
- La virulencia, el grado en que un patógeno puede causar enfermedad, se puede cuantificar calculando la ID 50 o LD 50 de un patógeno en una población determinada.
- Los patógenos primarios son capaces de causar cambios patológicos asociados a la enfermedad en un individuo sano, mientras que los patógenos oportunistas solo pueden causar enfermedad cuando el individuo se ve comprometido por una ruptura de barreras protectoras o inmunosupresión.
- Las infecciones y enfermedades pueden ser causadas por patógenos en el ambiente o microbios en la microbiota residente de un individuo.
- Las infecciones pueden clasificarse como locales, focales o sistémicas dependiendo de la medida en que el patógeno se propague en el organismo.
- Una infección secundaria a veces puede ocurrir después de que las defensas del huésped o la microbiota normal se vean comprometidas por una infección primaria o tratamiento antibiótico.
- Los patógenos ingresan al cuerpo a través de portales de entrada y salen por portales de salida. Las etapas de patogénesis incluyen exposición, adhesión, invasión, infección y transmisión.
Notas al pie
- 1 Administración de Alimentos y Medicamentos. “Bad Bug Book, Microorganismos patógenos transmitidos por los alimentos y toxinas naturales.” 2a ed. Silver Spring, MD: Administración de Alimentos y Medicamentos de Estados Unidos; 2012.
- 2 M. Otto. “Staphylococcus epidermidis —El patógeno 'accidental'”. Nature Reviews Microbiología 7 núm. 8 (2009) :555—567.
- 3 La O en TORCHA significa “otro”.
- 4 D. Davies. “Entendiendo la Resistencia a Biofilm a los Agentes Antibacterianos”. Nature Reviews Drug Discovery 2 (2003) :114—122.


