20.3: Ensayos de aglutinación
- Page ID
- 54778
Objetivos de aprendizaje
- Comparar aglutinación directa e indirecta
- Identificar diversos usos de la hemaglutinación en el diagnóstico de la enfermedad
- Explicar cómo se determinan los tipos de sangre
- Explicar los pasos utilizados para hacer coincidir la sangre que se utilizará en una transfusión
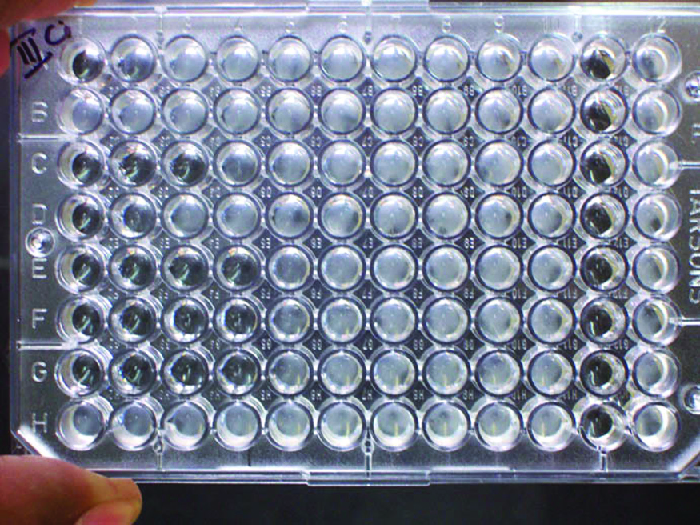
Además de provocar la precipitación de moléculas solubles y la floculación de moléculas en suspensión, los anticuerpos también pueden agrupar células o partículas (por ejemplo, perlas de látex recubiertas de antígeno) en un proceso llamado aglutinación (Figura 18.1.8). La aglutinación se puede utilizar como indicador de la presencia de anticuerpos contra bacterias o glóbulos rojos. Los ensayos de aglutinación suelen ser rápidos y fáciles de realizar en un portaobjetos de vidrio o placa de microtitulación (Figura\(\PageIndex{1}\)). Las placas de microtitulación tienen una serie de pocillos para contener pequeños volúmenes de reactivos y para observar reacciones (por ejemplo, aglutinación) ya sea visualmente o usando un espectrofotómetro especialmente diseñado. Los pozos vienen en muchos tamaños diferentes para ensayos que involucran diferentes volúmenes de reactivos.
Aglutinación de Bacterias y Virus
El uso de pruebas de aglutinación para identificar bacterias estreptocócicas fue desarrollado en la década de 1920 por Rebecca Lancefield trabajando con sus colegas A.R. Dochez y Oswald Avery. 1 Utilizó anticuerpos para identificar la proteína M, un factor de virulencia en los estreptococos que es necesario para la capacidad de la bacteria de causar faringitis estreptocócica. La producción de anticuerpos contra la proteína M es crucial para montar una respuesta protectora contra las bacterias.
Lancefield utilizó antisueros para demostrar que diferentes cepas de la misma especie de estreptococos expresan diferentes versiones de la proteína M, lo que explica por qué los niños pueden caer con faringitis estreptocócica repetidamente. Lancefield clasificó los estreptococos beta-hemolíticos en muchos grupos basándose en diferencias antigénicas en polisacáridos específicos de grupo ubicados en la pared celular bacteriana. Las cepas se llaman serovares porque se diferencian usando antisueros. Identificar los serovares presentes en un brote de enfermedad es importante porque algunos serovares pueden causar enfermedad más grave que otros.
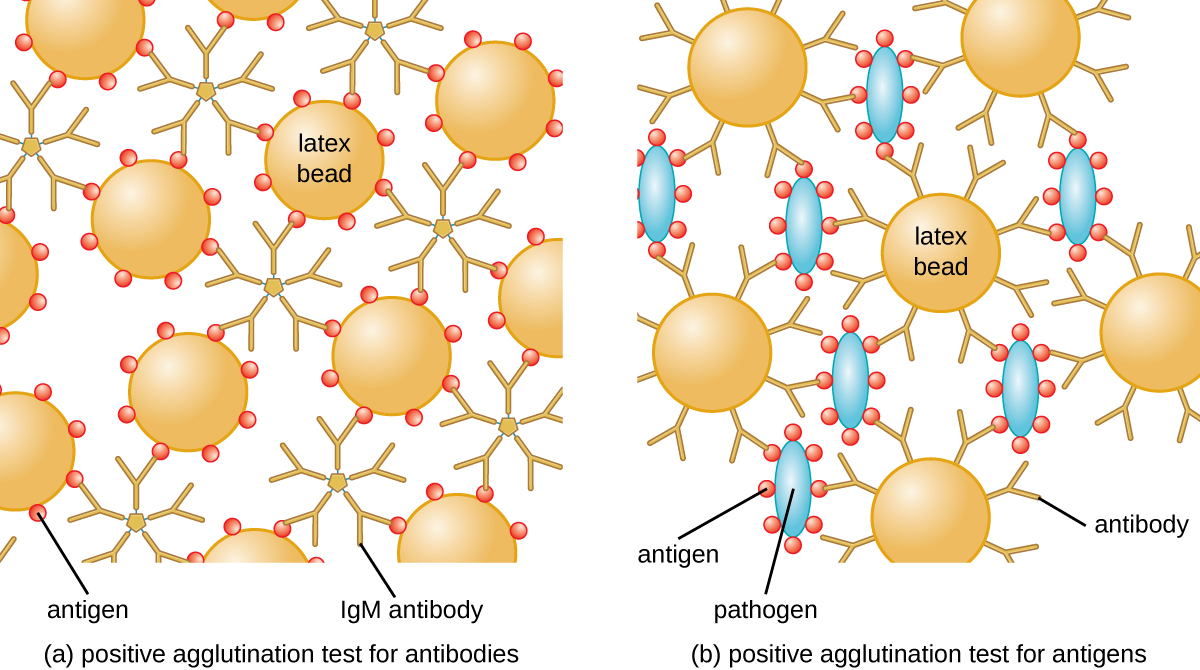
El método desarrollado por Lancefield es un ensayo de aglutinación directa, ya que las propias células bacterianas se aglutinan. Una estrategia similar se usa más comúnmente hoy en día al identificar serovares de bacterias y virus; sin embargo, para mejorar la visualización de la aglutinación, los anticuerpos pueden unirse a perlas de látex inertes. Esta técnica se denomina ensayo de aglutinación indirecta (o ensayo de fijación de látex), debido a que la aglutinación de las perlas es un marcador de unión de anticuerpos a algún otro antígeno (Figura\(\PageIndex{2}\)). Se pueden usar ensayos indirectos para detectar la presencia de anticuerpos o antígenos específicos.
Para identificar anticuerpos en el suero de un paciente, el antígeno de interés se une a perlas de látex. Cuando se mezclan con suero del paciente, los anticuerpos se unirán al antígeno, reticulando las perlas de látex y provocando que las perlas se aglutinen indirectamente; esto indica la presencia del anticuerpo (Figura\(\PageIndex{3}\)). Esta técnica es la más utilizada cuando se buscan anticuerpos IgM, ya que su estructura proporciona la máxima reticulación. Un ejemplo ampliamente utilizado de este ensayo es una prueba de factor reumatoide (RF) para confirmar un diagnóstico de artritis reumatoide. La RF es, de hecho, la presencia de anticuerpos IgM que se unen a la propia IgG del paciente. RF aglutinará perlas de látex recubiertas de IgG.
En la prueba inversa, los antígenos solubles pueden detectarse en el suero de un paciente uniendo anticuerpos específicos (comúnmente mAbs) a las perlas de látex y mezclando este complejo con el suero (Figura\(\PageIndex{3}\)).
Las pruebas de aglutinación son ampliamente utilizadas en países subdesarrollados que pueden carecer de instalaciones adecuadas para cultivar bacterias. Por ejemplo, la prueba de Widal, utilizada para el diagnóstico de fiebre tifoidea, busca la aglutinación de Salmonella enterica subespecie typhi en sueros de pacientes. La prueba de Widal es rápida, económica y útil para monitorear la extensión de un brote; sin embargo, no es tan precisa como las pruebas que implican el cultivo de la bacteria. La prueba de Wical frecuentemente produce falsos positivos en pacientes con infecciones previas con otras subespecies de Salmonella, así como falsos negativos en pacientes con hiperproteinemia o inmunodeficiencias.
Además, las pruebas de aglutinación están limitadas por el hecho de que los pacientes generalmente no producen niveles detectables de anticuerpos durante la primera semana (o más) de una infección. Se dice que un paciente ha sufrido seroconversión cuando los niveles de anticuerpos alcanzan el umbral de detección. Por lo general, la seroconversión coincide con la aparición de signos y síntomas de la enfermedad. Sin embargo, en una infección por VIH, por ejemplo, generalmente toma 3 semanas para que se produzca la seroconversión, y en algunos casos, puede tardar mucho más.
Similar a las técnicas para la prueba del anillo de precipitina y los ensayos de placa, es rutinario preparar diluciones seriadas dobles del suero del paciente y determinar el título de anticuerpo aglutinante presente. Dado que los niveles de anticuerpos cambian con el tiempo tanto en las respuestas inmunitarias primarias como secundarias, al verificar las muestras a lo largo del tiempo, se pueden detectar cambios en el título de anticuerpos. Por ejemplo, una comparación del título durante la fase aguda de una infección versus el título de la fase de convalecencia distinguirá si una infección es actual o ha ocurrido en el pasado. También es posible monitorear qué tan bien está respondiendo el sistema inmunológico del paciente al patógeno.
Mira este video que demuestra las reacciones de aglutinación con perlas de látex.
Ejercicio\(\PageIndex{1}\)
- ¿Cómo se usa la aglutinación para distinguir los serovares entre sí?
- En un ensayo de perlas de látex para probar anticuerpos en el suero de un paciente, ¿con qué se recubren las perlas?
- ¿Qué ha pasado cuando un paciente ha sido sometido a seroconversión?
Hemaglutinación
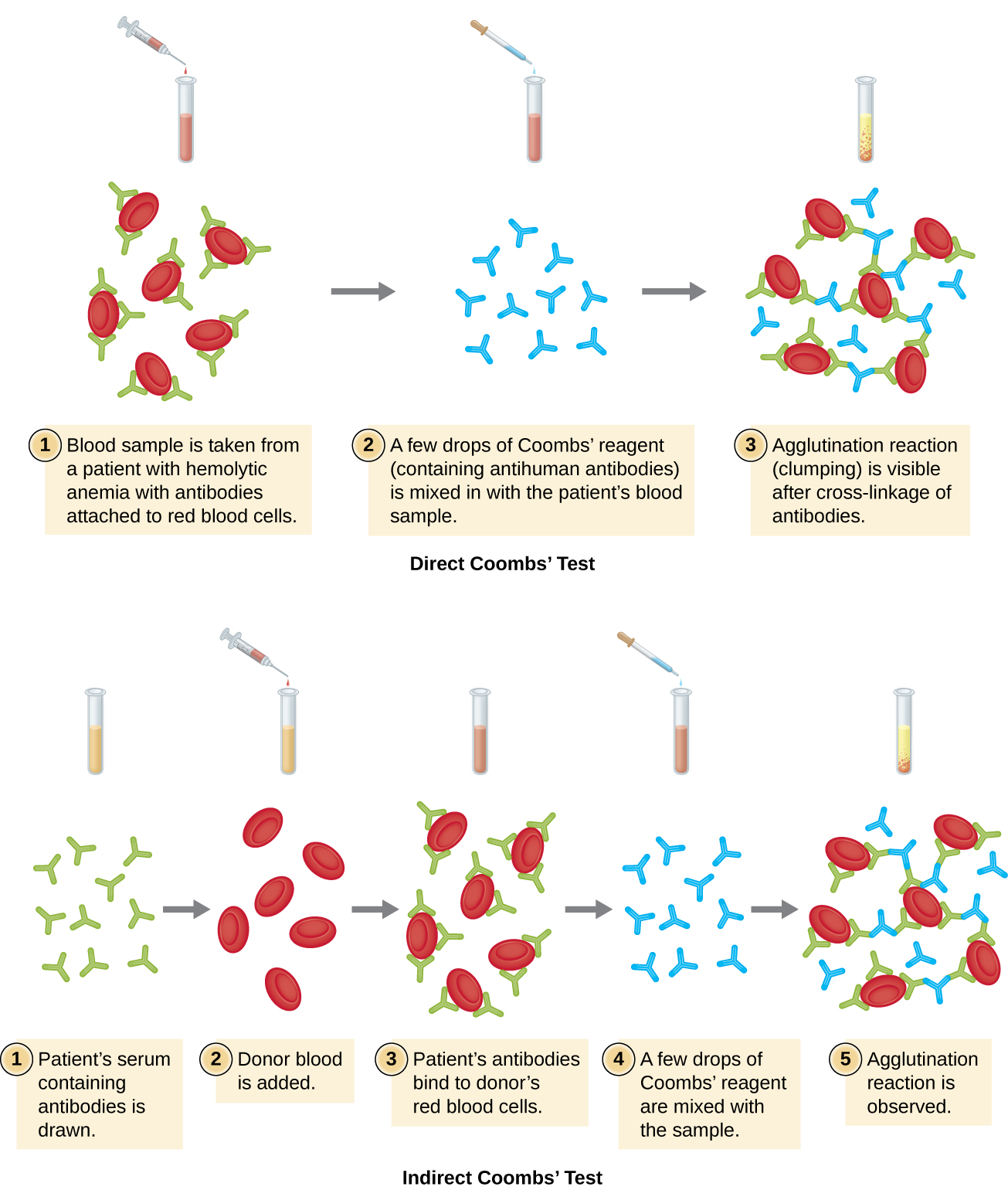
La aglutinación de los glóbulos rojos se llama hemaglutinación. Un ensayo común que utiliza la hemaglutinación es la prueba directa de Coombs, también llamada prueba directa de globulina antihumana (DAT), que generalmente busca anticuerpos no aglutinantes. La prueba también puede detectar el complemento adherido a los glóbulos rojos.
La prueba de Coombs suele emplearse cuando un recién nacido presenta ictericia, coloración amarillenta de la piel causada por altas concentraciones sanguíneas de bilirrubina, producto de la descomposición de la hemoglobina en la sangre. La prueba de Coombs se utiliza para determinar si los glóbulos rojos del niño han sido unidos por los anticuerpos de la madre. Estos anticuerpos activarían el complemento, dando lugar a la lisis de glóbulos rojos y la posterior ictericia. Otras afecciones que pueden causar pruebas de Coombs directas positivas incluyen reacciones transfusionales hemolíticas, anemia hemolítica autoinmune, mononucleosis infecciosa (causada por el virus de Epstein-Barr), sífilis y neumonía por Mycoplasma. También se puede ver una prueba de Coombs directa positiva en algunos cánceres y como una reacción alérgica a algunos medicamentos (p. ej., penicilina).
Los anticuerpos unidos a los glóbulos rojos en estas condiciones suelen ser IgG, y debido a la orientación de los sitios de unión al antígeno en IgG y al tamaño comparativamente grande de un glóbulo rojo, es poco probable que ocurra alguna aglutinación visible. Sin embargo, la presencia de IgG unida a glóbulos rojos se puede detectar añadiendo reactivo de Coombs, un antisuero que contiene anticuerpos IgG antihumanos (que pueden combinarse con anti-complemento) (Figura\(\PageIndex{4}\)). El reactivo de Coombs une la IgG unida a los glóbulos rojos vecinos y así promueve la aglutinación.
También existe una prueba indirecta de Coombs conocida como prueba indirecta de antiglobulina (IAT). Esto criba a un individuo en busca de anticuerpos contra antígenos de glóbulos rojos (distintos de los antígenos A y B) que no están unidos en el suero de un paciente (Figura\(\PageIndex{4}\)). La IAT se puede usar para examinar a mujeres embarazadas en busca de anticuerpos que puedan causar enfermedad hemolítica del recién nacido. También se puede utilizar antes de dar transfusiones de sangre. Más detalles sobre cómo se realiza el IAT se discute a continuación.
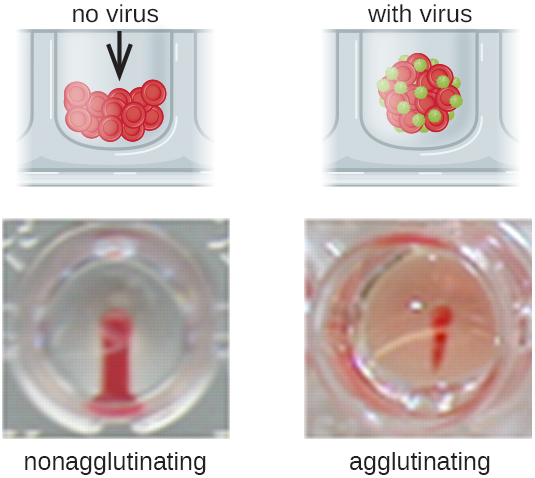
Los anticuerpos que se unen a los glóbulos rojos no son la única causa de hemaglutinación. Algunos virus también se unen a los glóbulos rojos, y esta unión puede causar aglutinación cuando los virus reticulan los glóbulos rojos. Por ejemplo, los virus de la influenza tienen dos tipos diferentes de espigas virales llamadas neuraminidasa (N) y hemaglutinina (H), esta última llamada por su capacidad para aglutinar glóbulos rojos (ver Virus). Así, podemos usar glóbulos rojos para detectar la presencia del virus de la influenza mediante ensayos de hemaglutinación directa (HA), en los que el virus provoca aglutinación visible de glóbulos rojos. Los virus de las paperas y la rubéola también se pueden detectar usando HA.
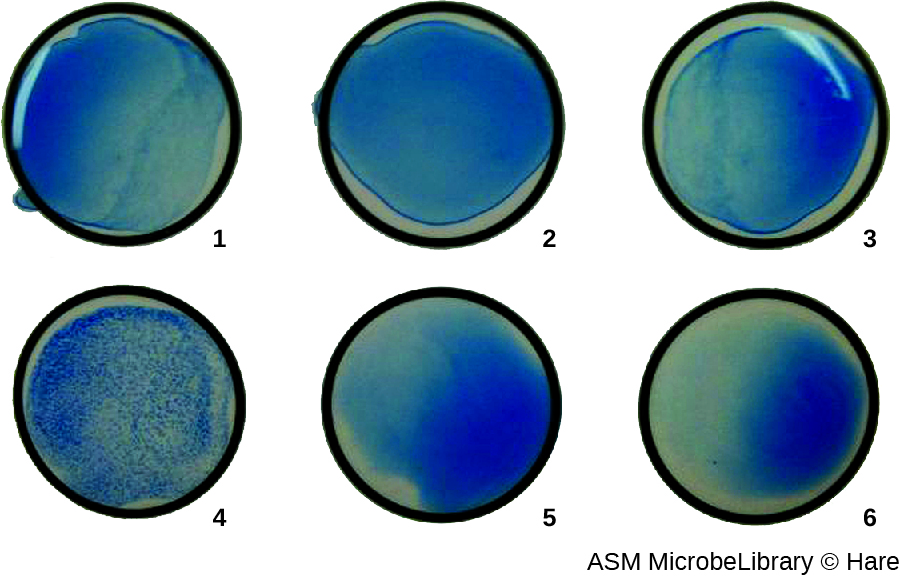
Con mayor frecuencia, se utiliza un ensayo de aglutinación viral de dilución en serie para medir el título o estimar la cantidad de virus producidos en cultivo celular o para la producción de vacunas. Se puede determinar un título viral usando un HA directo haciendo una dilución en serie de la muestra que contiene el virus, comenzando con una alta concentración de muestra que luego se diluye en una serie de pocillos. La dilución más alta que produce aglutinación visible es el título. El ensayo se realiza en una placa de microtitulación con pocillos de fondo V o redondo. En presencia de virus aglutinantes, los glóbulos rojos y el virus se agrupan y producen una estera difusa sobre el fondo del pozo. En ausencia de virus, los glóbulos rojos ruedan o sedimentan hasta el fondo del pozo y forman un sedimento denso, razón por la cual no se pueden utilizar pozos de fondo plano (Figura\(\PageIndex{5}\)).
Se puede usar una modificación del ensayo de HA para determinar el título de anticuerpos antivirales. La presencia de estos anticuerpos en el suero de un paciente o en un antisuero producido en laboratorio neutralizará al virus y le bloqueará la aglutinación de los glóbulos rojos, haciendo de éste un ensayo de inhibición de la hemaglutinación viral (HIA). En este ensayo, el suero del paciente se mezcla con una cantidad estandarizada de virus. Después de una breve incubación, se agrega una cantidad estandarizada de glóbulos rojos y se observa hemaglutinación. El título del suero del paciente es la dilución más alta que bloquea la aglutinación (Figura\(\PageIndex{6}\)).

Ejercicio\(\PageIndex{2}\)
- ¿Cuál es el mecanismo por el cual se detectan los virus en un ensayo de hemaglutinación?
- ¿Qué resultado de hemaglutinación nos dice el título de virus en una muestra?
Animales en el Laboratorio
Gran parte de lo que conocemos hoy sobre el sistema inmune humano se ha aprendido a través de investigaciones realizadas utilizando animales, principalmente, mamíferos, como modelos. Además de la investigación, los mamíferos también se utilizan para la producción de la mayoría de los anticuerpos y otros componentes del sistema inmune necesarios para el inmunodiagnóstico. Vacunas, diagnósticos, terapias y medicina traslacional en general se han desarrollado a través de la investigación con modelos animales.
Considere algunos de los usos comunes de los animales de laboratorio para producir componentes del sistema inmune. Los cobayas se utilizan como fuente de complemento, y los ratones son la principal fuente de células para hacer mAbs. Estos mAbs pueden ser utilizados en investigación y con fines terapéuticos. Los antisueros se crían en una variedad de especies, incluyendo caballos, ovejas, cabras y conejos. Cuando se produce un antisuero, el animal normalmente se inyectará al menos dos veces, y se pueden usar adyuvantes para reforzar la respuesta de anticuerpos. Los animales más grandes utilizados para elaborar antisueros tendrán sangre recolectada repetidamente durante largos periodos de tiempo, con poco daño a los animales, pero ese no suele ser el caso de los conejos. Si bien podemos obtener unos mililitros de sangre de las venas de las orejas de los conejos, generalmente necesitamos volúmenes mayores, lo que resulta en la muerte de los animales.
También utilizamos animales para el estudio de enfermedades. La única forma de cultivar Treponema pallidum para el estudio de la sífilis es en animales vivos. Muchos virus se pueden cultivar en cultivo celular, pero el crecimiento en cultivo celular nos dice muy poco sobre cómo responderá el sistema inmune al virus. Al trabajar en una enfermedad recién descubierta, seguimos empleando postulados de Koch, que requieren causar enfermedades en animales de laboratorio utilizando patógenos de cultivo puro como paso crucial para demostrar que un microorganismo en particular es la causa de una enfermedad. Estudiar la proliferación de bacterias y virus en hospedadores animales, y cómo responde el sistema inmune del huésped, ha sido fundamental para la investigación microbiológica durante más de 100 años.
Si bien la práctica de usar animales de laboratorio es esencial para la investigación científica y el diagnóstico médico, muchas personas se oponen fuertemente a la explotación de animales para beneficio humano. Este argumento ético no es nuevo, de hecho, una de las hijas de Charles Darwin era una activa antiviviseccionista (la vivisección es la práctica de cortar o diseccionar un animal vivo para estudiarlo). La mayoría de los científicos reconocen que debe haber límites en la medida en que los animales pueden ser explotados con fines de investigación. Consideraciones éticas han llevado a los Institutos Nacionales de Salud (NIH) a desarrollar regulaciones estrictas sobre los tipos de investigación que se pueden realizar. Estas regulaciones también incluyen pautas para el tratamiento humano de los animales de laboratorio, estableciendo estándares para su alojamiento, cuidado y eutanasia. El documento del NIH “Guía para el Cuidado y Uso de Animales de Laboratorio” deja claro que el uso de animales en la investigación es un privilegio otorgado por la sociedad a los investigadores.
Los lineamientos de los NIH se basan en el principio de las tres R: reemplazar, refinar y reducir. Los investigadores deben esforzarse por reemplazar modelos animales por modelos no vivos, reemplazar vertebrados por invertebrados siempre que sea posible, o usar modelos por computadora cuando corresponda. Deben refinar los procedimientos de cría y experimentación para reducir el dolor y el sufrimiento, y utilizar diseños y procedimientos experimentales que reduzcan el número de animales necesarios para obtener la información deseada. Para obtener financiamiento, los investigadores deben satisfacer a los revisores de los NIH que la investigación justifica el uso de animales y que su uso está de acuerdo con los lineamientos.
A nivel local, cualquier instalación que utilice animales y reciba financiamiento federal debe contar con un Comité Institucional de Cuidado y Uso de Animales (IACUC) que asegure que se sigan los lineamientos de los NIH. El IACUC debe incluir investigadores, administradores, un veterinario, y al menos una persona sin vinculación con la institución, es decir, un ciudadano preocupado. Este comité también realiza inspecciones de laboratorios y protocolos. Para investigaciones que involucren a sujetos humanos, un Consejo de Revisión Institucional (IRB) asegura que se sigan las pautas adecuadas.
Visite este sitio para ver la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio.
Tipificación de sangre y coincidencia cruzada
Además de los anticuerpos contra bacterias y virus a los que han estado expuestos previamente, la mayoría de los individuos también portan anticuerpos contra tipos de sangre distintos al suyo. Actualmente existen 33 sistemas de tipo sanguíneo de importancia inmunológica, muchos de los cuales están restringidos dentro de diversos grupos étnicos o raramente dan como resultado la producción de anticuerpos. Los más importantes y quizás más conocidos son los grupos sanguíneos ABO y Rh (ver Figura 19.1.3).
Cuando se están considerando unidades de sangre para transfusión, se deben realizar análisis de sangre pretransfusión. Para la unidad de sangre, los anticuerpos preparados comercialmente contra los antígenos A, B y Rh se mezclan con glóbulos rojos de las unidades para confirmar inicialmente que el tipo de sangre en la unidad es exacto. Una vez que se ha solicitado una unidad de sangre para transfusión, es de vital importancia asegurarse de que el donante (unidad de sangre) y el receptor (paciente) sean compatibles con estos antígenos cruciales. Además de confirmar el tipo de sangre de la unidad, también se confirma el tipo de sangre del paciente utilizando los mismos anticuerpos preparados comercialmente contra A, B y Rh. Por ejemplo, como se muestra en la Figura\(\PageIndex{7}\), si la sangre del donante es A-positiva, se aglutinará con el antisuero anti-A y con el antisuero anti-RH. Si no se observa aglutinación con ninguno de los sueros, entonces el tipo de sangre sería O-negativo.
Después de determinar el tipo de sangre, inmediatamente antes de liberar la sangre para transfusión, se realiza una coincidencia cruzada en la que se mezcla una pequeña alícuota de los glóbulos rojos del donante con suero del paciente en espera de transfusión. Si el paciente sí tiene anticuerpos contra los glóbulos rojos del donante, se producirá la hemaglutinación. Para confirmar los resultados negativos de las pruebas y verificar si hay glóbulos rojos sensibilizados, se puede agregar reactivo de Coombs a la mezcla para facilitar la visualización de la interacción anticuerpo-glóbulos rojos.
Bajo algunas circunstancias, también se puede realizar un cruce menor. En este ensayo, se mezcla una pequeña alícuota de suero donante con glóbulos rojos del paciente. Esto permite la detección de anticuerpos aglutinantes en el suero donante. Esta prueba rara vez es necesaria porque las transfusiones generalmente usan glóbulos rojos empaquetados con la mayor parte del plasma eliminado por centrifugación.
Los glóbulos rojos tienen muchos otros antígenos además de ABO y Rh. Si bien es poco probable que la mayoría de las personas tengan anticuerpos contra estos antígenos, las mujeres que han tenido embarazos múltiples o las pacientes que han tenido múltiples transfusiones pueden tenerlos debido a la exposición repetida. Por esta razón, se utiliza una prueba de detección de anticuerpos para determinar si dichos anticuerpos están presentes. El suero del paciente se verifica contra glóbulos rojos tipo O preparados comercialmente, agrupados, que expresan estos antígenos. Si se produce aglutinación, el antígeno al que responde el paciente debe ser identificado y determinado que no está presente en la unidad donante.

Ejercicio\(\PageIndex{3}\)
- Si la sangre de un paciente se aglutina con suero anti-B, ¿cuál es el tipo de sangre del paciente?
- ¿Qué es un ensayo de coincidencia cruzada y por qué se realiza?
La tabla\(\PageIndex{1}\) resume los diversos tipos de ensayos de aglutinación discutidos en esta sección.
| Tipo de ensayo | Mecanismo | Ejemplo |
|---|---|---|
| Aglutinación | Directo: El anticuerpo se usa para agrupar células bacterianas u otras estructuras grandes | Serotipificación de bacterias |
| Indirecto: Las perlas de látex se acoplan con antígeno o anticuerpo para buscar anticuerpos o antígenos, respectivamente, en el suero del paciente | Confirmando la presencia de factor reumatoide (Ig de unión a IgM) en suero de pacientes | |
| Hemaglutinación | Directo: Algunas bacterias y virus reticulan los glóbulos rojos y los agrupan | Diagnóstico de influenza, paperas y sarampión |
| Prueba directa de Coombs (DAT): Detecta anticuerpos no aglutinantes o proteínas del complemento en glóbulos rojos in vivo | Comprobación de anticuerpos maternos que se unen a glóbulos rojos neonatales | |
| Prueba indirecta de Coombs (IAT): examina a un individuo para detectar anticuerpos contra antígenos de glóbulos rojos (distintos de los antígenos A y B) que no están unidos en el suero de un paciente in vitro | Realización de análisis de sangre pretransfusión | |
| Inhibición de la hemaglutinación viral: Utiliza anticuerpos de un paciente para inhibir la aglutinación viral | Diagnóstico de diversas enfermedades virales por la presencia de anticuerpos del paciente contra el virus | |
| Tipificación sanguínea y coincidencia cruzada: Detecta ABO, Rh y antígenos menores en la sangre | Hace coincidir la sangre del donante con los requisitos inmunológicos |
Conceptos clave y resumen
- Los anticuerpos pueden aglutinar células o partículas grandes en una matriz visible. Las pruebas de aglutinación a menudo se realizan en tarjetas o en placas de microtitulación que permiten que se produzcan múltiples reacciones una al lado de la otra usando pequeños volúmenes de reactivos.
- El uso de antisueros contra ciertas proteínas permite la identificación de serovares dentro de especies de bacterias.
- Detectar anticuerpos contra un patógeno puede ser una herramienta poderosa para diagnosticar enfermedades, pero hay un período de tiempo antes de que los pacientes pasen por seroconversión y el nivel de anticuerpos sea detectable.
- La aglutinación de perlas de látex en ensayos de aglutinación indirecta puede usarse para detectar la presencia de antígenos específicos o anticuerpos específicos en el suero del paciente.
- La presencia de algunos anticuerpos antibacterianos y antivirales puede confirmarse mediante el uso de la prueba directa de Coombs, que utiliza el reactivo de Coombs para reticular anticuerpos unidos a glóbulos rojos y facilitar la hemaglutinación.
- Algunos virus y bacterias se unirán y aglutinarán los glóbulos rojos; esta interacción es la base del ensayo de hemaglutinación directa, más utilizado para determinar el título de virus en solución.
- Los ensayos de neutralización cuantifican el nivel de anticuerpos específicos de virus midiendo la disminución en la hemaglutinación observada después de mezclar el suero del paciente con una cantidad estandarizada de virus.
- Los ensayos de hemaglutinación también se utilizan para seleccionar y hacer coincidir la sangre de donantes y receptores para garantizar que el receptor de la transfusión no tenga anticuerpos contra antígenos en la sangre donada.
Notas al pie
- 1 Lancefield, Rebecca C., “El Complejo Antigénico de Streptococcus haemoliticus. I. Demostración de una Sustancia Tipo Específico en Extractos de Streptococcus haemolyticus,” The Journal of Experimental Medicine 47, núm. 1 (1928): 91-103.


