20.4: Inmunoensayos enzimáticos (EIA) y ensayos inmunoabsorbentes ligados a enzimas (ELISA)
- Page ID
- 54794
Objetivos de aprendizaje
- Explicar las diferencias y similitudes entre EIA, FEIA y ELISA
- Describir la diferencia y similitudes entre inmunohistoquímica e inmunocitoquímica
- Describir los diferentes propósitos del ELISA directo e indirecto
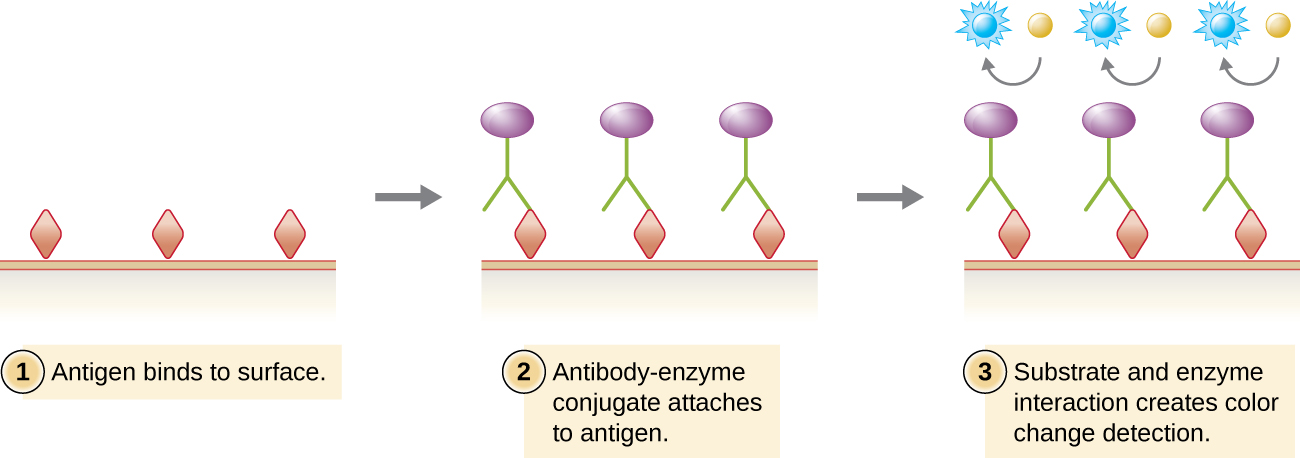
Similar a la transferencia Western, los inmunoensayos enzimáticos (EIA) utilizan anticuerpos para detectar la presencia de antígenos. Sin embargo, los EIA difieren de los Western blots en que los ensayos se llevan a cabo en placas de microtitulación o in vivo en lugar de en una membrana absorbente. Existen muchos tipos diferentes de EIA, pero todos implican una molécula de anticuerpo cuya región constante se une a una enzima, dejando la región variable libre para unirse a su antígeno específico. La adición de un sustrato para la enzima permite visualizar o cuantificar el antígeno (Figura\(\PageIndex{1}\)).
En los EIA, el sustrato para la enzima suele ser un cromógeno, una molécula incolora que se convierte en un producto final coloreado. Las enzimas más utilizadas son la fosfatasa alcalina y la peroxidasa de rábano picante para las que se encuentran fácilmente disponibles sustratos apropiados. En algunos EIA, el sustrato es un fluorógeno, una molécula no fluorescente que la enzima convierte en una forma fluorescente. Los EIA que utilizan un fluorógeno se denominan inmunoensayos enzimáticos fluorescentes (FIA). La fluorescencia se puede detectar mediante un microscopio de fluorescencia o un espectrofotómetro.
El título de MMR
La vacuna MMR es una vacuna combinada que brinda protección contra el sarampión, las paperas y la rubéola (sarampión alemán). La mayoría de las personas reciben la vacuna MMR cuando son niños y por lo tanto tienen anticuerpos contra estas enfermedades. Sin embargo, por diversas razones, incluso los individuos vacunados pueden volverse susceptibles a estas enfermedades nuevamente más adelante en la vida. Por ejemplo, algunos niños pueden recibir solo una ronda de la vacuna MMR en lugar de las dos recomendadas. Además, el título de anticuerpos protectores en el cuerpo de un individuo puede comenzar a disminuir con la edad o como resultado de algunas afecciones médicas.
Para determinar si el título de anticuerpos en el torrente sanguíneo de un individuo es suficiente para proporcionar protección, se puede realizar una prueba de título de MMR. La prueba es un inmunoensayo sencillo que se puede hacer rápidamente con una muestra de sangre. Los resultados de la prueba indicarán si el individuo aún tiene inmunidad o necesita otra dosis de la vacuna MMR.
Someter a un título de MMR es a menudo un requisito previo al empleo para los trabajadores de la salud, especialmente aquellos que frecuentemente estarán en contacto con niños pequeños o pacientes inmunodeprimidos. Si un trabajador de la salud se infectara con sarampión, paperas o rubéola, el individuo podría transmitir fácilmente estas enfermedades a pacientes susceptibles, dando lugar a un brote. Dependiendo de los resultados del título de MMR, los trabajadores de la salud podrían necesitar ser revacunados antes de comenzar a trabajar.
Inmunotinción
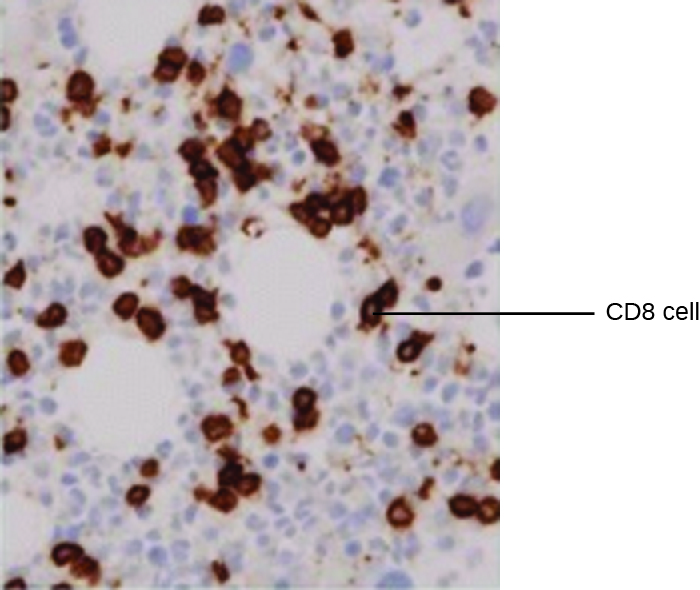
Un uso poderoso de EIA es la inmunotinción, en la que los conjugados anticuerpo-enzima mejoran la microscopía. La inmunohistoquímica (IHC) se utiliza para examinar tejidos enteros. Como se ve en la Figura\(\PageIndex{2}\), se puede teñir una sección de tejido para visualizar los diversos tipos de células. En este ejemplo, se utilizó un mAB contra CD8 para teñir células CD8 en una sección de tejido de amígdalas. Ahora es posible contar el número de células CD8, determinar sus números relativos frente a los otros tipos de células presentes y determinar la ubicación de estas células dentro de este tejido. Dichos datos serían útiles para estudiar enfermedades como el SIDA, en las que la función normal de las células CD8 es crucial para ralentizar la progresión de la enfermedad.
La inmunocitoquímica (ICC) es otra forma valiosa de inmunotinción. Si bien es similar a la IHC, en ICC, el material de la matriz extracelular se elimina y la membrana celular se graba con alcohol para hacerla permeable a los anticuerpos. Esto permite que los anticuerpos pasen a través de la membrana celular y se unan a dianas específicas dentro de la célula. Los orgánulos, los componentes citoesqueléticos y otras estructuras intracelulares se pueden visualizar de esta manera. Mientras que algunas técnicas ICC utilizan EIA, la enzima puede ser reemplazada por una molécula fluorescente, convirtiéndola en un inmunoensayo fluorescente.
Ejercicio\(\PageIndex{1}\)
- ¿Cuál es la diferencia entre inmunohistoquímica e inmunocitoquímica?
- ¿Qué debe ser cierto del producto de la reacción enzimática utilizada en inmunohistoquímica?
Ensayos Inmunosorbentes Enzimados (ELISA)
Los ensayos inmunoabsorbentes ligados a enzimas (ELISA) son EIA ampliamente utilizados. En el ELISA directo, los antígenos se inmovilizan en el pocillo de una placa de microtitulación. A cada pocillo se le agrega un anticuerpo que es específico para un antígeno particular y se conjuga con una enzima. Si el antígeno está presente, entonces el anticuerpo se unirá. Después del lavado para eliminar cualquier anticuerpo no unido, se agrega un sustrato incoloro (cromógeno). La presencia de la enzima convierte el sustrato en un producto final coloreado (Figura\(\PageIndex{1}\)). Si bien esta técnica es más rápida porque solo requiere el uso de un anticuerpo, tiene la desventaja de que la señal de un ELISA directo es menor (menor sensibilidad).
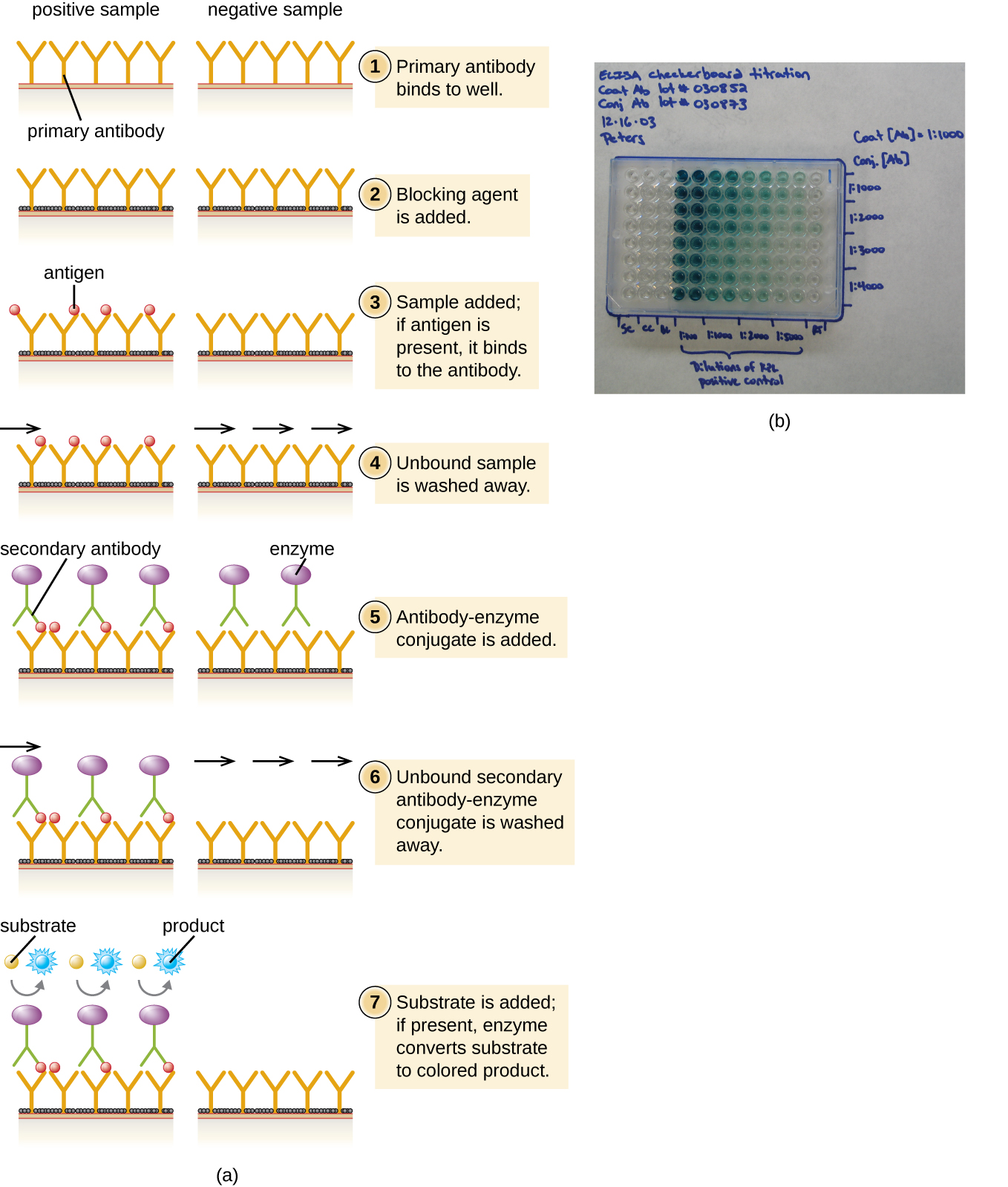
En un ELISA sándwich, el objetivo es usar anticuerpos para cuantificar con precisión antígeno específico presente en una solución, como antígeno de un patógeno, una proteína sérica, o una hormona de la sangre u orina para enumerar solo algunos ejemplos. El primer paso de un ELISA sándwich es agregar el anticuerpo primario a todos los pocillos de una placa de microtitulación (Figura\(\PageIndex{3}\)). El anticuerpo se adhiere al plástico por interacciones hidrofóbicas. Después de un tiempo de incubación apropiado, cualquier anticuerpo no unido se elimina por lavado. Se utilizan lavados comparables entre cada una de las etapas posteriores para asegurar que solo las moléculas unidas específicamente permanezcan unidas a la placa. Luego se añade una proteína bloqueante (por ejemplo, albúmina o la caseína de proteína láctea) para unirse a los sitios de unión a proteínas inespecíficos restantes en el pocillo. Algunos de los pocillos recibirán cantidades conocidas de antígeno para permitir la construcción de una curva estándar, y se agregan soluciones de antígeno desconocidas a los otros pocillos. El anticuerpo primario captura el antígeno y, después de un lavado, se agrega el anticuerpo secundario, que es un anticuerpo policlonal que se conjuga con una enzima. Después de un lavado final, se agrega un sustrato incoloro (cromógeno), y la enzima lo convierte en un producto final coloreado. La intensidad de color de la muestra causada por el producto final se mide con un espectrofotómetro. La cantidad de color producida (medida como absorbancia) es directamente proporcional a la cantidad de enzima, que a su vez es directamente proporcional al antígeno capturado. Los ELISA son extremadamente sensibles, lo que permite cuantificar el antígeno en el rango de nanogramos (10 —9 g) por mL.
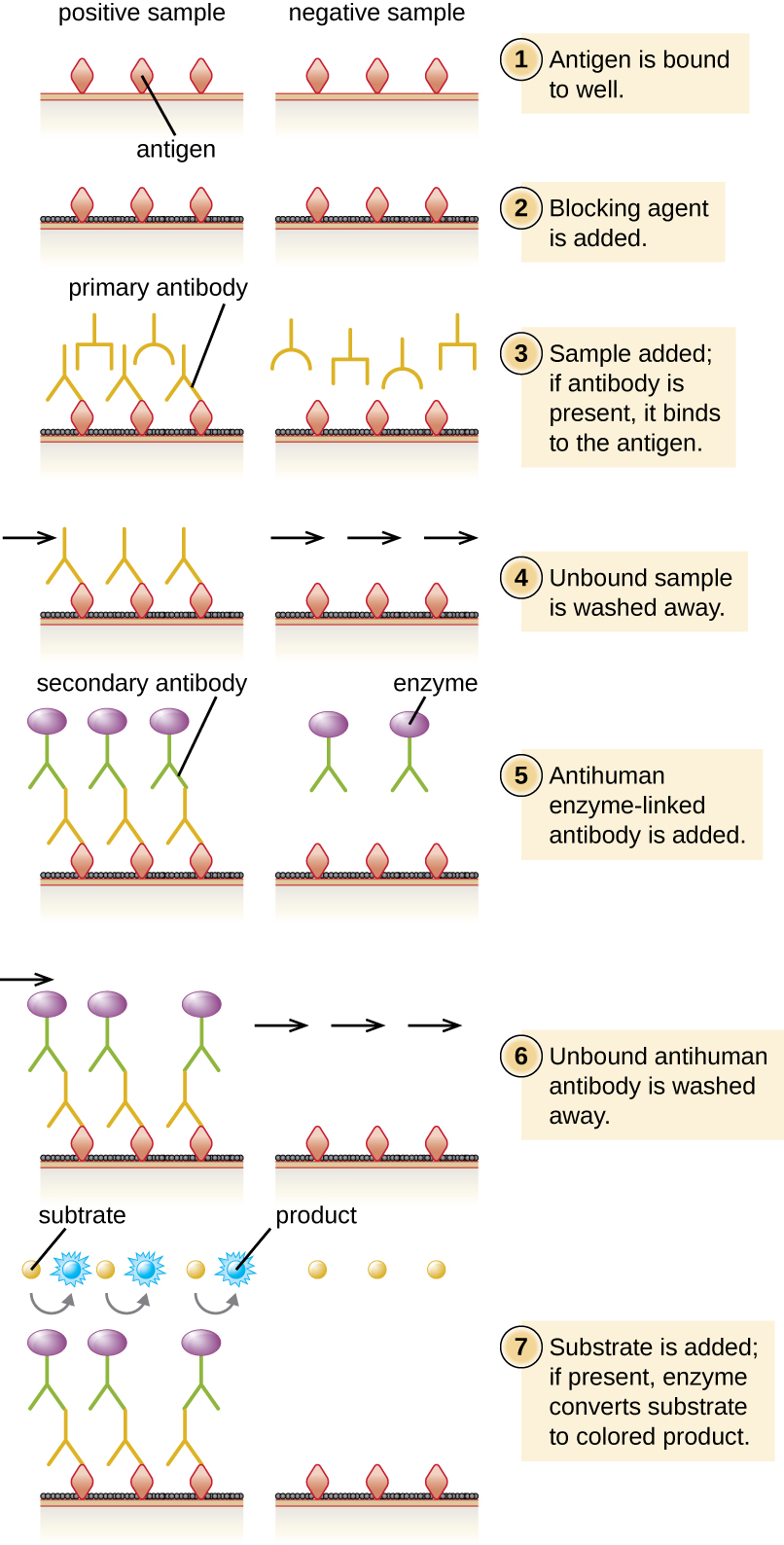
En un ELISA indirecto, cuantificamos anticuerpos específicos de antígeno en lugar de antígeno. Podemos usar ELISA indirecto para detectar anticuerpos contra muchos tipos de patógenos, entre ellos Borrelia burgdorferi (enfermedad de Lyme) y VIH. Hay tres diferencias importantes entre los ELISAs indirectos y directos como se muestra en la Figura\(\PageIndex{4}\). En lugar de usar anticuerpos para capturar antígeno, el ELISA indirecto comienza con la unión del antígeno conocido (por ejemplo, péptidos del VIH) al fondo de los pocillos de la placa de microtitulación. Después de bloquear los sitios no unidos en la placa, se agrega suero del paciente; si hay anticuerpos presentes (anticuerpo primario), se unirán al antígeno. Después de lavar cualquier proteína no unida, el anticuerpo secundario con su enzima conjugada se dirige contra el anticuerpo primario (por ejemplo, inmunoglobulina antihumana). El anticuerpo secundario nos permite cuantificar la cantidad de anticuerpos específicos de antígeno que está presente en el suero del paciente por la intensidad del color producido por la reacción conjugada enzima-cromógeno.
Al igual que con varias otras pruebas de anticuerpos discutidas en este capítulo, siempre existe preocupación por la reactividad cruzada con anticuerpos dirigidos contra algún otro antígeno, lo que puede conducir a resultados falsos positivos. Por lo tanto, no podemos diagnosticar definitivamente una infección por VIH (o cualquier otro tipo de infección) con base en un único ensayo ELISA indirecto. Debemos confirmar cualquier prueba sospechosa de positivo, que se realiza con mayor frecuencia ya sea mediante una inmunotransferencia que realmente identifique la presencia de péptidos específicos del patógeno o una prueba para identificar los ácidos nucleicos asociados con el patógeno, como la PCR de transcriptasa inversa (RT-PCR) o un antígeno de ácido nucleico prueba.
Ejercicio\(\PageIndex{2}\)
- ¿Cuál es el propósito del anticuerpo secundario en un ELISA directo?
- ¿Qué cuantifican los ELISA directos e indirectos?
Enfoque Clínico: Parte 2
Si bien contactar y probar el VIH a los 1300 pacientes sería costoso y costoso, los administradores esperaban minimizar la responsabilidad del hospital buscando y tratando proactivamente a las víctimas potenciales del delito del empleado pícaro. La detección temprana del VIH es importante, y el tratamiento rápido puede ralentizar la progresión de la enfermedad.
Hay una variedad de pruebas de tamizaje para el VIH, pero la más utilizada es la ELISA indirecta. Al igual que con otros ELISA indirectos, la prueba funciona uniendo antígeno (en este caso, péptidos VIH) a un pocillo en una placa de 96 pocillos. Si el paciente es VIH positivo, los anticuerpos anti-VIH se unirán al antígeno y serán identificados por el segundo conjugado anticuerpo-enzima.
Ejercicio\(\PageIndex{3}\)
- ¿Qué tan precisa es una prueba ELISA indirecta para el VIH y qué factores podrían afectar la precisión de la prueba?
- ¿Debe el hospital utilizar alguna otra prueba para confirmar los resultados del ELISA indirecto?
Inmunofiltración y Ensayos Inmunocromatográficos
Para algunas situaciones, puede ser necesario detectar o cuantificar antígenos o anticuerpos que están presentes a muy baja concentración en solución. Se han desarrollado técnicas de inmunofiltración para que esto sea posible. En la inmunofiltración, se pasa un gran volumen de fluido a través de una membrana porosa hacia una almohadilla absorbente. Un antígeno unido a la membrana porosa capturará el anticuerpo a medida que pasa; alternativamente, también podemos unir un anticuerpo a la membrana para capturar el antígeno.
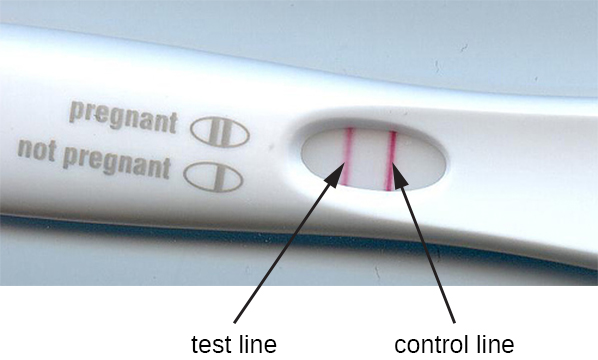
El método de inmunofiltración se ha adaptado en el desarrollo de ensayos inmunocromatográficos, comúnmente conocidos como pruebas de flujo lateral o pruebas de tira. Estas pruebas son rápidas y fáciles de realizar, lo que las hace populares para su uso en el punto de atención (es decir, en el consultorio del médico) o en el hogar. Un ejemplo es la prueba TORCH que permite a los médicos examinar a mujeres embarazadas o recién nacidos para detectar infecciones por una serie de virus y otros patógenos (Toxoplasma, otros virus, rubéola, citomegalovirus, herpes simple). Las pruebas de embarazo en el hogar son otro ejemplo ampliamente utilizado de una prueba de flujo lateral (Figura\(\PageIndex{5}\)). Las pruebas de inmunofiltración también son populares en los países en desarrollo, ya que son económicas y no requieren refrigeración constante de los reactivos secos. Sin embargo, la tecnología también está integrada en algunos sofisticados equipos de laboratorio.
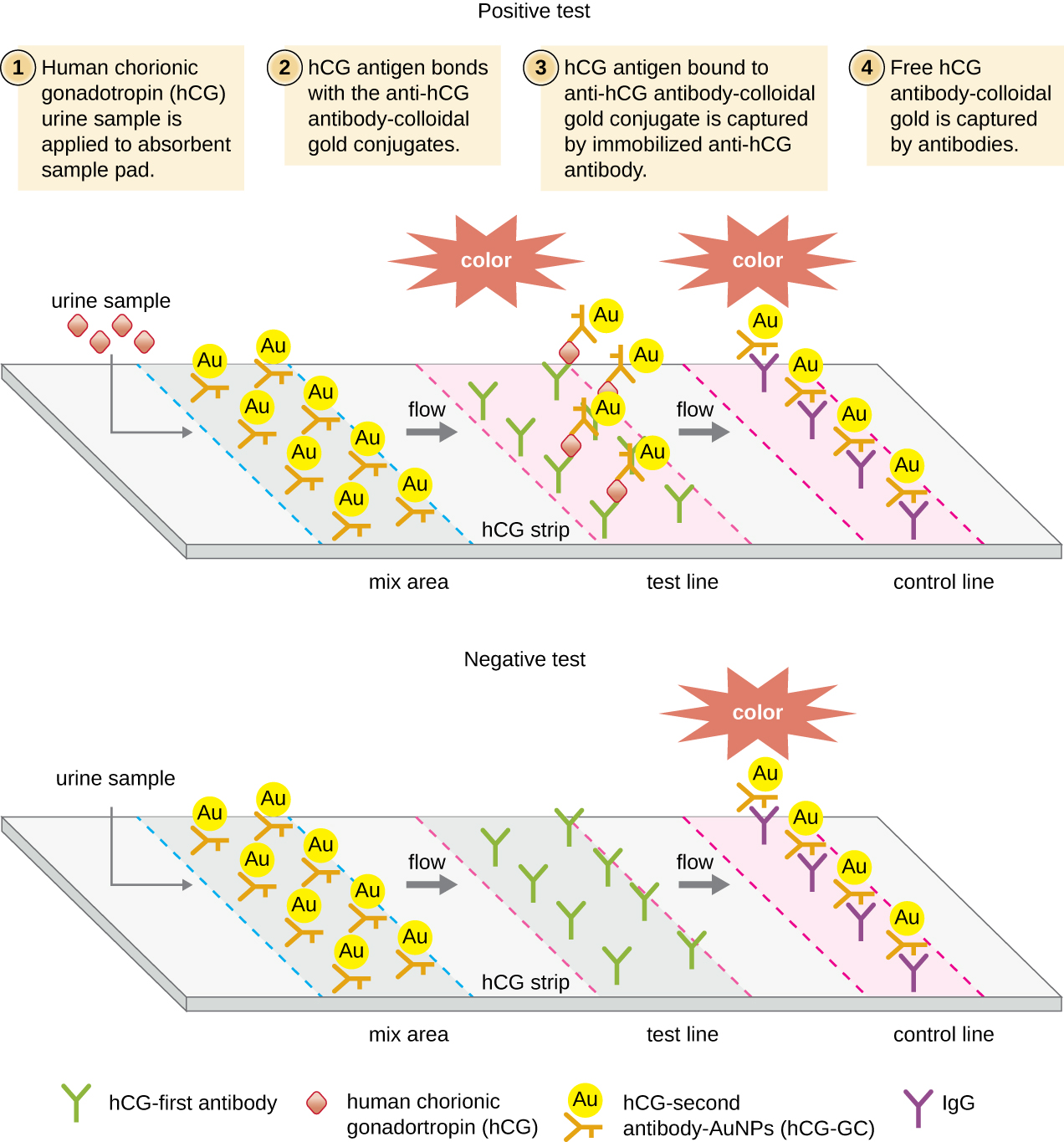
En las pruebas de flujo lateral (Figura\(\PageIndex{6}\)), los fluidos como la orina se aplican a una almohadilla absorbente en la tira reactiva. El fluido fluye por acción capilar y se mueve a través de una franja de perlas con anticuerpos unidos a sus superficies. El fluido en la muestra realmente hidrata los reactivos, los cuales están presentes en estado seco en la franja. Las perlas recubiertas de anticuerpos hechas de látex o diminutas partículas de oro se unirán a los antígenos en el líquido de prueba. Los complejos anticuerpo-antígeno fluyen luego sobre una segunda banda que tiene anticuerpo inmovilizado contra el antígeno; esta banda retendrá las perlas que tienen antígeno unido. Una tercera banda de control se une a cualquier bolita. Un color rojo (de partículas de oro) o azul (de perlas de látex) que se desarrolla en la línea de prueba indica una prueba positiva. Si el color solo se desarrolla en la línea de control, la prueba es negativa.
Al igual que las técnicas ELISA, las pruebas de flujo lateral aprovechan los sándwiches de anticuerpos, aportando sensibilidad y especificidad. Si bien no son tan cuantitativas como el ELISA, estas pruebas tienen la ventaja de ser rápidas, económicas y no dependientes de equipos especiales. Así, pueden ser realizadas en cualquier lugar por cualquier persona. Hay algunas preocupaciones sobre poner pruebas diagnósticas tan poderosas en manos de personas que tal vez no comprendan las limitaciones de las pruebas, como la posibilidad de resultados falsos positivos. Si bien las pruebas de embarazo caseras han llegado a ser ampliamente aceptadas, las pruebas de detección de anticuerpos en el hogar para enfermedades como el VIH han generado algunas preocupaciones en la comunidad médica. Algunos han cuestionado si se debe permitir la autoadministración de tales pruebas en ausencia de personal médico que pueda explicar los resultados de las pruebas y ordenar pruebas confirmatorias adecuadas. Sin embargo, con el creciente número de pruebas de flujo lateral disponibles y el rápido desarrollo de la tecnología de laboratorio en un chip (Figura 20.1), es probable que las pruebas médicas en el hogar se vuelvan aún más comunes en el futuro.
Ejercicio\(\PageIndex{4}\)
- ¿Qué proceso físico requiere el método de flujo lateral para funcionar?
- Explicar el propósito de la tercera tira en un ensayo de flujo lateral.
En la tabla\(\PageIndex{1}\) se comparan algunos de los mecanismos clave y ejemplos de algunos de los EIA discutidos en esta sección así como de inmunotransferencia, los cuales fueron discutidos en Detección de Complejos Antigeno-Anticuerpo.
| Tipo de ensayo | Mecanismo | Procedimientos Específicos | Ejemplos |
|---|---|---|---|
| Inmunotransferencia | Utiliza conjugados enzima-anticuerpo para identificar proteínas específicas que han sido transferidas a una membrana absorbente | Western blot: Detecta la presencia de una proteína particular | Detección de la presencia de péptidos del VIH (o péptidos de otros agentes infecciosos) en sueros de pacientes |
| Inmunotinción | Utiliza conjugados enzima-anticuerpo para teñir moléculas específicas sobre o en células | Inmunohistoquímica: Se utiliza para teñir células específicas en un tejido | Tinción para la presencia de células CD8 en tejido huésped |
| Ensayo inmunoabsorbente ligado a enzimas (ELISA) | Utiliza conjugados enzima-anticuerpo para cuantificar moléculas diana | ELISA directo: Utiliza un solo anticuerpo para detectar la presencia de un antígeno | Detección del antígeno VIH p24 hasta un mes después de haber sido infectado |
| ELISA indirecto: mide la cantidad de anticuerpo producido contra un antígeno | Detección de anticuerpos contra el VIH en suero | ||
| Ensayos inmunocromatográficos (flujo lateral) | Las técnicas utilizan la captura de complejos fluyentes de antígeno-anticuerpo marcados con color mediante anticuerpos fijos para el diagnóstico de enfermedades | ELISA tipo sándwich: mide la cantidad de antígeno unido por el anticuerpo | Detección de anticuerpos para diversos patógenos en sueros de pacientes (por ejemplo, estreptococo rápido, varilla reactiva de malaria) |
| Prueba de embarazo que detecta gonadotropina coriónica humana en orina |
Enfoque Clínico: Parte 3
Aunque el ELISA indirecto para el VIH es un ensayo sensible, existen varias consideraciones que complican. Primero, si una persona infectada se hace la prueba demasiado pronto después de infectarse, la prueba puede arrojar resultados falsos negativos. La ventana de seroconversión es generalmente de aproximadamente tres semanas, pero en algunos casos, puede ser de más de dos meses.
Además de los falsos negativos, también pueden ocurrir falsos positivos, generalmente debido a infecciones previas con otros virus que inducen anticuerpos de reacción cruzada. La tasa de falsos positivos depende de la marca particular de prueba utilizada, pero 0.5% no es inusual. 1 Debido a la posibilidad de un falso positivo, todas las pruebas positivas son seguidas con una prueba confirmatoria. Esta prueba confirmatoria suele ser una inmunotransferencia (Western Blot) en la que los péptidos del VIH de la sangre del paciente se identifican mediante un conjugado mAb-enzima específico del VIH. Una transferencia Western positiva confirmaría una infección por VIH y una transferencia negativa confirmaría la ausencia de VIH a pesar del ELISA positivo.
Desafortunadamente, las manchas Western para antígenos del VIH a menudo producen resultados indeterminantes, en cuyo caso, no confirman ni invalidan los resultados del ELISA indirecto. De hecho, la tasa de indeterminantes puede ser del 10— 49% (razón por la cual, combinado con su costo, las manchas western no se utilizan para el cribado). Similar al ELISA indirecto, una transferencia Western indeterminante puede ocurrir debido a reactividad cruzada o infecciones virales previas, vacunas o enfermedades autoinmunes.
Ejercicio\(\PageIndex{5}\)
- De los 1300 pacientes que se están probando, ¿cuántos falsos positivos se esperarían pruebas ELISA?
- De los falsos positivos, ¿cuántas manchas occidentales indeterminantes podrían esperarse?
- ¿Cómo abordaría el hospital cualquier caso en el que la transferencia western de un paciente fuera indeterminante?
Conceptos clave y resumen
- Se utilizan inmunoensayos enzimáticos (EIA) para visualizar y cuantificar antígenos. Utilizan un anticuerpo conjugado con una enzima para unirse al antígeno, y la enzima convierte un sustrato en un producto final observable. El sustrato puede ser un cromógeno o un fluorógeno.
- La inmunotinción es una técnica de EIA para visualizar células en un tejido (inmunohistoquímica) o examinar estructuras intracelulares (inmunocitoquímica).
- Se utiliza ELISA directo para cuantificar un antígeno en solución. El anticuerpo primario captura el antígeno y el anticuerpo secundario suministra una enzima. La producción del producto final a partir del sustrato cromogénico es directamente proporcional a la cantidad de antígeno capturado.
- El ELISA indirecto se utiliza para detectar anticuerpos en el suero del paciente mediante la unión del antígeno al pocillo de una placa de microtitulación, permitiendo que el anticuerpo del paciente (primario) se una al antígeno y un anticuerpo secundario conjugado con enzima para detectar el anticuerpo primario.
- Los ensayos de inmunofiltración e inmunocromatografía se utilizan en pruebas de flujo lateral, que se pueden usar para diagnosticar el embarazo y diversas enfermedades mediante la detección de complejos antígeno-anticuerpo marcados con color en orina u otras muestras de líquidos
Notas al pie
- 1 Thomas, Justin G., Victor Jaffe, Judith Shaffer y Jose Abreu, “Pruebas de VIH: Recomendaciones de Estados Unidos 2014”, Médico Osteopático de Familia 6, núm. 6 (2014).


