20.5: Técnicas de Auto-Anticuerpo Fluorescente
- Page ID
- 54795
Objetivos de aprendizaje
- Describir los beneficios de los ensayos de anticuerpos inmunofluorescentes en comparación con los ensayos no fluorescentes
- Comparar ensayos de anticuerpos fluorescentes directos e indirectos
- Explicar cómo se puede usar un citómetro de flujo para cuantificar subconjuntos específicos de células presentes en una mezcla compleja de tipos celulares
- Explicar cómo se puede usar un clasificador celular activado por fluorescencia para separar tipos únicos de células
La visualización rápida de bacterias de una muestra clínica como un hisopo de garganta o esputo se puede lograr a través de técnicas de anticuerpos fluorescentes (FA) que unen un marcador fluorescente (fluorógeno) a la región constante de un anticuerpo, dando como resultado una molécula indicadora que es rápida de usar, fácil de ver o medir, y capaz de unirse a marcadores diana con alta especificidad. También podemos etiquetar células, lo que nos permite cuantificar con precisión subconjuntos particulares de células o incluso purificar estos subconjuntos para futuras investigaciones.
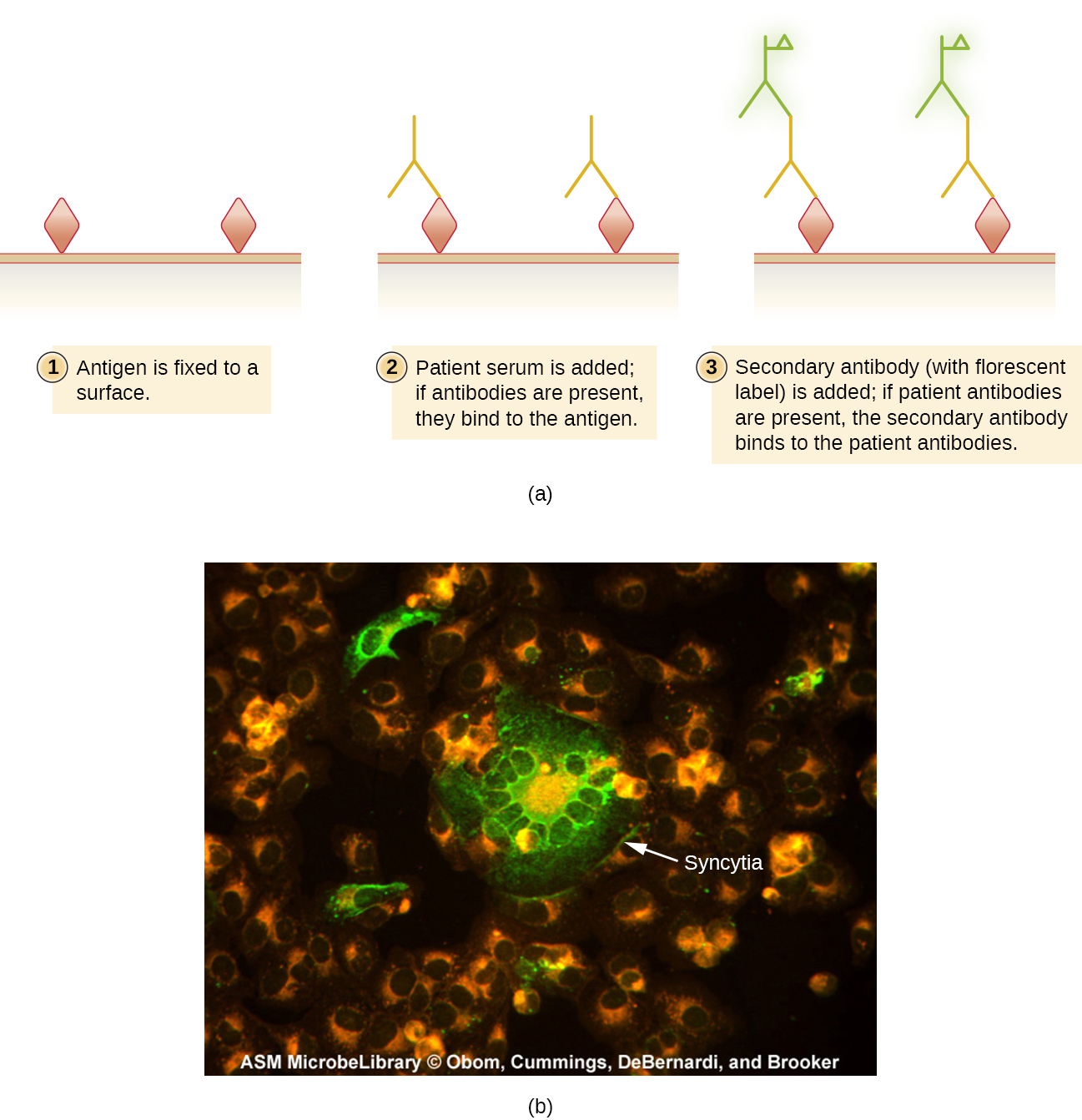
Al igual que con los ensayos enzimáticos, los métodos de FA pueden ser directos, en los que un MAb marcado se une a un antígeno, o indirectos, en los que los anticuerpos policlonales secundarios se unen a anticuerpos de pacientes que reaccionan a un antígeno Las aplicaciones de estos dos métodos se demostraron en la Figura 2.3.8. Los métodos de FA también se utilizan en sistemas automatizados de conteo y clasificación de células para enumerar o segregar subpoblaciones etiquetadas de células en una muestra.
Técnicas de anticuerpos fluorescentes directos
Las pruebas de anticuerpos fluorescentes directos (DFA) utilizan un AcM marcado fluorescentemente para unirse e iluminar un antígeno diana. Las pruebas de DFA son particularmente útiles para el diagnóstico rápido de enfermedades bacterianas. Por ejemplo, los anticuerpos marcados con fluorescencia contra Streptococcus pyogenes (estreptococo del grupo A) se pueden usar para obtener un diagnóstico de faringitis estreptocócica a partir de un hisopo de garganta. El diagnóstico está listo en cuestión de minutos, y el paciente puede iniciarse con antibióticos incluso antes de salir de la clínica. También se pueden utilizar técnicas de DFA para diagnosticar neumonía causada por Mycoplasma pneumoniae o Legionella pneumophila a partir de muestras de esputo (Figura\(\PageIndex{1}\)). Los anticuerpos fluorescentes se unen a las bacterias en un portaobjetos de microscopio, permitiendo una detección fácil de las bacterias usando un microscopio de fluorescencia. Así, la técnica DFA es valiosa para visualizar ciertas bacterias que son difíciles de aislar o cultivar a partir de muestras de pacientes.
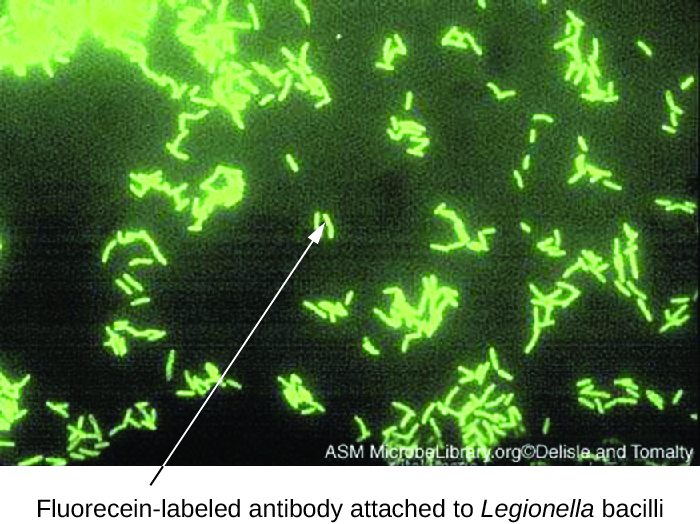
Ejercicio\(\PageIndex{1}\)
En una prueba de anticuerpos fluorescentes directos, ¿a qué se une el anticuerpo fluorescente?
Técnicas de anticuerpos fluorescentes indirectos
Se utilizan pruebas de anticuerpos fluorescentes indirectos (IFA\(\PageIndex{2}\)) (Figura) para buscar anticuerpos en el suero del paciente. Por ejemplo, una prueba IFA para el diagnóstico de sífilis utiliza células de T. pallidum aisladas de un animal de laboratorio (la bacteria no se puede cultivar en medios de laboratorio) y un frotis preparado en un portaobjetos de vidrio. El suero del paciente se extiende sobre el frotis y se permite que los anticuerpos antitreponémicos, si están presentes, se unan. El suero se lava y se agrega un anticuerpo secundario. El anticuerpo secundario es una inmunoglobulina antihumana conjugada con un fluorógeno. En el examen, las bacterias T. pallidum solo serán visibles si han sido unidas por los anticuerpos del suero del paciente.
La prueba IFA para sífilis proporciona un complemento importante a la prueba VDRL discutida en Detección de Complejos Antigeno-Anticuerpo. La VDRL es más probable que genere reacciones de falsos positivos que la prueba IFA; sin embargo, la VDRL es una mejor prueba para determinar si una infección está actualmente activa.
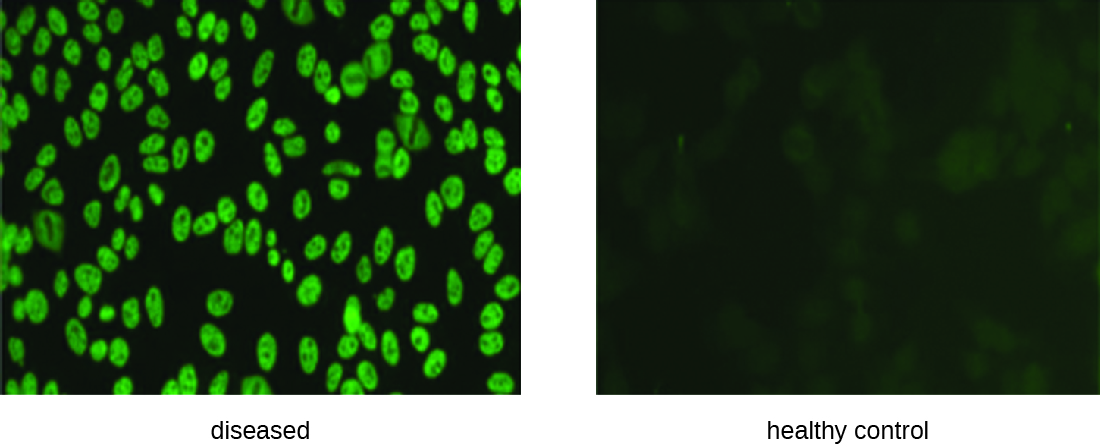
Las pruebas IFA también son útiles para el diagnóstico de enfermedades autoinmunes. Por ejemplo, el lupus eritematoso sistémico (LES) (ver Trastornos autoinmunes) se caracteriza por niveles elevados de expresión de anticuerpos antinucleares (ANA). Estos autoanticuerpos se pueden expresar contra una variedad de proteínas de unión al ADN e incluso contra el ADN mismo. Debido a que la autoinmunidad suele ser difícil de diagnosticar, especialmente al principio de la progresión de la enfermedad, las pruebas de ANA pueden ser una pista valiosa para hacer un diagnóstico y comenzar el tratamiento adecuado.
El IFA para ANA comienza fijando las células cultivadas en cultivo a un portaobjetos de vidrio y haciéndolas permeables al anticuerpo. Los portaobjetos se incuban luego con diluciones seriadas de suero del paciente. Después de la incubación, el portaobjetos se lava para eliminar las proteínas no unidas, y se agrega el anticuerpo fluorescente (IgG antihumana conjugada con un fluorógeno). Después de una incubación y lavado, las células pueden ser examinadas para detectar fluorescencia evidente alrededor del núcleo (Figura\(\PageIndex{3}\)). El título de ANA en el suero está determinado por la dilución más alta que muestra fluorescencia. Debido a que muchas personas sanas expresan ANA, el Colegio Americano de Reumatología recomienda que el título sea de al menos 1:40 en presencia de síntomas que involucren dos o más sistemas de órganos para ser considerados indicativos de LES. 1
Ejercicio\(\PageIndex{2}\)
- En una prueba de anticuerpos fluorescentes indirectos, ¿a qué se une el anticuerpo fluorescente?
- ¿Qué busca la prueba ANA?
Citometría de Flujo
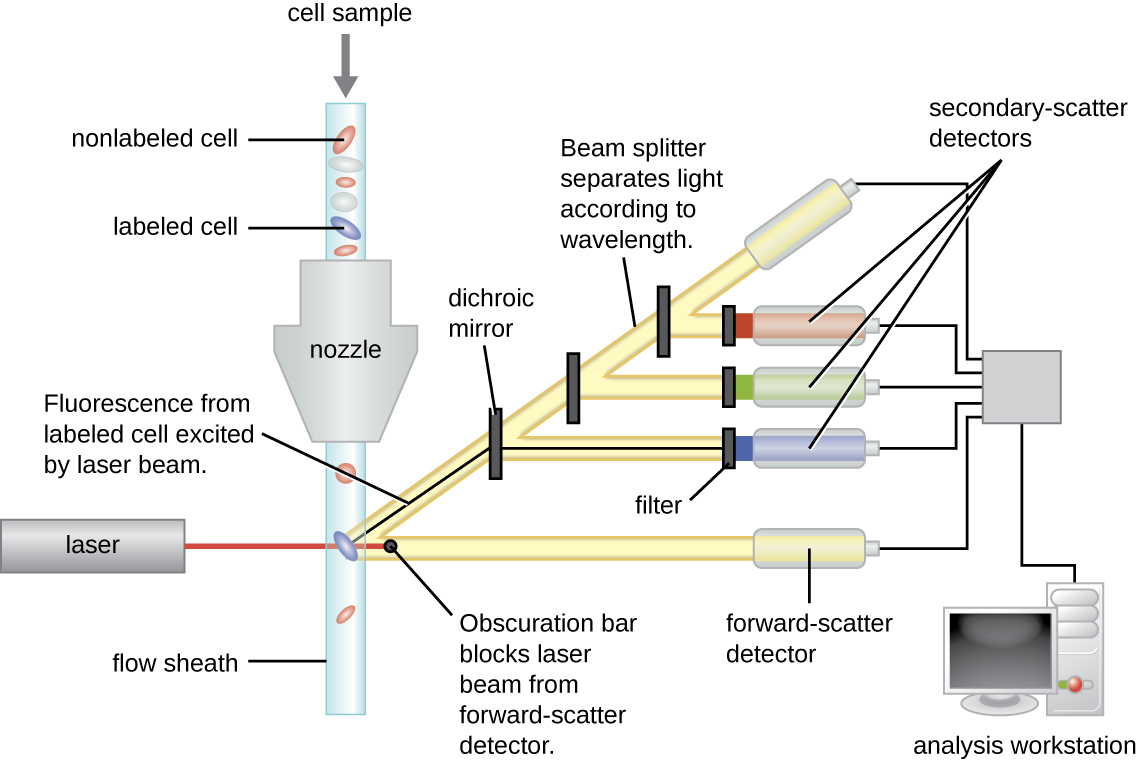
Los anticuerpos marcados fluorescentemente se pueden usar para cuantificar células de un tipo específico en una mezcla compleja usando citometría de flujo (Figura\(\PageIndex{4}\)), un sistema automatizado de conteo de células que detecta células fluorescentes a medida que pasan a través de un tubo estrecho una célula a la vez. Por ejemplo, en las infecciones por VIH, es importante conocer el nivel de células T CD4 en la sangre del paciente; si los números caen por debajo de 500 por μL de sangre, el paciente tiene más probabilidades de adquirir infecciones oportunistas; por debajo de 200 por μL, el paciente ya no puede montar una respuesta inmune adaptativa útil en absoluto. El análisis comienza incubando una población de células mixtas (por ejemplo, glóbulos blancos de un donante) con un mAB marcado fluorescentemente específico para una subpoblación de células (por ejemplo, anti-CD4). Algunos experimentos analizan dos marcadores celulares simultáneamente agregando un fluorógeno diferente al mAB apropiado. Luego, las células se introducen en el citómetro de flujo a través de un capilar estrecho que obliga a las células a pasar en una sola fila. Se utiliza un láser para activar el fluorógeno. La luz fluorescente se irradia en todas las direcciones, por lo que el detector de fluorescencia se puede colocar en un ángulo con respecto a la luz láser incidente.
La figura\(\PageIndex{4}\) muestra la barra de oscurecimiento frente al detector de dispersión frontal que evita que la luz láser golpee el detector. A medida que una celda pasa a través de la barra láser, el detector de dispersión directa detecta la luz dispersada alrededor de la barra de oscurecimiento. La luz dispersada se transforma en un pulso de voltaje, y el citómetro cuenta una célula. La fluorescencia de una célula marcada es detectada por los detectores de dispersión lateral. La luz pasa a través de diversos espejos dicroicos de tal manera que la luz emitida desde el fluoróforo es recibida por el detector correcto.
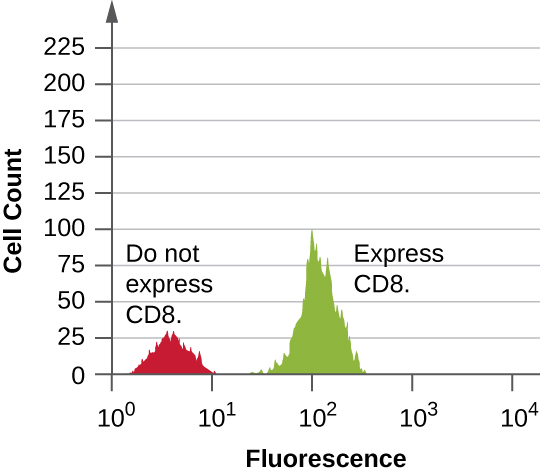
Los datos se recopilan tanto de los detectores de dispersión directa como lateral. Una forma de presentar estos datos es en forma de histograma. La dispersión hacia adelante se coloca en el eje y (para representar el número de células), y la dispersión lateral se coloca en el eje x (para representar la fluorescencia de cada célula). El escalado para el eje x es logarítmico, por lo que la intensidad de fluorescencia aumenta en un factor de 10 con cada unidad de aumento a lo largo del eje. La Figura\(\PageIndex{5}\) representa un ejemplo en el que un cultivo de células se combina con un anticuerpo unido a un fluoróforo para detectar células CD8 y luego se analiza por citometría de flujo. El histograma tiene dos picos. El pico de la izquierda tiene lecturas de fluorescencia menores, representando el subconjunto de la población celular (aproximadamente 30 células) que no fluoresce; por lo tanto, no se unen por anticuerpos y por lo tanto no expresan CD8. El pico de la derecha tiene lecturas de fluorescencia más altas, representando el subconjunto de la población celular (aproximadamente 100 células) que muestran fluorescencia; por lo tanto, están unidas por el anticuerpo y por lo tanto sí expresan CD8.
Ejercicio\(\PageIndex{3}\)
- ¿Cuál es el propósito del láser en un citómetro de flujo?
- En la salida de un citómetro de flujo, ¿el área bajo el histograma es equivalente a qué?
Foco Clínico: Resolución
Después de notificar a los 1300 pacientes, el hospital comienza a programar el tamizaje del VIH. Las citas se programaron un mínimo de 3 semanas después de la última visita hospitalaria del paciente para minimizar el riesgo de falsos negativos. Debido a que se anticiparon algunos falsos positivos, el médico de salud pública estableció un protocolo de consejería para cualquier paciente cuyo ELISA indirecto diera positivo.
De los 1300 pacientes, ocho dieron positivo mediante ELISA. Cinco de estas pruebas fueron invalidadas por pruebas de Western blot negativas, pero una Western blot dio positivo, confirmando que el paciente efectivamente había contraído VIH. Las dos manchas occidentales restantes volvieron indeterminadas. Estos individuos tuvieron que someterse a una tercera prueba, una PCR, para confirmar la presencia o ausencia de secuencias del VIH. Por suerte, ambos pacientes dieron negativo.
En cuanto al paciente solitario confirmado que tiene VIH, las pruebas no pueden probar ni desmentir ninguna conexión con las jeringas comprometidas por el ex empleado del hospital. Aun así, el seguro del hospital cubrirá totalmente el tratamiento del paciente, que comenzó de inmediato.
Aunque ahora tenemos medicamentos que suelen ser efectivos para controlar la progresión del VIH y el SIDA, todavía no hay cura. Si no se trata, o si el régimen farmacológico falla, el paciente experimentará una disminución gradual en el número de células T auxiliares CD4, lo que dará como resultado un deterioro severo de todas las funciones inmunitarias adaptativas. Incluso disminuciones moderadas del número de células T auxiliares pueden resultar en inmunodeficiencia, dejando al paciente susceptible a infecciones oportunistas. Para monitorear el estado de las células T auxiliares del paciente, el hospital utilizará citometría de flujo. Esta prueba sensible permite a los médicos determinar con precisión el número de células T auxiliares para que puedan ajustar el tratamiento si el número cae por debajo de 500 células/µL.
Clasificación de células mediante inmunofluorescencia
El citómetro de flujo y la inmunofluorescencia también se pueden modificar para clasificar células de una sola muestra en subpoblaciones purificadas de células con fines de investigación. Esta modificación del citómetro de flujo se denomina clasificador celular activado por fluorescencia (FACS). En un FACS, la fluorescencia por una célula induce al dispositivo a poner una carga en una gotita del fluido de transporte que contiene esa célula. La carga es específica de la longitud de onda de la luz fluorescente, lo que permite la clasificación diferencial por esas diferentes cargas. La clasificación se realiza mediante un deflector electrostático que mueve la gotita cargada que contiene la celda a un recipiente colector u otro. El proceso da como resultado subpoblaciones de células altamente purificadas.
Una limitación de un FACS es que solo funciona en células aisladas. Así, el método funcionaría en la clasificación de los glóbulos blancos, ya que existen como células aisladas. Pero para las células de un tejido, la citometría de flujo solo se puede aplicar si podemos extirpar el tejido y separarlo en células individuales (usando proteasas para escindir moléculas de adhesión célula-célula) sin alterar la integridad celular. Este método puede ser utilizado en tumores, pero más a menudo, la inmunohistoquímica y la inmunocitoquímica se utilizan para estudiar las células en los tejidos.
Vea videos para conocer más sobre cómo funcionan la citometría de flujo y un FACS.
Ejercicio\(\PageIndex{4}\)
En la clasificación celular activada por fluorescencia, ¿qué característica de las células diana permite que se separen?
En la tabla\(\PageIndex{1}\) se comparan los mecanismos de las técnicas de anticuerpos fluorescentes discutidos en esta sección.
| Tipo de ensayo | Mecanismo | Ejemplos |
|---|---|---|
| Anticuerpo fluorescente directo (DFA) | Utiliza conjugados de fluorógeno-anticuerpo para etiquetar bacterias de muestras de pacientes | Visualización de Legionella pneumophila a partir de un hisopo de garganta |
| Anticuerpo fluorescente indirecto (IFA) | Detecta anticuerpos específicos de enfermedad en suero de patente | Diagnóstico de sífilis; detección de anticuerpos antinucleares (ANA) para lupus y otras enfermedades autoinmunes |
| Citometría de flujo | Marca las membranas celulares con marcadores conjugados de fluorógeno-anticuerpo excitados por un láser; la máquina cuenta la célula y registra la fluorescencia relativa | Contar el número de células CD4 o CD8 marcadas fluorescentemente en una muestra |
| Clasificador de células activadas por fluorescencia (FACS) | Forma de citometría de flujo que cuenta las células y las separa físicamente en grupos de células de alta y baja fluorescencia | Clasificación de células cancerosas |
Conceptos clave y resumen
- Los ensayos de inmunofluorescencia utilizan conjugados anticuerpo-fluorógeno para iluminar antígenos para una detección fácil y rápida.
- La inmunofluorescencia directa puede ser utilizada para detectar la presencia de bacterias en muestras clínicas como el esputo.
- La inmunofluorescencia indirecta detecta la presencia de anticuerpos específicos de antígeno en sueros de pacientes. El anticuerpo fluorescente se une al anticuerpo específico de antígeno en lugar del antígeno.
- El uso de ensayos de inmunofluorescencia indirecta para detectar anticuerpos antinucleares es una herramienta importante en el diagnóstico de varias enfermedades autoinmunes.
- La citometría de flujo utiliza mAbs fluorescentes contra proteínas de membrana celular para cuantificar subconjuntos específicos de células en mezclas complejas.
- Los clasificadores celulares activados por fluorescencia son una extensión de la citometría de flujo en la que la intensidad de fluorescencia se usa para separar físicamente las células en poblaciones de alta y baja fluorescencia.
Notas al pie
- 1 Gill, James M., ANNA M. Quisel, PETER V. Rocca y DENE T. Walters. “Diagnóstico de lupus eritematoso sistémico”. Médico de familia americano 68, núm. 11 (2003): 2179-2186.


