24.3: Infecciones Bacterianas del Tracto Gastrointestinal
- Page ID
- 54957
Objetivos de aprendizaje
- Identificar las bacterias más comunes que pueden causar infecciones del tracto gastrointestinal
- Comparar las principales características de enfermedades bacterianas específicas que afectan el tracto gastrointestinal
Una amplia gama de enfermedades gastrointestinales son causadas por la contaminación bacteriana de los alimentos. Recordemos que las enfermedades transmitidas por los alimentospueden surgir de infección o intoxicación. En ambos casos, las toxinas bacterianas son típicamente responsables de producir signos y síntomas de la enfermedad. La distinción radica en dónde se producen las toxinas. En una infección, el agente microbiano se ingiere, coloniza el intestino y luego produce toxinas que dañan las células hospedadoras. En una intoxicación, las bacterias producen toxinas en los alimentos antes de ser ingeridos. En cualquier caso, las toxinas causan daño a las células que recubren el tracto gastrointestinal, típicamente el colon. Esto lleva a los signos y síntomas comunes de diarrea o heces acuosas y calambres abdominales, o la disentería más severa. Los síntomas de las enfermedades transmitidas por los alimentos también suelen incluir náuseas y vómitos, que son mecanismos que el cuerpo utiliza para expulsar los materiales tóxicos.
La mayoría de las enfermedades gastrointestinales bacterianas son efímeras y autolimitantes; sin embargo, la pérdida de líquidos por enfermedad diarreica grave puede llevar a deshidratación que, en algunos casos, puede ser fatal sin un tratamiento adecuado. La terapia de rehidratación oral con soluciones electrolíticas es un aspecto esencial del tratamiento para la mayoría de los pacientes con enfermedad GI, especialmente en niños y lactantes.
Intoxicación alimentaria por estafilococos
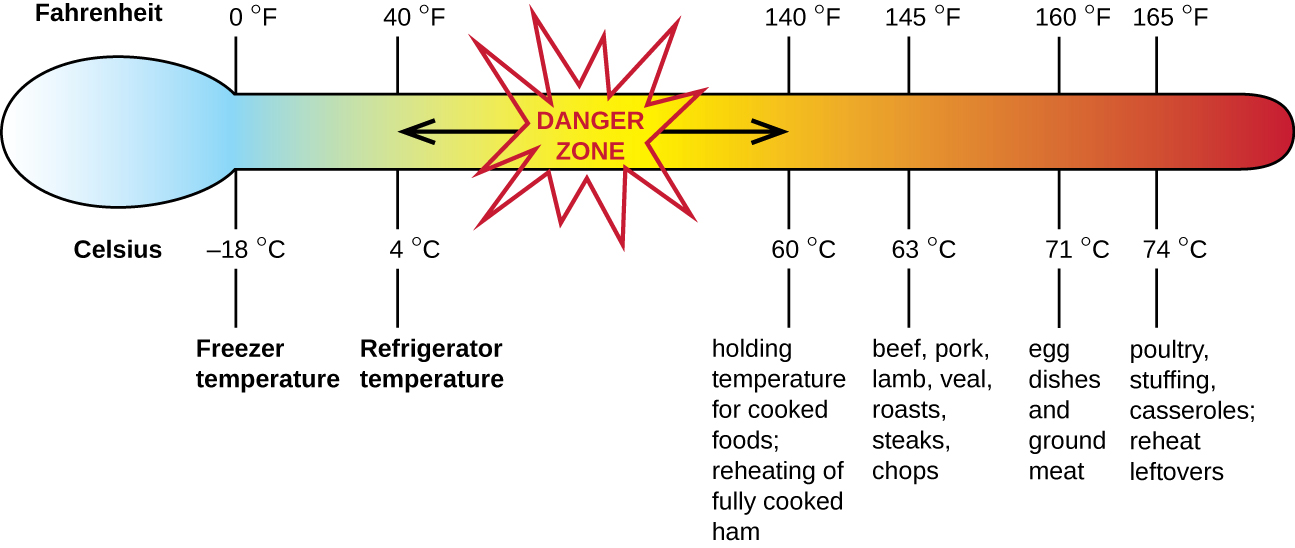
La intoxicación alimentaria por estafilococos es una forma de intoxicación alimentaria. Cuando Staphylococcus aureus crece en los alimentos, puede producir enterotoxinas que, al ingerirse, pueden causar síntomas como náuseas, diarrea, calambres y vómitos dentro de una a seis horas. En algunos casos severos, puede causar dolor de cabeza, deshidratación y cambios en la presión arterial y la frecuencia cardíaca. Los signos y síntomas se resuelven dentro de las 24 a 48 horas. S. aureus a menudo se asocia con una variedad de alimentos crudos o poco cocidos y cocidos, incluyendo carne (por ejemplo, carne enlatada, jamón y salchichas) y productos lácteos (por ejemplo, quesos, leche y mantequilla). También se encuentra comúnmente en las manos y puede transmitirse a alimentos preparados a través de una higiene deficiente, incluido el mal lavado de manos y el uso de superficies contaminadas de preparación de alimentos, como tablas de cortar. El mayor riesgo es para los alimentos dejados a una temperatura inferior a 60 °C (140 °F), lo que permite que las bacterias crezcan. Los alimentos cocidos generalmente deben recalentarse a al menos 60 °C (140 °F) para mayor seguridad y la mayoría de las carnes crudas deben cocinarse a temperaturas internas aún más altas (Figura\(\PageIndex{1}\)).
Hay al menos 21 enterotoxinas estafilocócicas y toxinas similares a enterotoxinas estafilocócicas que pueden causar intoxicación alimentaria. Las enterotoxinas son proteínas que son resistentes a pH bajo, lo que les permite pasar por el estómago. Son estables al calor y no se destruyen por ebullición a 100 °C, aunque la bacteria misma puede ser destruida, las enterotoxinas por sí solas pueden causar vómitos y diarrea, aunque los mecanismos no se entienden completamente. Al menos algunos de los síntomas pueden ser causados por la enterotoxina funcionando como un superantígeno y provocando una fuerte respuesta inmune al activar la proliferación de células T.
La rápida aparición de signos y síntomas ayuda a diagnosticar esta enfermedad transmitida por los alimentos. Debido a que la bacteria no necesita estar presente para que la toxina cause síntomas, el diagnóstico se confirma identificando la toxina en una muestra de alimento o en especímenes biológicos (heces o vómitos) del paciente. También se pueden utilizar técnicas serológicas, incluyendo ELISA, para identificar la toxina en muestras de alimentos.
El padecimiento generalmente se resuelve con relativa rapidez, dentro de las 24 horas, sin tratamiento. En algunos casos, puede ser necesario un tratamiento de apoyo en un hospital.
Ejercicio\(\PageIndex{1}\)
¿Cómo puede S. aureus causar intoxicación alimentaria?
Shigelosis (Disentería Bacilar)
Cuando la enfermedad gastrointestinal se asocia con la bacteria gramnegativa Shigella en forma de varilla, se llama disentería bacilar, o shigelosis. Las infecciones pueden ser causadas por S. dysenteriae, S. flexneri, S. boydii y/o S. sonnei que colonizan el tracto gastrointestinal. La shigelosis se puede propagar de la mano a la boca o a través de alimentos y agua contaminados. Con mayor frecuencia, se transmite a través de la vía fecal-oral.
La bacteria Shigella invade las células epiteliales intestinales. Al ser llevados a un fagosoma, pueden escapar y luego vivir dentro del citoplasma de la célula o trasladarse a células adyacentes. A medida que los organismos se multiplican, el epitelio y las estructuras con células M de los parches de Peyer en el intestino pueden ulcerarse y causar pérdida de líquido. A menudo se desarrollan calambres estomacales, fiebre y diarrea acuosa que también pueden contener pus, moco y/o sangre. Los casos más severos pueden resultar en ulceración de la mucosa, deshidratación y sangrado rectal. Adicionalmente, los pacientes pueden desarrollar posteriormente el síndrome urémico hemolítico (SUH), una afección grave en la que se acumulan células sanguíneas dañadas en los riñones y puede causar insuficiencia renal, o artritis reactiva, una afección en la que la artritis se desarrolla en múltiples articulaciones después de la infección. Los pacientes también pueden desarrollar síndrome de intestino irritable (SII) posinfección crónica.
S. dysenteriae tipo 1 es capaz de producir toxina Shiga, que se dirige a las células endoteliales de los vasos sanguíneos pequeños en el intestino delgado y grueso mediante la unión a un glicoesfingolípido. Una vez dentro de las células endoteliales, la toxina se dirige a la subunidad ribosómica grande, afectando así la síntesis proteica de estas células. Pueden resultar hemorragias y lesiones en el colon. La toxina puede apuntar al glomérulo del riñón, los vasos sanguíneos donde comienza la filtración de sangre en el riñón, resultando así en SUH.
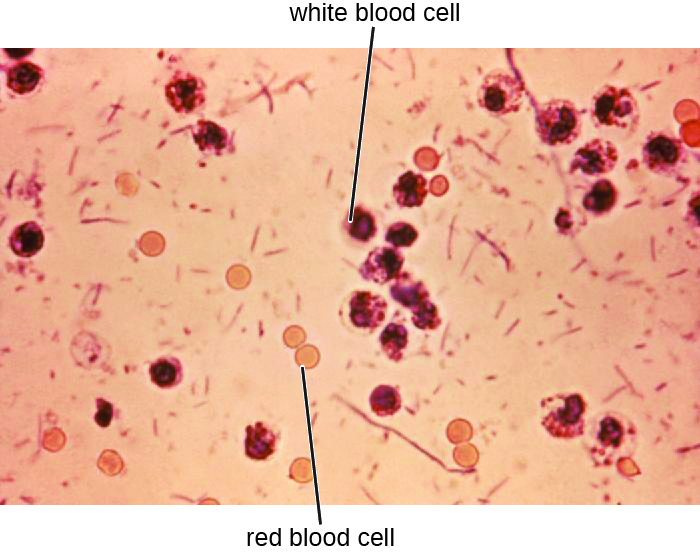
Las muestras de heces, que deben procesarse con prontitud, se analizan mediante técnicas serológicas o moleculares. Un método común es realizar inmunoensayos para S. dysenteriae. (Otros métodos que se pueden usar para identificar Shigella incluyen tiras reactivas API, sistemas Enterotube o pruebas de PCR. La presencia de glóbulos blancos y sangre en muestras fecales se presenta en aproximadamente 70% de los pacientes 1 (Figura\(\PageIndex{2}\)). Los casos graves pueden requerir antibióticos como ciprofloxacino y azitromicina, pero estos deben prescribirse cuidadosamente porque la resistencia es cada vez más común.
Ejercicio\(\PageIndex{2}\)
Comparar y contrastar infecciones e intoxicaciones por Shigella.
Salmonelosis
La gastroenteritis por Salmonella, también llamada salmonelosis, es causada por la bacteria Gram-negativa en forma de varilla Salmonella. Dos especies, S. enterica y S. bongori, causan enfermedades en humanos, pero S. enterica es la más común. Los serotipos más comunes de S. enterica son Enteritidis y Typhi. Discutiremos la fiebre tifoidea causada por los serotipos Typhi y Paratyphi A por separado. Aquí, nos centraremos en la salmonelosis causada por otros serotipos.
La salmonela es parte de la microbiota intestinal normal de muchos individuos. Sin embargo, la salmonelosis es causada por agentes exógenos, y la infección puede ocurrir dependiendo del serotipo, tamaño del inóculo y salud general del huésped. La infección es causada por la ingestión de alimentos contaminados, manejo de cáscaras de huevo o exposición a ciertos animales. La salmonela es parte de la microbiota avícola, por lo que la exposición a huevos crudos y aves crudas puede aumentar el riesgo de infección. Lavar las manos y cocinar los alimentos a fondo reducen en gran medida el riesgo de transmisión. La bacteria Salmonella puede sobrevivir a la congelación por períodos prolongados pero no puede sobrevivir a altas temperaturas.
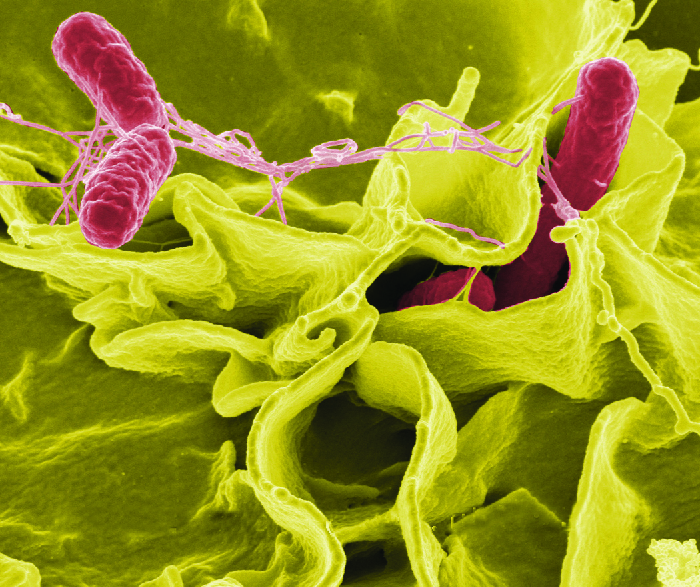
Una vez que las bacterias son ingeridas, se multiplican dentro de los intestinos y penetran en las células epiteliales de la mucosa a través de las células M donde continúan creciendo (Figura\(\PageIndex{3}\)). Desencadenan procesos inflamatorios y la hipersecreción de fluidos. Una vez dentro del cuerpo, pueden persistir dentro de los fagosomas de los macrófagos. La salmonela puede atravesar la membrana celular epitelial e ingresar al torrente sanguíneo y al sistema linfático. Algunas cepas de Salmonella también producen una enterotoxina que puede causar una intoxicación.
Los individuos infectados desarrollan fiebre, náuseas, calambres abdominales, vómitos, dolor de cabeza y diarrea. Estos signos y síntomas suelen durar de unos días a una semana. Según los Centros para el Control y la Prevención de Enfermedades (CDC), hay mil millones de casos anuales, con 380 muertes cada año. 2 Sin embargo, debido a que la enfermedad suele ser autolimitante, muchos casos no se reportan a los médicos y la incidencia general puede ser subreportada. El diagnóstico implica cultivo seguido de serotipado y huellas de ADN si es necesario. Los resultados positivos se reportan a los CDC. Cuando se detecta un serotipo inusual, las muestras se envían a los CDC para su posterior análisis. El serotipado es importante para determinar el tratamiento. La terapia de rehidratación oral se usa comúnmente. Los antibióticos solo se recomiendan para casos graves. Cuando se necesitan antibióticos, como en pacientes inmunocomprometidos, se recomiendan fluoroquinolonas, cefalosporinas de tercera generación y ampicilina. La resistencia a los antibióticos es una grave preocupación.
Fiebre tifoidea
Ciertos serotipos de S. enterica, principalmente el serotipo Typhi (S. typhi) pero también Paratyphi, causan un tipo de salmonelosis más grave llamada fiebre tifoidea. Esta grave enfermedad, que tiene una tasa de mortalidad no tratada del 10%, provoca fiebre alta, dolores corporales, dolor de cabeza, náuseas, letargo y un posible sarpullido.
Algunos individuos portan S. typhi sin presentar signos o síntomas (conocidos como portadores asintomáticos) y los vierten continuamente a través de sus heces. Estos portadores suelen tener las bacterias en la vesícula biliar o epitelio intestinal. Los individuos que consumen alimentos o agua contaminados con estas heces pueden infectarse.
Los S. typhi penetran en la mucosa intestinal, crecen dentro de los macrófagos y son transportados a través del cuerpo, sobre todo al hígado y la vesícula biliar. Finalmente, los macrófagos se lisan, liberando S. typhi en el torrente sanguíneo y el sistema linfático. La mortalidad puede ser el resultado de ulceración y perforación del intestino. Una amplia gama de complicaciones, como neumonía e ictericia, pueden ocurrir con la enfermedad diseminada.
S. typhi tienen islas de patogenicidad de Salmonella (SPI) que contienen los genes para muchos de sus factores de virulencia. Dos ejemplos de toxinas tifoideas importantes son el antígeno Vi, que codifica para la producción de cápsulas, y la toxina quimérica A2B5, que causa muchos de los signos y síntomas de la fase aguda de la fiebre tifoidea.
El examen clínico y el cultivo se utilizan para realizar el diagnóstico. Las bacterias se pueden cultivar a partir de heces, orina, sangre o médula ósea. La serología, incluyendo ELISA, se utiliza para identificar las cepas más patógenas, pero se necesita confirmación con pruebas de ADN o cultivo. También se puede usar una prueba de PCR, pero no está ampliamente disponible.
El tratamiento antibiótico recomendado incluye fluoroquinolonas, ceftriaxona y azitromicina. Los individuos deben ser extremadamente cuidadosos para evitar infectar a otros durante el tratamiento. La fiebre tifoidea se puede prevenir a través de la vacunación para individuos que viajan a partes del mundo donde es común.
Ejercicio\(\PageIndex{3}\)
¿Por qué el serotipo es particularmente importante en las infecciones por Salmonella y la fiebre tifoidea?
Mary Mallon era una inmigrante irlandesa que trabajaba como cocinera en Nueva York a principios del siglo XX. A lo largo de siete años, de 1900 a 1907, Mallon trabajó para varios hogares diferentes, transmitiendo sin saberlo la enfermedad a las personas que vivían en cada uno. En 1906, una familia contrató a George Soper, experto en epidemias de fiebre tifoidea, para determinar la causa de las enfermedades en su hogar. Finalmente, Soper rastreó a Mallon y le vinculó directamente 22 casos de fiebre tifoidea. Descubrió que Mallon era portador de la tifoidea pero era inmune a ella misma. Aunque antes se habían reconocido portadores activos, esta fue la primera vez que se identificó un portador asintomático de infección.
Debido a que ella misma nunca había estado enferma, a Mallon le resultaba difícil creer que pudiera ser la fuente de la enfermedad. Ella huyó de Soper y de las autoridades porque no quería que la pusieran en cuarentena ni la obligaran a renunciar a su profesión, que estaba relativamente bien remunerada para alguien con sus antecedentes. No obstante, Mallon finalmente fue atrapada y mantenida en un centro de aislamiento en el Bronx, donde permaneció hasta 1910, cuando el departamento de salud de Nueva York la liberó bajo la condición de que nunca más trabajara con alimentos. Desafortunadamente, Mallon no cumplió, y pronto comenzó a trabajar de nuevo como cocinera. Después de que comenzaron a aparecer nuevos casos que resultaron con la muerte de dos individuos, las autoridades la rastrearon nuevamente y la devolvieron al aislamiento, donde permaneció por 23 años más hasta su muerte en 1938. Los epidemiólogos pudieron rastrear 51 casos de fiebre tifoidea y tres muertes directamente a Mallon, quien es recordado de manera poco halagadora como “María tifoidea”.
El caso María tifoidea tiene correlaciones directas en la industria de la salud. Considere a Kaci Hickox, una enfermera estadounidense que atendió a pacientes con ébola en África Occidental durante la epidemia de 2014. Después de regresar a Estados Unidos, Hickox fue puesta en cuarentena contra su voluntad durante tres días y posteriormente se encontró que no tenía ébola. Hickox se opuso vehementemente a la cuarentena. En un editorial publicado en el diario británico The Guardian, 3 Hickox argumentó que poner en cuarentena a los trabajadores de la salud asintomáticos que no habían dado positivo por una enfermedad no solo evitaría que tales individuos ejerzan su profesión, sino que desalentaría a otros de ofrecerse como voluntarios para trabajar en zonas plagadas de enfermedades en las que se necesita desesperadamente trabajadores de la salud.
¿Cuál es la responsabilidad de un individuo como Mary Mallon de cambiar su comportamiento para proteger a los demás? ¿Qué sucede cuando un individuo cree que no es un riesgo, pero otros creen que lo es? ¿Cómo reaccionarías si estuvieras en los zapatos de Mallon y te pusieran en cuarentena que no creías que fuera necesaria, a costa de tu propia libertad y posiblemente de tu carrera? ¿Importa si definitivamente estabas infectado o no?
Infecciones por E. coli
La varilla gramnegativa Escherichia coli es un miembro común de la microbiota normal del colon. Aunque la gran mayoría de las cepas de E. coli son bacterias comensales útiles, algunas pueden ser patógenas y pueden causar enfermedades diarreicas peligrosas. Las cepas patógenas tienen factores de virulencia adicionales como fimbrias tipo 1 que promueven la colonización del colon o pueden producir toxinas (ver Factores de Virulencia de Patógenos Bacterianos y Virales). Estos factores de virulencia se adquieren a través de la transferencia génica horizontal.
La enfermedad extraintestinal puede resultar si la bacteria se propaga desde el tracto gastrointestinal. Si bien estas bacterias pueden transmitirse de persona a persona, a menudo se adquieren a través de alimentos o agua contaminados. Hay seis grupos patógenos reconocidos de E. coli, pero aquí nos centraremos en los cuatro que se transmiten más comúnmente a través de los alimentos y el agua.
E. coli enterotoxigénica (ETEC), también conocida como diarrea del viajero, causa enfermedades diarreicas y es común en países menos desarrollados. En México, la infección por ETEC se llama La Venganza de Montezuma. Después de la ingestión de alimentos o agua contaminados, los individuos infectados desarrollan diarrea acuosa, calambres abdominales, malestar general (sensación de malestar) y fiebre baja. ETEC produce una enterotoxina termoestable similar a la toxina del cólera, y adhesinas llamadas factores de colonización que ayudan a que las bacterias se adhieran a la pared intestinal. Algunas cepas de ETEC también producen toxinas lábiles al calor. La enfermedad suele ser relativamente leve y autolimitante. El diagnóstico implica cultivo y PCR. Si es necesario, el tratamiento antibiótico con fluoroquinolonas, doxiciclina, rifaximina y trimetoprim-sulfametoxazol (TMP/SMZ) puede acortar la duración de la infección. Sin embargo, la resistencia a los antibióticos es un problema.
E. coli enteroinvasiva (EIEC) es muy similar a la shigelosis, incluyendo su patogénesis de invasión intracelular en el tejido epitelial intestinal. Esta bacteria porta un plásmido grande que está implicado en la penetración de las células epiteliales. La enfermedad suele ser autolimitante, con síntomas que incluyen diarrea acuosa, escalofríos, calambres, malestar general, fiebre y disentería. El cultivo y las pruebas de PCR se pueden utilizar para el diagnóstico. No se recomienda el tratamiento con antibióticos, por lo que se usa terapia de apoyo si es necesario.
La E. coli enteropatogénica (EPEC) puede causar una diarrea potencialmente mortal, especialmente en lactantes y en países menos desarrollados. La fiebre, los vómitos y la diarrea pueden llevar a una deshidratación severa. Estas E. coli inyectan una proteína (Tir) que se adhiere a la superficie de las células epiteliales intestinales y desencadena el reordenamiento de la actina de la célula huésped de microvellosidades a pedestales. Tir también resulta ser el receptor de Intimin, una proteína de superficie producida por EPEC, permitiendo así que E. coli se “asiente” en el pedestal. Los genes necesarios para esta formación de pedestal están codificados en el locus para la isla de patogenicidad de eliminación de enterocitos (LEE). Al igual que con ETEC, el diagnóstico implica el cultivo y la PCR. El tratamiento es similar al de ETEC.
Las cepas más peligrosas son E. coli enterohemorrágica (EHEC), que son las cepas capaces de causar epidemias. En particular, la cepa O157:H7 ha sido responsable de varios brotes recientes. Recordemos que los O y H se refieren a antígenos de superficie que contribuyen a la patogenicidad y desencadenan una respuesta inmune del huésped (“O” se refiere a la cadena lateral O del lipopolisacárido y la “H” se refiere a los flagelos). Similar a EPEC, EHEC también forma pedestales. EHEC también produce una toxina similar a Shiga. Debido a que el genoma de esta bacteria ha sido secuenciado, se sabe que los genes de la toxina Shiga probablemente se adquirieron a través de la transducción (transferencia génica horizontal). Los genes de la toxina Shiga se originaron a partir de Shigella dysenteriae. Profecago de un bacteriófago que previamente infectó a Shigella se integró en el cromosoma de E. coli. La toxina similar al Shiga a menudo se llama verotoxina.
La EHEC puede causar enfermedades que van desde relativamente leves hasta potencialmente mortales. Los síntomas incluyen diarrea sanguinolenta con calambres severos, pero sin fiebre. Aunque suele ser autolimitante, puede provocar colitis hemorrágica y sangrado profuso. Una posible complicación es el SUH. El diagnóstico implica el cultivo, a menudo usando MacConkey con agar sorbitol para diferenciar entre E. coli O157:H7, que no fermenta sorbitol, y otras cepas menos virulentas de E. coli que pueden fermentar sorbitol.
También se pueden usar pruebas de tipificación serológica o PCR, así como pruebas genéticas para la toxina Shiga. Para distinguir EPEC de EHEC, debido a que ambos forman pedestales en las células epiteliales intestinales, es necesario realizar pruebas de genes que codifican tanto para la toxina similar a Shiga como para el LEE. Tanto la EPEC como la EHEC tienen LEE, pero la EPEC carece del gen para la toxina Shiga. No se recomienda la terapia con antibióticos y puede empeorar el SUH debido a las toxinas liberadas cuando se matan las bacterias, por lo que se deben usar terapias de apoyo. El cuadro\(\PageIndex{1}\) resume las características de los cuatro grupos patógenos más comunes.
| Grupo | Factores de Virulencia y Genes | Signos y síntomas | Pruebas diagnósticas | Tratamiento |
|---|---|---|---|---|
| E. coli enterotoxigénica (ETEC) | Enterotoxina estable al calor similar a la toxina del cólera | Diarrea acuosa relativamente leve | Cultivo, PCR | Autolimitante; si es necesario, fluoroquinolonas, doxiciclina, rifaximina, TMP/SMZ; la resistencia a antibióticos es un problema |
| E. coli enteroinvasiva (EIEC) | Genes Inv (plásmido invasivo) | Diarrea acuosa relativamente leve; puede presentarse disentería o colitis inflamatoria | Cultivo, PCR; pruebas para el gen inv; ensayos adicionales para distinguir de Shigella | Solo terapia de apoyo; no se recomiendan antibióticos |
| E. coli enteropatogénica (EPEC) | Isla de patogenicidad del locus de eliminación de enterocitos (LEE) | Fiebre severa, vómitos, diarrea no sanguinolenta, deshidratación; potencialmente mortal | Cultivo, PCR; detección de LEE carentes de genes de toxina tipo Shiga | Autolimitante; si es necesario, fluoroquinolonas, doxiciclina, rifaximina (TMP/SMZ); la resistencia a antibióticos es un problema |
| E. coli enterohemorrágica (EHEC) | Verotoxina | Puede ser leve o muy grave; diarrea sanguinolenta; puede resultar en SUH | Cultivo; placa sobre agar MacConkey con agar sorbitol ya que no fermenta sorbitol; detección por PCR de LEE que contiene genes de toxina tipo Shiga | No se recomiendan antibióticos debido al riesgo de SUH |
Ejercicio\(\PageIndex{4}\)
Comparar y contrastar los factores de virulencia y signos y síntomas de las infecciones con los cuatro grupos principales de E. coli.
Cólera y Otros Vibrios
El cólera de la enfermedad gastrointestinal es una infección grave a menudo asociada con un saneamiento deficiente, especialmente después de desastres naturales, debido a que se propaga a través de agua contaminada y alimentos que no han sido calentados a temperaturas lo suficientemente altas como para matar a la bacteria. Es causada por Vibrio cholerae serotipo O1, una bacteria gramnegativa flagelada en forma de varilla curva (vibrio). Según los CDC, el cólera causa un estimado de 3 a 5 millones de casos y 100 mil muertes cada año. 4
Debido a que V. cholerae es asesinado por el ácido estomacal, se necesitan dosis relativamente grandes para que unas pocas células microbianas sobrevivan y lleguen a los intestinos y causen infección. Las células móviles viajan a través de la capa mucosa de los intestinos, donde se unen a las células epiteliales y liberan enterotoxina del cólera. La toxina es una toxina A-B con actividad a través de adenilato ciclasa (ver Factores de Virulencia de Patógenos Bacterianos y Virales). Dentro de la célula intestinal, aumentan los niveles de AMP cíclico (AMPc), lo que activa un canal de cloruro y da como resultado la liberación de iones en la luz intestinal. Este aumento en la presión osmótica en el lumen lleva a que el agua también ingrese al lumen. A medida que el agua y los electrolitos salen del cuerpo, provoca una rápida deshidratación y desequilibrio electrolítico. La diarrea es tan profusa que a menudo se le llama “heces de agua de arroz”, y los pacientes se colocan en cunas con un agujero en ellas para monitorear la pérdida de líquido (Figura\(\PageIndex{4}\)).
El cólera se diagnostica tomando una muestra de heces y cultivando para Vibrio. Las bacterias son positivas a oxidasa y muestran fermentación sin lactosa en agar MacConkey. Los fermentadores de lactosa gramnegativos producirán colonias rojas mientras que los no fermentadores producirán colonias blancas/incoloras. Las bacterias grampositivas no crecerán en MacConkey. La fermentación de lactosa se usa comúnmente para la identificación de patógenos porque la microbiota normal generalmente fermenta lactosa mientras que los patógenos no. V. cholerae también se puede cultivar en agar tiosulfato citrato sales biliares sacarosa (TCBS), un medio selectivo y diferencial para Vibrio spp., que produce una colonia amarilla distinta.
El cólera puede ser autolimitante y el tratamiento implica rehidratación y reposición de electrolitos. Aunque normalmente no se necesitan antibióticos, pueden usarse para enfermedades graves o diseminadas. Se recomiendan tetraciclinas, pero se puede usar doxiciclina, eritromicina, orfloxacina, ciprofloxacina y TMP/SMZ. La evidencia reciente sugiere que la azitromicina también es un buen antibiótico de primera línea. Un buen saneamiento, incluido el tratamiento adecuado de aguas residuales, suministros limpios para cocinar y agua potable purificada, es importante para prevenir infecciones (Figura\(\PageIndex{4}\))

V. el cólera no es la única especie de Vibrio que puede causar enfermedades. V. parahemolyticus se asocia con el consumo de mariscos contaminados y causa enfermedades gastrointestinales con signos y síntomas como diarrea acuosa, náuseas, fiebre, escalofríos y calambres abdominales. La bacteria produce una hemolisina termoestable, lo que lleva a disentería y posible enfermedad diseminada. También a veces causa infecciones de heridas. V. parahemolyticus se diagnostica usando cultivos de sangre, heces o una herida. Al igual que con V. cholera, el medio selectivo (especialmente el agar TCBS) funciona bien. La tetraciclina y el ciprofloxacino pueden usarse para tratar casos severos, pero generalmente no se necesitan antibióticos.
Vibrio vulnificus se encuentra en agua de mar caliente y, a diferencia de V. cholerae, no se asocia con malas condiciones sanitarias. La bacteria se puede encontrar en mariscos crudos, y la ingestión causa enfermedades gastrointestinales. También puede ser adquirida por individuos con heridas cutáneas abiertas que están expuestos al agua con altas concentraciones del patógeno. En algunos casos, la infección se propaga al torrente sanguíneo y provoca septicemia. La infección de la piel puede provocar edema, equimosis (decoloración de la piel por sangrado) y abscesos. Los pacientes con enfermedad subyacente tienen una alta tasa de mortalidad de alrededor del 50%. Es de particular preocupación para las personas con enfermedad hepática crónica o que de otra manera son inmunodeficientes porque un sistema inmunológico saludable a menudo puede evitar que se desarrolle una infección. V. vulnificus se diagnostica mediante el cultivo del patógeno a partir de muestras de heces, muestras de sangre o abscesos cutáneos. Los pacientes adultos son tratados con doxiciclina combinada con una cefalosporina de tercera generación o con fluoroquinolonas, y los niños son tratados con TMP/SMZ.
Otros dos vibrios, Aeromonas hydrophila y Plesiomonas shigelloides, también están asociados con ambientes marinos y mariscos crudos; también pueden causar gastroenteritis. Al igual que V. vulnificus, A. hydrophila se asocia más frecuentemente con infecciones en heridas, generalmente las adquiridas en el agua. En algunos casos, también puede causar septicemia. Otras especies de Aeromonas pueden causar enfermedades. P. shigelloides a veces se asocia con infecciones sistémicas más graves si se ingiere en alimentos o agua contaminados. El cultivo puede ser utilizado para diagnosticar infecciones por A. hydrophila y P. shigelloides, para las cuales generalmente no se necesita terapia antibiótica. Cuando sea necesario, tetraciclina y ciprofloxacino, entre otros antibióticos, pueden ser utilizados para el tratamiento de A. hydrophila, y las fluoroquinolonas y trimetoprima son los tratamientos efectivos para P. shigelloides.
Ejercicio\(\PageIndex{5}\)
¿Cómo causa la infección por V. cólera una deshidratación rápida?
Gastroenteritis por Campylobacter jejuni
Campylobacter es un género de bacterias gramnegativas, espirales o curvas. Pueden tener uno o dos flagelos. La gastroenteritis por Campylobacter jejuni, una forma de campilobacteriosis, es una enfermedad generalizada causada por Campylobacter jejuni. La principal vía de transmisión es a través de aves de corral que se contaminan durante el sacrificio. El manejo del pollo crudo a su vez contamina las superficies de cocción, utensilios y otros alimentos. La leche no pasteurizada o el agua contaminada también son vehículos potenciales de transmisión. En la mayoría de los casos, la enfermedad es autolimitante e incluye fiebre, diarrea, calambres, vómitos y, a veces, disentería. A veces se presentan signos y síntomas más graves, como bacteriemia, meningitis, pancreatitis, colecistitis y hepatitis. También se ha asociado con padecimientos autoinmunes como el síndrome de Guillain-Barré, una enfermedad neurológica que se presenta después de algunas infecciones y da como resultado parálisis temporal. El SUH después de la infección también puede ocurrir. La virulencia en muchas cepas es el resultado de la producción de hemolisina y la presencia de la toxina de distensión citoletal Campylobacter (CDT), una poderosa desoxirribonucleasa (DNasa) que daña irreversiblemente el ADN de la célula hospedadora.
El diagnóstico implica el cultivo en condiciones especiales, como temperatura elevada, baja tensión de oxígeno y, a menudo, medio complementado con agentes antimicrobianos. Estas bacterias deben cultivarse en medio selectivo (como Campy CV, medio selectivo de carbón o agar desoxicolato de carbón de cefaperazona) e incubarse en condiciones microaerofílicas durante al menos 72 horas a 42 °C, generalmente no se necesita tratamiento con antibióticos, pero se puede usar eritromicina o ciprofloxacino.
Úlceras pépticas
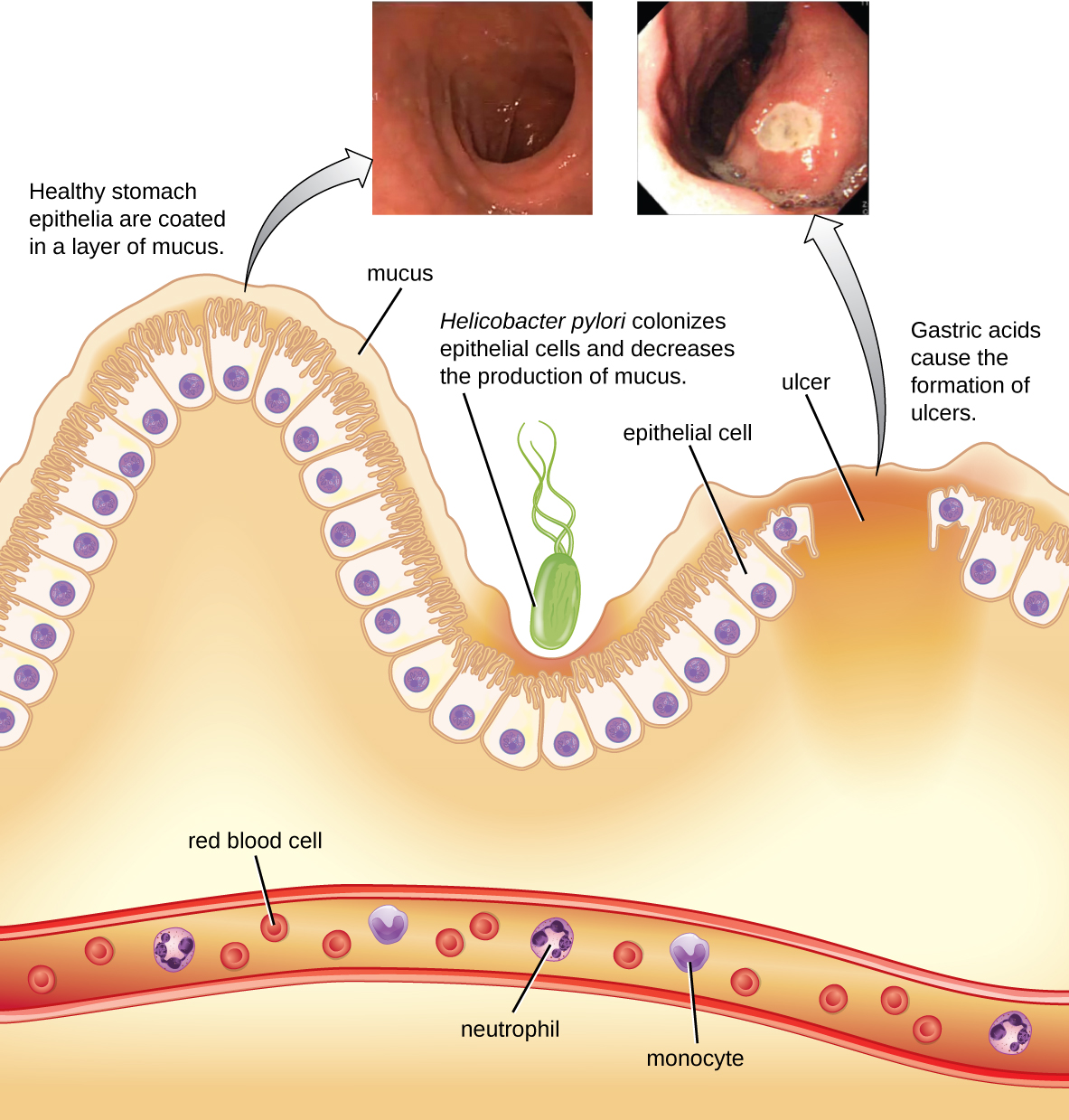
La bacteria gramnegativa Helicobacter pylori es capaz de tolerar el ambiente ácido del estómago humano y se ha demostrado que es una causa importante de úlceras pépticas, que son úlceras del estómago o duodeno. La bacteria también se asocia con un mayor riesgo de cáncer de estómago (Figura\(\PageIndex{5}\)). Según los CDC, aproximadamente dos tercios de la población está infectada con H. pylori, pero menos del 20% tiene riesgo de desarrollar úlceras o cáncer de estómago. H. pylori se encuentra en aproximadamente el 80% de las úlceras estomacales y en más del 90% de las úlceras duodenales. 5
H. pylori coloniza células epiteliales en el estómago usando pili para su adhesión. Estas bacterias producen ureasa, que estimula una respuesta inmune y crea amoníaco que neutraliza los ácidos estomacales para proporcionar un microambiente más hospitalario. La infección daña las células del revestimiento del estómago, incluyendo aquellas que normalmente producen el moco protector que sirve como barrera entre el tejido y el ácido estomacal. Como resultado, se produce inflamación (gastritis) y las úlceras pueden desarrollarse lentamente. La formación de úlceras también puede ser causada por la actividad de la toxina. Se ha reportado que el 50% de los aislados clínicos de H. pylori tienen niveles detectables de actividad de exotoxinas in vitro. 6 Esta toxina, VacA, induce la formación de vacuolas en células hospedadoras. VacA no tiene homología de secuencia primaria con otras toxinas bacterianas, y en un modelo de ratón, existe una correlación entre la presencia del gen de la toxina, la actividad de la toxina y el daño del tejido epitelial gástrico.
Los signos y síntomas incluyen náuseas, falta de apetito, hinchazón, eructos y pérdida de peso. Las úlceras sangrantes pueden producir heces oscuras. Si no se brinda tratamiento, las úlceras pueden volverse más profundas, se pueden involucrar más tejidos y se puede producir perforación estomacal. Debido a que la perforación permite que las enzimas digestivas y el ácido se filtren al cuerpo, es un padecimiento muy grave.
Para diagnosticar la infección por H. pylori se dispone de múltiples métodos. En una prueba de aliento, el paciente traga urea radiomarcada. Si H. pylori está presente, la bacteria producirá ureasa para descomponer la urea. Esta reacción produce dióxido de carbono radiomarcado que se puede detectar en la respiración del paciente. Los análisis de sangre también se pueden utilizar para detectar anticuerpos contra H. pylori. Las bacterias mismas pueden detectarse mediante una prueba de heces o una biopsia de pared estomacal.
Se pueden usar antibióticos para tratar la infección. Sin embargo, exclusiva de H. pylori, la recomendación de la Administración de Alimentos y Medicamentos de Estados Unidos es utilizar una triple terapia. Los protocolos actuales son 10 días de tratamiento con omeprazol, amoxicilina y claritromicina (OAC); 14 días de tratamiento con subsalicilato de bismuto, metronidazol y tetraciclina (BMT); o 10 o 14 días de tratamiento con lansoprazol, amoxicilina y claritromicina (LAC). El omeprazol, el subsalicilato de bismuto y el lansoprazol no son antibióticos sino que se utilizan para disminuir los niveles de ácido porque H. pylori prefiere ambientes ácidos.
Aunque el tratamiento suele ser valioso, también existen riesgos para la erradicación de H. pylori. La infección por H. pylori en realidad puede proteger contra algunos cánceres, como el adenocarcinoma esofágico y la enfermedad por reflujo gastroesofágico. 7 8
Ejercicio\(\PageIndex{6}\)
¿Cómo causa H. pylori úlceras pépticas?
Gastroenteritis por Clostridium perfringens
La gastroenteritis por Clostridium perfringens es una enfermedad generalmente leve transmitida por los alimentos que se asocia con carnes poco cocidas y otros alimentos. C. perfringens es una bacteria anaerobia grampositiva, en forma de varilla, formadora de endosporas que es tolerante a altas y bajas temperaturas. A altas temperaturas, las bacterias pueden formar endosporas que germinarán rápidamente en los alimentos o dentro del intestino. La intoxicación alimentaria por cepas tipo A es común. Esta cepa siempre produce una enterotoxina, a veces también presente en otras cepas, que provoca los síntomas clínicos de calambres y diarrea. Una forma más grave de la enfermedad, llamada pig-bel o enteritis necróticante, causa hemorragia, dolor, vómitos e hinchazón. La gangrena de los intestinos puede resultar. Esta forma tiene una alta tasa de mortalidad pero es rara en Estados Unidos.
El diagnóstico consiste en detectar la toxina de C. perfringens en muestras de heces mediante técnicas de biología molecular (detección por PCR del gen de la toxina) o técnicas de inmunología (ELISA). La bacteria misma también puede detectarse en alimentos o en muestras fecales. El tratamiento incluye terapia de rehidratación, reemplazo de electrolitos y fluidos intravenosos. No se recomiendan los antibióticos porque pueden dañar el equilibrio de la microbiota en el intestino, y existen preocupaciones sobre la resistencia a los antibióticos. La enfermedad se puede prevenir a través del manejo y cocción adecuados de los alimentos, incluida la refrigeración rápida a temperaturas suficientemente bajas y la cocción de los alimentos a una temperatura suficientemente alta.
Clostridium difficile
Clostridium difficile es una varilla grampositiva que puede ser una bacteria comensal como parte de la microbiota normal de individuos sanos. Cuando la microbiota normal se ve alterada por el uso prolongado de antibióticos, puede permitir el crecimiento excesivo de esta bacteria, resultando en diarrea asociada a antibióticos causada por C. difficile. La diarrea asociada a antibióticos también puede considerarse una enfermedad nosocomial. Los pacientes con mayor riesgo de infección por C. difficile son aquellos que están inmunocomprometidos, han estado en entornos de salud por períodos prolongados, son mayores, han tomado recientemente antibióticos, se han realizado procedimientos gastrointestinales o usan inhibidores de la bomba de protones, que reducen la acidez estomacal y permitir la proliferación de C. difficile. Debido a que esta especie puede formar endosporas, puede sobrevivir durante largos períodos de tiempo en el ambiente bajo condiciones adversas y es una preocupación considerable en entornos de salud.
Esta bacteria produce dos toxinas, Clostridium difficile toxina A (TcdA) y Clostridium difficile toxina B (TcdB). Estas toxinas inactivan pequeñas proteínas de unión a GTP, resultando en condensación de actina y redondeo celular, seguido de muerte celular. Las infecciones comienzan con necrosis focal, luego ulceración con exudado, y pueden progresar a colitis pseudomembranosa, lo que implica la inflamación del colon y el desarrollo de una pseudomembrana de fibrina que contiene células epiteliales muertas y leucocitos (Figura\(\PageIndex{6}\)). Pueden resultar diarrea acuosa, deshidratación, fiebre, pérdida de apetito y dolor abdominal. La perforación del colon puede ocurrir, lo que lleva a septicemia, shock y muerte. C. difficile también se asocia con enterocolitis necrotizante en bebés prematuros y enterocolitis neutropénica asociada a terapias contra el cáncer.
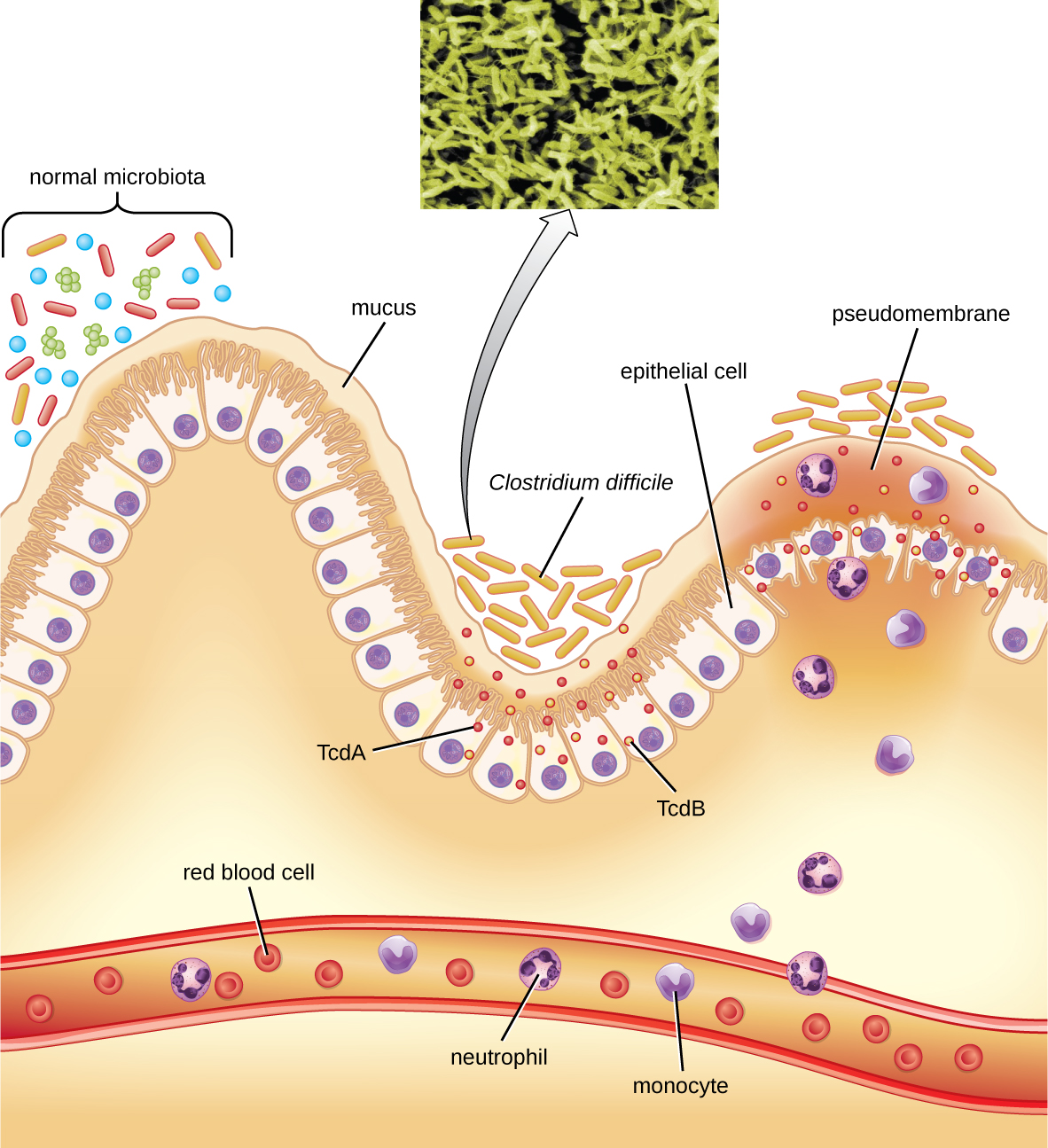
El diagnóstico se realiza considerando la historia del paciente (como la exposición a antibióticos), la presentación clínica, la imagen, la endoscopia, las pruebas de laboratorio y otros datos disponibles. La detección de la toxina en muestras de heces se utiliza para confirmar el diagnóstico. Aunque se prefiere el cultivo, rara vez es práctico en la práctica clínica debido a que la bacteria es un anaerobio obligado. Las pruebas de amplificación de ácidos nucleicos, incluida la PCR, se consideran preferibles a las pruebas ELISA para análisis molecular.
El primer paso del tratamiento convencional es detener el uso de antibióticos, y luego brindar terapia de apoyo con reemplazo de electrolitos y fluidos. El metronidazol es el tratamiento preferido si se ha confirmado el diagnóstico de C. difficile. También se puede usar vancomicina, pero debe reservarse para pacientes para quienes el metronidazol no fue efectivo o que cumplan con otros criterios (por ejemplo, menores de 10 años, embarazadas o alérgicos al metronidazol).
Un nuevo enfoque de tratamiento, conocido como trasplante fecal, se enfoca en restaurar la microbiota del intestino para combatir la infección. En este procedimiento, un individuo sano dona una muestra de heces, la cual se mezcla con solución salina y se trasplanta al receptor mediante colonoscopia, endoscopia, sigmoidoscopia o enema. Se ha reportado que este procedimiento tiene más de 90% de éxito en la resolución de infecciones por C. difficile. 9
Ejercicio\(\PageIndex{7}\)
¿Cómo el uso de antibióticos conduce a infecciones por C. difficile?
Enfermedades transmitidas por alimentos por Bacillus cereus
Bacillus cereus, que se encuentra comúnmente en el suelo, es una bacteria grampositiva formadora de endosporas que a veces puede causar enfermedades transmitidas por los alimentos. Las endosporas de B. cereus pueden sobrevivir a la cocción y producir enterotoxinas en los alimentos después de que se hayan calentado; las enfermedades a menudo ocurren después de comer arroz y otros alimentos preparados que se dejan a temperatura ambiente durante demasiado tiempo. Los signos y síntomas aparecen a las pocas horas de la ingestión e incluyen náuseas, dolor y calambres abdominales. B. cereus produce dos toxinas: una que causa diarrea y la otra que provoca vómitos. A veces se pueden desarrollar signos y síntomas más severos.
El diagnóstico se puede lograr aislando bacterias de muestras de heces o vómitos y alimentos infectados no ingeridos. El tratamiento implica rehidratación y terapia de apoyo. Normalmente no se necesitan antibióticos, ya que la enfermedad suele ser relativamente leve y se debe a la actividad de la toxina.
Enfermedades transmitidas por los alimentos debido a Yersinia
El género Yersinia es mejor conocido por Yersinia pestis, una vara gramnegativa que causa la peste. Sin embargo, Y. enterocolitica e Y. pseudotuberculosis pueden causar gastroenteritis. La infección generalmente se transmite por vía fecal-oral, con ingestión de alimentos o agua que ha sido contaminada por heces. La intoxicación también puede resultar por la actividad de su endotoxina y exotoxinas (enterotoxina y factor necrotizante de citotoxinas). La enfermedad normalmente es relativamente leve y autolimitante. Sin embargo, la diarrea severa y la disentería pueden desarrollarse en los bebés. En adultos, la infección puede propagarse y causar complicaciones como artritis reactiva, trastornos tiroideos, endocarditis, glomerulonefritis, inflamación ocular y/o eritema nudoso. La bacteriemia puede desarrollarse en casos raros.
El diagnóstico generalmente se realiza detectando las bacterias en muestras de heces. También se pueden obtener muestras de otros tejidos o fluidos corporales. El tratamiento suele ser de apoyo, incluyendo la rehidratación, sin antibióticos. Si hay bacteriemia u otra enfermedad sistémica, entonces se pueden usar antibióticos como fluoroquinolonas, aminoglucósidos, doxiciclina y trimetoprim-sulfametoxazol. La recuperación puede tardar hasta dos semanas.
Ejercicio\(\PageIndex{8}\)
Comparar y contrastar enfermedades transmitidas por los alimentos por B. cereus y Yersinia.
Infecciones Bacterianas del Tracto Gastrointestinal
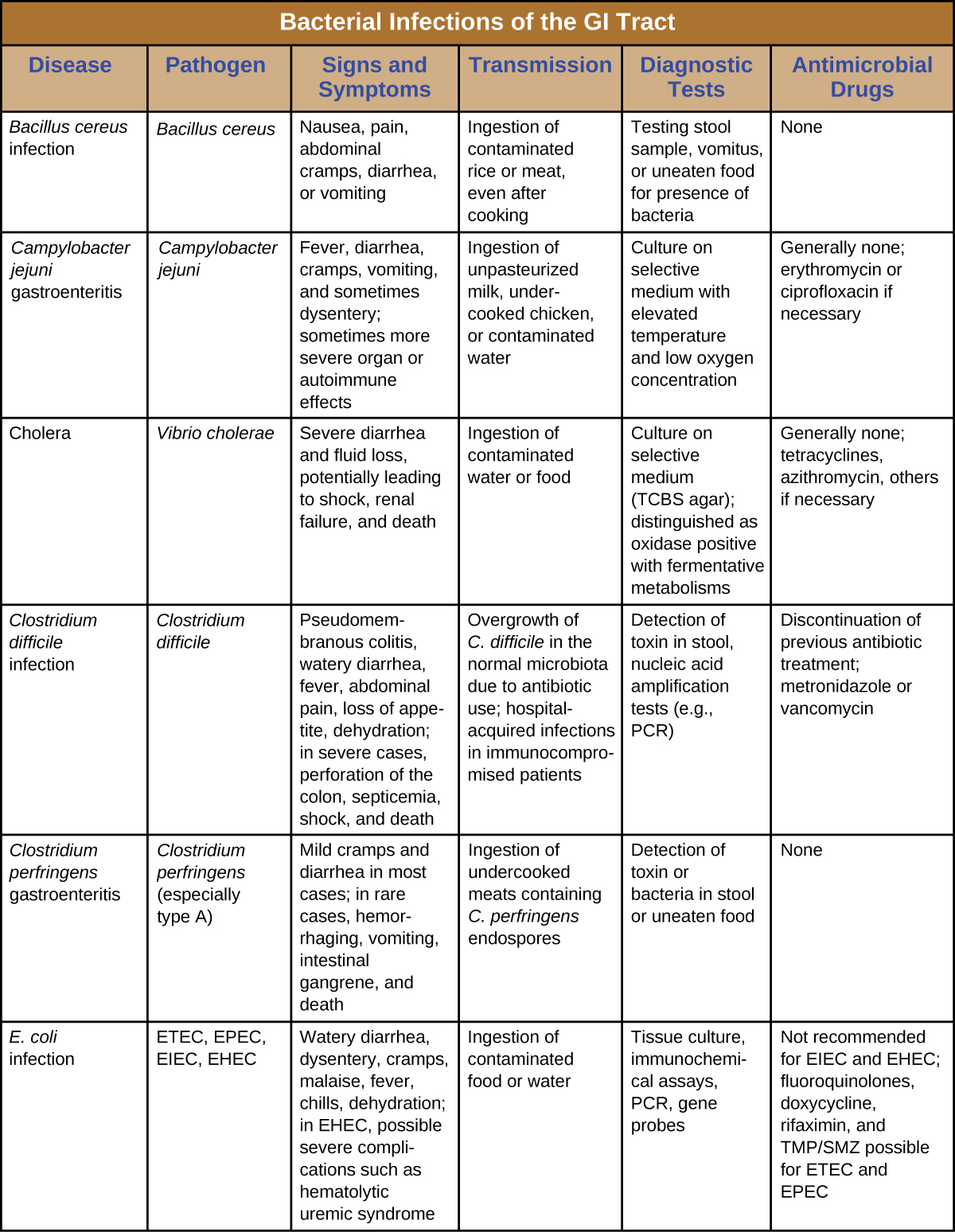
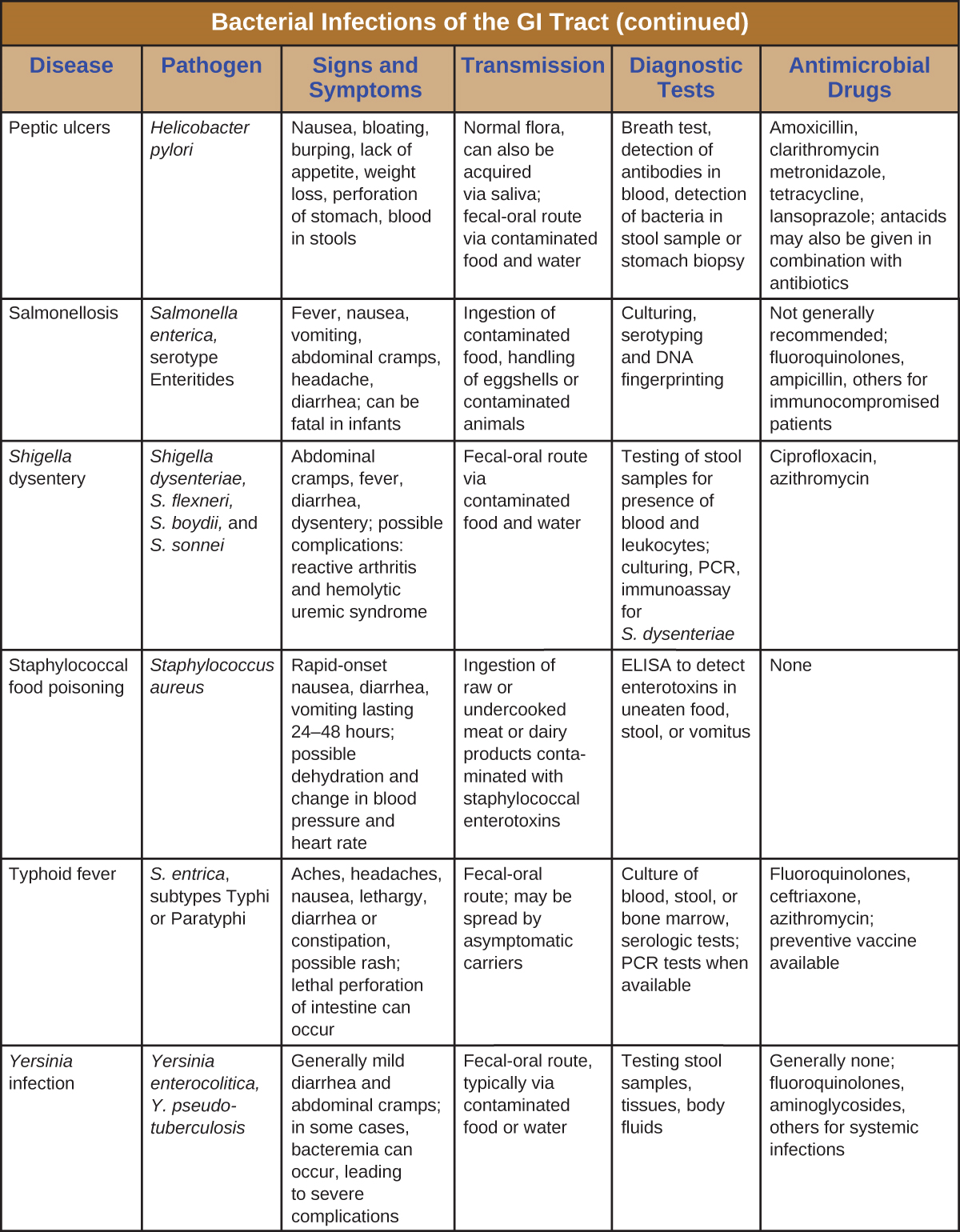
Las infecciones bacterianas del tracto gastrointestinal generalmente ocurren cuando se ingieren bacterias o toxinas bacterianas en alimentos o agua contaminados. Las toxinas y otros factores de virulencia pueden producir inflamación gastrointestinal y síntomas generales como diarrea y vómitos. Las infecciones gastrointestinales bacterianas pueden variar ampliamente en términos de severidad y tratamiento. Algunos pueden ser tratados con antibióticos, pero en otros casos los antibióticos pueden ser ineficaces para combatir toxinas o incluso contraproducentes si comprometen la microbiota GI. Figura\(\PageIndex{7}\) y Figura\(\PageIndex{8}\) las características clave de las infecciones gastrointestinales bacterianas comunes.
Enfoque Clínico: Parte 2
En el hospital, la doctora de Carli comenzó a pensar en las posibles causas de su grave malestar gastrointestinal. Una posibilidad era la intoxicación alimentaria, pero nadie más en su familia estaba enfermo. El médico le preguntó qué había comido Carli el día anterior; su madre mencionó que había comido huevos para el almuerzo, y que tal vez estaban un poco poco cocidos. El médico tomó una muestra de las heces de Carli y la envió para pruebas de laboratorio como parte de su análisis. Ella sospechaba que Carli podría tener un caso de gastroenteritis bacteriana o viral, pero necesitaba conocer la causa para poder prescribir un tratamiento adecuado.
En el laboratorio, los técnicos identificaron microscópicamente bacilos gramnegativos en la muestra de heces de Carli. También establecieron un cultivo puro de la bacteria y la analizaron en busca de antígenos. Esta prueba mostró que el agente causal fue Salmonella.
Ejercicio\(\PageIndex{9}\)
¿Qué debe hacer ahora el médico para tratar a Carli?
Conceptos clave y resumen
- Las principales causas de enfermedades gastrointestinales incluyen Salmonella spp., Staphylococcus spp., Helicobacter pylori, Clostridium perfringens, Clostridium difficile, Bacillus cereus y bacterias Yersinia.
- C. difficile es una causa importante de infección adquirida hospitalaria.
- Vibrio cholerae causa cólera, que puede ser una enfermedad diarreica grave.
- Diferentes cepas de E. coli, incluyendo ETEC, EPEC, EIEC y EHEC, causan diferentes enfermedades con diversos grados de severidad.
- H. pylori se asocia con úlceras pépticas.
- Los serotipos de Salmonella enterica pueden causar fiebre tifoidea, una enfermedad más grave que la salmonelosis.
- La rehidratación y otras terapias de apoyo se utilizan a menudo como tratamientos generales.
- Se requiere un uso cuidadoso de antibióticos para reducir el riesgo de causar infecciones por C. difficile y al tratar infecciones resistentes a antibióticos.
Notas al pie
- 1 Jaya Sureshbabu. “Examen de Infección por Shigella”. Medscape. Actualizado Jun 28, 2016. http://emedicine.medscape.com/article/968773-workup.
- 2 Centros de Control y Prevención de Enfermedades. Salmonella. Actualizado el 25 de agosto de 2016. https://www.cdc.gov/salmonella.
- 3 Kaci Hickox. “Deja de llamarme la 'enfermera del ébola'”. El Guardián. Noviembre 17, 2014. www.theguardian.com/commentis... se-kaci-hickox.
- 4 Centros de Control y Prevención de Enfermedades. Infección por cólera—Vibrio cholerae. Actualizado el 6 de noviembre de 2014. http://www.cdc.gov/cholera/general. Accedido el 14 de septiembre de 2016.
- 5 Centros de Control y Prevención de Enfermedades. “Helicobacter pylori: Hoja informativa para proveedores de atención médica”. Actualizado en julio de 1998. www.cdc.gov/ulcer/files/hpfacts.pdf.
- 6 T. L. Cubierta. “La Citotoxina Vacuolante de Helicobacter pylori”. Microbiología Molecular 20 (1996) 2: pp. 241—246. http://www.ncbi.nlm.nih.gov/pubmed/8733223.
- 7 Martin J. Blaser. “Microbiota Desaparecida: Helicobacter pylori Protección contra el Adenocarcinoma Esofágico”. Investigación en Prevención del Cáncer 1 (2008) 5: pp. 308—311. http://cancerpreventionresearch.aacr....full.pdf+html.
- 8 Ivan F. N. Hung y Benjamín C. Y. Wong. “Evaluación de los Riesgos y Beneficios del Tratamiento de la Infección por Helicobacter pylori”. Avances Terapéuticos en Gastroenterología 2 (2009) 3: pp, 141—147. doi: 10.1177/1756283X08100279.
- 9 Fe Rohlke y Neil Stollman. “Trasplante de Microbiota Fecal en Infección por Clostridium difficile recidivante”, Avances Terapéuticos en Gastroenterología 5 (2012) 6:403—420. doi: 10.1177/1756283X12453637.


