26.2: Enfermedades Bacterianas del Sistema Nervioso
- Page ID
- 54871
Objetivos de aprendizaje
- Identificar las bacterias más comunes que pueden causar infecciones del sistema nervioso
- Comparar las principales características de enfermedades bacterianas específicas que afectan al sistema nervioso
Las infecciones bacterianas que afectan el sistema nervioso son graves y pueden poner en peligro la vida. Afortunadamente, solo hay unas pocas especies bacterianas comúnmente asociadas con infecciones neurológicas.
Meningitis Bacteriana
La meningitis bacteriana es una de las formas más graves de meningitis. Las bacterias que causan meningitis suelen acceder al SNC a través del torrente sanguíneo después de un trauma o como resultado de la acción de toxinas bacterianas. Las bacterias también se pueden propagar desde estructuras en el tracto respiratorio superior, como la orofaringe, la nasofaringe, los senos paranasales y el oído medio. Los pacientes con heridas en la cabeza o implantes cocleares (un dispositivo electrónico colocado en el oído interno) también están en riesgo de desarrollar meningitis.
Muchas de las bacterias que pueden causar meningitis se encuentran comúnmente en personas sanas. Las causas más comunes de meningitis bacteriana no neonatal son Neisseria meningitidis, Streptococcus pneumoniae y Haemophilus influenzae. Los tres patógenos bacterianos se propagan de persona a persona por secreciones respiratorias. Cada uno puede colonizar y atravesar las membranas mucosas de la orofaringe y la nasofaringe, y entrar en la sangre. Una vez en la sangre, estos patógenos pueden diseminarse por todo el cuerpo y son capaces tanto de establecer una infección como de desencadenar inflamación en cualquier sitio del cuerpo, incluyendo las meninges (Figura\(\PageIndex{1}\)). Sin una terapia antibacteriana sistémica adecuada, la tasa de letalidad puede llegar al 70%, y el 20% de los sobrevivientes pueden quedar con daño irreversible en los nervios o destrucción tisular, lo que resulta en pérdida auditiva, discapacidad neurológica o pérdida de una extremidad. Las tasas de mortalidad son mucho menores (tan bajas como 15%) en poblaciones donde se dispone de medicamentos terapéuticos y vacunas preventivas apropiados. 1
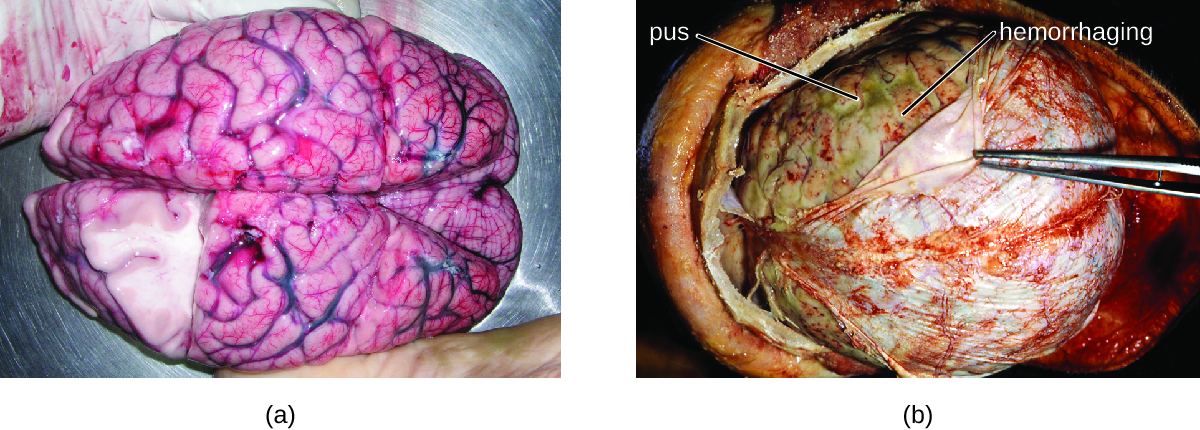
Una variedad de otras bacterias, incluyendo Listeria monocytogenes y Escherichia coli, también son capaces de causar meningitis. Estas bacterias provocan infecciones de la materia aracnoidea y del LCR después de propagarse a través de la circulación en la sangre o por diseminarse a partir de una infección de los senos paranasales o nasofaringe. Streptococcus agalactiae, que se encuentra comúnmente en la microbiota de la vagina y el tracto gastrointestinal, también puede causar meningitis bacteriana en recién nacidos después de la transmisión de la madre ya sea antes o durante el nacimiento.
La profunda inflamación causada por estos microbios puede dar como resultado síntomas tempranos que incluyen dolor de cabeza intenso, fiebre, confusión, náuseas, vómitos, fotofobia y rigidez en el cuello. Las respuestas inflamatorias sistémicas asociadas a algunos tipos de meningitis bacteriana pueden provocar hemorragias y lesiones purpúricas en la piel, seguidas de afecciones aún más graves que incluyen shock, convulsiones, coma y muerte, en algunos casos, en el lapso de solo unas horas.
El diagnóstico de meningitis bacteriana se confirma mejor mediante el análisis de LCR obtenido por punción lumbar. Los niveles anormales de neutrófilos polimorfonucleares (PMN) (> 10 PMNs/mM 3), glucosa (< 45 mg/dL), and protein (> 45 mg/dL) en el LCR son sugestivos de meningitis bacteriana. 2 Las características de las formas específicas de meningitis bacteriana se detallan en las subsecciones que siguen.
Meningocócica
La meningitis meningocócica es una infección grave causada por el coco gramnegativo N. meningitidis. En algunos casos, la muerte puede ocurrir a las pocas horas del inicio de los síntomas. Los casos no fatales pueden resultar en daño irreversible a los nervios, resultando en pérdida auditiva y daño cerebral, o amputación de extremidades debido a necrosis tisular.
La meningitis meningocócica puede infectar a personas de cualquier edad, pero su prevalencia es mayor entre infantes, adolescentes y adultos jóvenes. 3 La meningitis meningocócica fue una vez la causa más común de epidemias de meningitis en poblaciones humanas. Esto sigue siendo el caso en una franja de África subsahariana conocida como el cinturón de meningitis, pero las epidemias de meningitis meningocócica se han vuelto raras en la mayoría de las demás regiones, gracias a las vacunas meningocócicas. Sin embargo, los brotes aún pueden ocurrir en comunidades, escuelas, colegios, prisiones y otras poblaciones donde las personas están en estrecho contacto directo.
N. meningitidis tiene una alta afinidad por las membranas mucosas de la orofaringe y la nasofaringe. El contacto con secreciones respiratorias que contienen N. meningitidis es un modo efectivo de transmisión. La patogenicidad de N. meningitidis se ve potenciada por factores de virulencia que contribuyen a la rápida progresión de la enfermedad. Estos incluyen endotoxina de lipooligosacáridos (LOS), pili tipo IV para la unión a los tejidos del huésped y cápsulas de polisacáridos que ayudan a las células a evitar la fagocitosis y la destrucción mediada por el complemento. Los factores de virulencia adicionales incluyen la proteasa IgA (que descompone los anticuerpos IgA), los factores de invasión Opa, Opc y porina (que facilitan la entrada transcelular a través de la barrera hematoencefálica), los factores de absorción de hierro (que quitan las unidades hemo de la hemoglobina en las células hospedadoras y las usan para el crecimiento) y el estrés proteínas que protegen a las bacterias de las moléculas reactivas de oxígeno.
Un signo único de meningitis meningocócica es la formación de una erupción petequial en la piel o membranas mucosas, caracterizada por lesiones diminutas, rojas, planas, hemorrágicas. Esta erupción, que aparece poco después del inicio de la enfermedad, es una respuesta a la endotoxina LOS y a los factores de virulencia de adherencia que alteran las células endoteliales de los capilares y venas pequeñas en la piel. La alteración de los vasos sanguíneos desencadena la formación de pequeños coágulos sanguíneos, lo que hace que la sangre se filtre en el tejido circundante. A medida que avanza la infección, los niveles de factores de virulencia aumentan y las lesiones hemorrágicas pueden aumentar de tamaño a medida que la sangre continúa filtrándose hacia los tejidos. Las lesiones mayores a 1.0 cm generalmente ocurren en pacientes que desarrollan shock, ya que los factores de virulencia provocan un aumento de la hemorragia y la formación de coágulos. La sepsis, como resultado del daño sistémico por factores de virulencia meningocócica, puede conducir a una rápida insuficiencia orgánica múltiple, shock, coagulación intravascular diseminada y muerte.
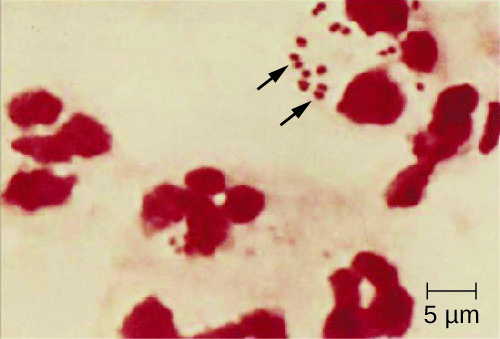
Debido a que la meningitis meningocócica progresa tan rápidamente, se requiere una mayor variedad de especímenes clínicos para la detección oportuna de N. meningitidis. Los especímenes requeridos pueden incluir sangre, LCR, hisopos naso y orofaríngeos, hisopos uretrales y endocervicales, aspirados petequiales y biopsias. Siempre se deben seguir los protocolos de seguridad para el manejo y transporte de especímenes sospechosos de contener N. meningitidis, ya que se han presentado casos de enfermedad meningocócica fatal en trabajadores de la salud expuestos a gotitas o aerosoles de especímenes de pacientes. El diagnóstico presuntivo rápido de meningitis meningocócica puede ocurrir cuando el LCR se evalúa directamente mediante tinción de Gram, revelando diplococos gramnegativos extra e intracelulares con una morfología microscópica distintiva en grano de café asociada a PMN (Figura\(\PageIndex{2}\)). La identificación también se puede hacer directamente a partir de LCR mediante aglutinación de látex y pruebas de diagnóstico rápido inmunocromatográficas específicas para N. meningitidis. La identificación de especies también se puede realizar usando esquemas de tipificación basados en secuencias de ADN para proteínas hipervariables de la membrana externa de N. meningitidis, que ha reemplazado la sero (sub) tipificación.
Las infecciones meningocócicas se pueden tratar con antibióticos, y las cefalosporinas de tercera generación se emplean con mayor frecuencia. Sin embargo, debido a que los resultados pueden ser negativos incluso con el tratamiento, la vacunación preventiva es la mejor forma de tratamiento. En 2010, los países del cinturón de meningitis de África comenzaron a usar una nueva vacuna conjugada meningocócica del serogrupo A. Este programa ha reducido drásticamente el número de casos de meningitis meningocócica al conferir inmunidad individual y colectiva.
Se sabe que existen doce serotipos capsulares diferentes de N. meningitidis. Los serotipos A, B, C, W, X e Y son los más prevalentes a nivel mundial. El CDC recomienda que los niños entre 11 y 12 años de edad sean vacunados con una dosis única de una vacuna cuadrivalente que proteja contra los serotipos A, C, W e Y, con un refuerzo a los 16 años. 4 Se puede administrar un refuerzo adicional o inyecciones de vacuna meningocócica del serogrupo B a individuos en entornos de alto riesgo (como brotes epidémicos en campus universitarios).
Meningitis en el Campus
Los estudiantes universitarios que viven en dormitorios o viviendas comunales tienen un mayor riesgo de contraer meningitis epidémica. De 2011 a 2015, se han registrado al menos nueve brotes meningocócicos en los campus universitarios de Estados Unidos. Estos incidentes involucraron a un total de 43 estudiantes (de los cuales cuatro fallecieron). 5 A pesar de un diagnóstico rápido y tratamiento antimicrobiano agresivo, varios de los sobrevivientes sufrieron amputaciones o problemas neurológicos graves.
La vacunación profiláctica de los estudiantes universitarios de primer año que viven en dormitorios es recomendada por los CDC, y las compañías de seguros ahora cubren la vacunación meningocócica para estudiantes en dormitorios universitarios. Algunas universidades han ordenado la vacunación con vacuna conjugada meningocócica para ciertos estudiantes que ingresan a la universidad (Figura\(\PageIndex{3}\)).
Meningitis neumocócica
La meningitis neumocócica es causada por la bacteria grampositiva encapsulada S. pneumoniae (neumococo, también llamada neumo estreptocócica). Este organismo se encuentra comúnmente en la microbiota de la faringe del 30— 70% de los niños pequeños, dependiendo del método de muestreo, mientras que S. pneumoniae se puede encontrar en menos del 5% de los adultos sanos. Aunque a menudo se presenta sin síntomas de enfermedad, este microbio puede atravesar la barrera hematoencefálica en individuos susceptibles. En algunos casos, también puede resultar en septicemia. Desde la introducción de la vacuna Hib, S. pneumoniae se ha convertido en la principal causa de meningitis en humanos de 2 meses hasta la edad adulta.
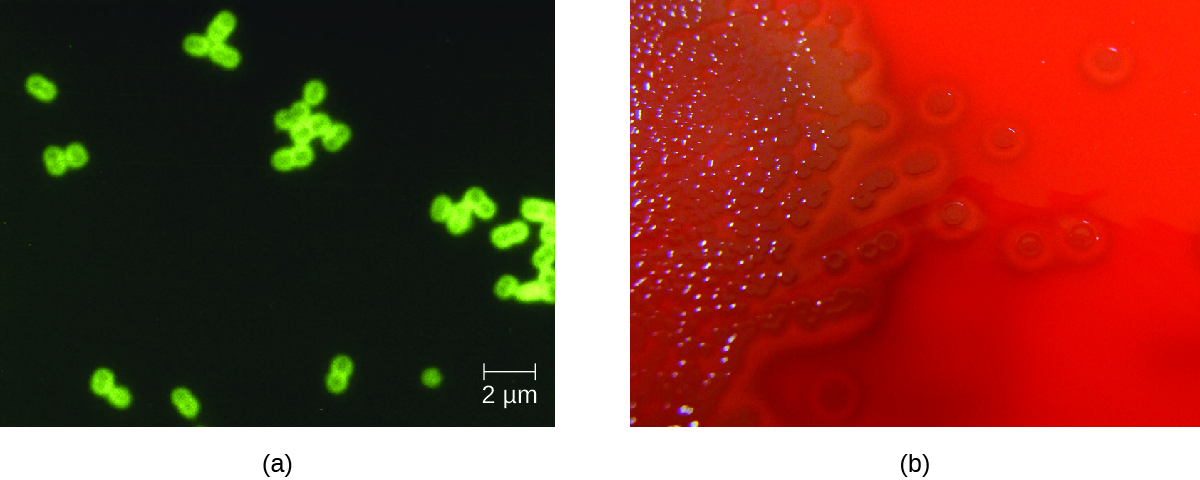
S. pneumoniae se puede identificar en muestras de LCR usando especímenes teñidos con gramos, aglutinación de látex y RDT inmunocromatográfica específica para S. pneumoniae. En muestras gram-teñidas, S. pneumoniae aparece como diplococos grampositivos en forma de lanceta (Figura\(\PageIndex{4}\)). La identificación de S. pneumoniae también se puede lograr usando cultivos de LCR y sangre, y se pueden identificar al menos 93 serotipos distintos basados en la reacción de quellung a polisacáridos capsulares únicos. Los ensayos de PCR y RT-PCR también están disponibles para confirmar la identificación.
Los principales factores de virulencia producidos por S. pneumoniae incluyen PI-1 pilina para adherencia a células hospedadoras (adherencia neumocócica) y factor de virulencia B (pAVb) para la unión a células del tracto respiratorio; proteínas de unión a colina (CbPA) que se unen a células epiteliales e interfieren con factores inmunes IgA y C3; y la toxina citoplasmática bacteriana neumolisina que desencadena una respuesta inflamatoria.
Con la aparición de cepas farmacorresistentes de S. pneumoniae, la meningitis neumocócica se suele tratar con antibióticos de amplio espectro, como levofloxacino, cefotaxima, penicilina u otros antibióticos β-lactámicos. Las dos vacunas neumocócicas disponibles se describen en Infecciones Bacterianas del Tracto Respiratorio.
Haemophilus influenzae Tipo b
La meningitis por H. influenzae serotipo b (Hib), un coccobacilos gramnegativos pleomórficos encapsulados, es ahora poco frecuente en la mayoría de los países, debido al uso de la vacuna efectiva contra Hib. Sin el uso de la vacuna Hib, H. influenzae puede ser la principal causa de meningitis en niños de 2 meses a 5 años de edad. H. influenzae se puede encontrar en la garganta de individuos sanos, incluyendo infantes y niños pequeños. A los cinco años de edad, la mayoría de los niños han desarrollado inmunidad a este microbio. Los bebés mayores de 2 meses de edad, sin embargo, no producen una respuesta suficiente de anticuerpos protectores y son susceptibles a enfermedades graves. La presión intracraneal causada por esta infección conduce a una tasa de mortalidad de 5% y 20% de incidencia de sordera o daño cerebral en sobrevivientes. 6
H. influenzae produce al menos 16 factores de virulencia diferentes, incluyendo LOS, que desencadena la inflamación, y el factor de adhesión y penetración de Haemophilus (Hap), que ayuda en la unión e invasión a las células epiteliales respiratorias. La bacteria también cuenta con una cápsula de polisacárido que le ayuda a evitar la fagocitosis, así como factores como la proteasa IgA1 y la proteína P2 que le permiten evadir los anticuerpos secretados por las membranas mucosas. Además, factores como la proteína de unión a hemoglobina (Hgp) y la proteína de unión a transferrina (Tbp) adquieren hierro de la hemoglobina y la transferrina, respectivamente, para el crecimiento bacteriano.
El diagnóstico preliminar de infecciones por H. influenzae se puede hacer por PCR directa y un frotis de LCR. Los frotis teñidos revelarán PMN intracelulares y extracelulares con cocobacilos pequeños, pleomórficos, gramnegativos o formas filamentosas que son características de H. influenzae. La confirmación inicial de este género puede basarse en su fastidioso crecimiento en agar chocolate. La identificación se confirma con requerimientos de cofactores de crecimiento bioquímicos exógenos NAD y hemo (por MALDI-TOF), aglutinación de látex y RT-PCR.
La meningitis causada por H. influenzae generalmente se trata con doxiciclina, fluoroquinolonas, cefalosporinas de segunda y tercera generación y carbapenémicos. El mejor medio para prevenir la infección por H. influenza es con el uso de la vacuna conjugada de polisacáridos Hib. Se recomienda que todos los niños reciban esta vacuna a los 2, 4 y 6 meses de edad, con una dosis final de refuerzo a los 12 a 15 meses de edad. 7
Meningitis Neonatal
S. agalactiae, estreptococo del Grupo B (GBS), es una bacteria grampositiva encapsulada que es la causa más común de meningitis neonatal, término que se refiere a la meningitis que ocurre en bebés de hasta 3 meses de edad. 8 S. agalactiae también puede causar meningitis en personas de todas las edades y se puede encontrar en la microbiota urogenital y gastrointestinal de alrededor del 10— 30% de los humanos.
La infección neonatal se presenta como enfermedad de inicio temprano o de inicio tardío. La enfermedad de inicio temprano se define como la que ocurre en lactantes de hasta 7 días de edad. El lactante inicialmente se infecta por S. agalactiae durante el parto, cuando la bacteria puede ser transferida de la vagina de la madre. La incidencia de meningitis neonatal de inicio temprano puede reducirse en gran medida administrando antibióticos intravenosos a la madre durante el parto.
La meningitis neonatal de inicio tardío ocurre en lactantes entre 1 semana y 3 meses de edad. Los bebés nacidos de madres con S. agalactiae en el tracto urogenital tienen un mayor riesgo de menigitis de inicio tardío, pero las infecciones de inicio tardío pueden transmitirse de fuentes distintas a la madre; a menudo, se desconoce la fuente de infección. Los bebés que nacen prematuramente (antes de las 37 semanas de embarazo) o de madres que desarrollan fiebre también tienen un mayor riesgo de contraer meningitis neonatal de inicio tardío.
Los signos y síntomas de la enfermedad de inicio temprano incluyen inestabilidad de temperatura, apnea (cese de la respiración), bradicardia (frecuencia cardíaca lenta), hipotensión, dificultad para alimentarse, irritabilidad y cojera. Cuando duerme, el bebé puede ser difícil de despertar. Los síntomas de la enfermedad de inicio tardío son más propensos a incluir convulsiones, fontanela abultada (punto blando), rigidez en el cuello, hemiparesia (debilidad en un lado del cuerpo) y opistotonos (cuerpo rígido con espalda arqueada y cabeza arrojada hacia atrás).
S. agalactiae produce al menos 12 factores de virulencia que incluyen FbSA que se adhiere a las proteínas de la superficie de la célula huésped, PI-1 pilique promueve la invasión de células endoteliales humanas, una cápsula de polisacáridos que impide la activación de la vía alternativa del complemento e inhibe la fagocitosis, y el factor CAMP de toxina, que forma poros en las membranas de las células hospedadoras y se une a anticuerpos IgG e IgM.
El diagnóstico de meningitis neonatal a menudo, pero no de manera uniforme, se confirma con resultados positivos de cultivos de LCR o sangre. Las pruebas incluyen cultivo de rutina, detección de antígenos por inmunoensayo enzimático, serotipado de diferentes tipos de cápsulas, PCR y RT-PCR. Por lo general, se trata con antibióticos β-lactámicos como penicilina intravenosa o ampicilina más gentamicina. Incluso con el tratamiento, se observa aproximadamente 10% de mortalidad en neonatos infectados. 9
Ejercicio\(\PageIndex{1}\)
- ¿Qué grupos son los más vulnerables a cada una de las enfermedades de meningitis bacteriana?
- ¿Para cuál de las enfermedades de meningitis bacteriana hay actualmente disponibles vacunas?
- ¿Qué organismo puede causar meningitis epidémica?
Enfermedades Asociadas al Clostridio
Las especies del género Clostridium son barras grampositivas, formadoras de endosporas que son anaerobios obligados. Las endosporas de Clostridium spp. están muy extendidas en la naturaleza, comúnmente se encuentran en el suelo, el agua, las heces, las aguas residuales y los sedimentos marinos. Clostridium spp. produce más tipos de exotoxinas proteicas que cualquier otro género bacteriano, incluyendo dos exotoxinas con actividad proteasa que son las toxinas biológicas más potentes conocidas: la neurotoxina botulínica (BoNT) y la neurotoxina tetánica (TeNT). Estas dos toxinas tienen dosis letales de 0.2—10 ng por kg de peso corporal.
La BoNT puede ser producida por cepas únicas de C. butyricum y C. baratii; sin embargo, se asocia principalmente con C. botulinum y la condición de botulismo. La carpa, que causa tétanos, solo es producida por C. tetani. Estas poderosas exotoxinas neuronales son los principales factores de virulencia de estos patógenos. El modo de acción de estas toxinas se describió en Factores de Virulencia de Patógenos Bacterianos y Virales y se ilustró en la Figura 15.3.7.
El diagnóstico de tétanos o botulismo generalmente implica bioensayos que detectan la presencia de BoT y TeN en especímenes fecales, sangre (suero) o alimentos sospechosos. Además, tanto C. botulinum como C. tetani pueden aislarse y cultivarse utilizando medios disponibles comercialmente para anaerobios. También están disponibles pruebas ELISA y RT-PCR.
Tétanos
El tétanos es una enfermedad no transmisible caracterizada por espasmos musculares incontrolables (contracciones) causados por la acción de TeN. Generalmente ocurre cuando C. tetani infecta una herida y produce TeNT, que se une rápidamente al tejido neural, resultando en una intoxicación (envenenamiento) de las neuronas. Dependiendo del sitio y extensión de la infección, los casos de tétanos pueden describirse como localizados, cefálicos o generalizados. El tétanos generalizado que ocurre en un recién nacido se llama tétanos neonatal.
El tétanos localizado ocurre cuando TeN solo afecta a los grupos musculares cercanos al sitio de la lesión. No hay afectación del SNC, y los síntomas suelen ser leves, con espasmos musculares localizados causados por una disfunción en las neuronas circundantes. Los individuos con inmunidad parcial, especialmente los vacunados previamente que descuidan recibir las inyecciones de refuerzo recomendadas, tienen más probabilidades de desarrollar tétanos localizado como resultado de que C. tetani infecta una herida punzante.
El tétanos cefálico es una forma rara y localizada de tétanos generalmente asociada con heridas en la cabeza o la cara. En raras ocasiones, se ha presentado en casos de otitis media (infección del oído medio). El tétanos cefálico a menudo da como resultado que los pacientes vean imágenes dobles, debido a los espasmos que afectan a los músculos que controlan el movimiento ocular.
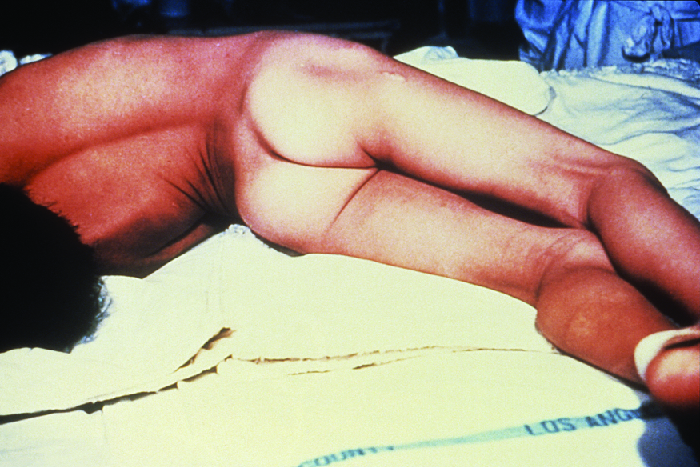
Tanto el tétanos localizado como el cefálico pueden progresar a tétanos generalizados, una afección mucho más grave, si TeN es capaz de propagarse más a los tejidos corporales. En el tétanos generalizado, TeN ingresa a las neuronas del SNP. A partir de ahí, TeN viaja desde el sitio de la herida, generalmente en una extremidad del cuerpo, retrógrada (respaldo) a neuronas inhibidoras en el SNC. Allí, previene la liberación de ácido gamma aminobutírico (GABA), el neurotransmisor responsable de la relajación muscular. Los espasmos musculares resultantes a menudo ocurren primero en los músculos de la mandíbula, lo que lleva al síntoma característico de la mandíbula cerrada (incapacidad para abrir la boca). A medida que la toxina continúa bloqueando progresivamente la liberación de neurotransmisores, otros músculos se involucran, resultando en espasmos musculares incontrolables y repentinos que son lo suficientemente potentes como para provocar que los tendones se rompan y los huesos se fracturen. Los espasmos en los músculos del cuello, la espalda y las piernas pueden hacer que el cuerpo forme un arco rígido y rígido, una postura llamada opistotonos (Figura\(\PageIndex{5}\)). Los espasmos en la laringe, el diafragma y los músculos del tórax restringen la capacidad del paciente para tragar y respirar, lo que finalmente lleva a la muerte por asfixia (suministro insuficiente de oxígeno).
El tétanos neonatal suele ocurrir cuando el muñón del cordón umbilical se contamina con esporas de C. tetani después del parto. Aunque este padecimiento es raro en Estados Unidos, el tétanos neonatal es una de las principales causas de mortalidad infantil en países que carecen de inmunización materna para el tétanos y donde el parto suele ocurrir en condiciones insalubres. Al final de la primera semana de vida, los infantes infectados se vuelven irritables, se alimentan mal y desarrollan rigidez con espasmos. El tétanos neonatal tiene un pronóstico muy malo con una tasa de mortalidad de 70% — 100%. 10
El tratamiento para pacientes con tétanos incluye la respiración asistida mediante el uso de un ventilador, desbridamiento de heridas, balance de líquidos y terapia antibiótica con metronidazol o penicilina para detener el crecimiento de C. tetani. Además, los pacientes son tratados con antitoxina TeNT, preferiblemente en forma de inmunoglobulina humana para neutralizar la toxina no fijada y benzodiazepinas para potenciar el efecto del GABA para la relajación muscular y la ansiedad.
Se dispone de una vacuna contra el toxoide tetánico (TT) para la protección y prevención del tétanos. Es el componente T de vacunas como DTaP, Tdap y Td. Los CDC recomiendan que los niños reciban dosis de la vacuna DTaP a los 2, 4, 6 y 15 a 18 meses de edad y otra a los 4 a 6 años de edad. Se recomienda una dosis de Td para adolescentes y adultos como refuerzo TT cada 10 años. 11
Botulismo
El botulismo es una enfermedad rara pero frecuentemente mortal causada por intoxicación por BoT. Puede ocurrir ya sea como resultado de una infección por C. botulinum, en cuyo caso la bacteria produce BoNT in vivo, o como resultado de una introducción directa de BoNT en los tejidos.
La infección y producción de BoT in vivo puede resultar en botulismo de heridas, botulismo infantil y toxemia intestinal en adultos. El botulismo de la herida generalmente ocurre cuando C. botulinum se introduce directamente en una herida después de una lesión traumática, herida por punción profunda o sitio de inyección. El botulismo infantil, que se presenta en lactantes menores de 1 año de edad, y la toxemia intestinal adulta, que ocurre en adultos inmunodeprimidos, es el resultado de ingerir endosporas de C. botulinum en los alimentos. Las endoesporas germinan en el organismo, resultando en la producción de BoNTs en el tracto intestinal.
Las intoxicaciones ocurren cuando la BoT se produce fuera del cuerpo y luego se introduce directamente en el cuerpo a través de los alimentos (botulismo transmitido por los alimentos), el aire (botulismo por inhalación) o un procedimiento clínico (botulismo iatrogénico). El botulismo de transmisión alimentaria, la más común de estas formas, ocurre cuando la BoT se produce en alimentos contaminados y luego se ingiere junto con la comida (recuérdese Case in Point: A Streak of Bad Potluck). El botulismo por inhalación es raro porque la BoT es inestable como aerosol y no ocurre en la naturaleza; sin embargo, se puede producir en el laboratorio y fue utilizada (sin éxito) como arma biológica por terroristas en Japón en la década de 1990. También se han presentado algunos casos de botulismo por inhalación accidental. El botulismo iatrogénico también es raro; se asocia con inyecciones de BoT utilizadas con fines cosméticos (ver Micro Conexiones: Usos Medicinales de la Toxina Botulínica).
Cuando la BoNT ingresa al torrente sanguíneo en el tracto gastrointestinal, herida o pulmones, se transfiere a las uniones neuromusculares de las neuronas motoras donde se une irreversiblemente a las membranas presinápticas y evita la liberación de acetilcolina desde el terminal presináptico de las neuronas motoras hacia el neuromuscular cruce. La consecuencia de prevenir la liberación de acetilcolina es la pérdida de actividad muscular, lo que lleva a la relajación muscular y eventualmente a la parálisis.
Si la BoT se absorbe a través del tracto gastrointestinal, los primeros síntomas del botulismo incluyen visión borrosa, párpados caídos, dificultad para tragar, calambres abdominales, náuseas, vómitos, estreñimiento o posiblemente diarrea. A esto le sigue la parálisis flácida progresiva, un debilitamiento gradual y pérdida de control sobre los músculos. La experiencia de un paciente puede ser particularmente aterradora, porque la audición sigue siendo normal, no se pierde la conciencia y es plenamente consciente de la progresión de su condición. En los bebés, los signos notables de botulismo incluyen llanto débil, disminución de la capacidad de mamar e hipotonía (flacidez de la cabeza o el cuerpo). Finalmente, el botulismo termina en la muerte por insuficiencia respiratoria causada por la parálisis progresiva de los músculos de la vía aérea superior, el diafragma y el tórax.
El botulismo se trata con una antitoxina específica para la BoT. Si se administra a tiempo, la antitoxina detiene la progresión de la parálisis pero no la revierte. Una vez administrada la antitoxina, el paciente recuperará lentamente la función neurológica, pero esto puede tardar varias semanas o meses, dependiendo de la gravedad del caso. Durante la recuperación, los pacientes generalmente deben permanecer hospitalizados y recibir asistencia respiratoria a través de un ventilador.
Ejercicio\(\PageIndex{2}\)
- ¿Con qué frecuencia se debe actualizar la vacunación contra el tétanos en adultos?
- ¿Cuáles son las causas más comunes del botulismo?
- ¿Por qué el botulismo no se trata con un antibiótico?
Usos medicinales de la toxina botulínica
A pesar de que es el material biológico más tóxico conocido por el hombre, la toxina botulínica a menudo se inyecta intencionalmente en las personas para tratar otras afecciones. La toxina botulínica tipo A se utiliza cosméticamente para reducir las arrugas. La inyección de cantidades diminutas de esta toxina en el rostro provoca la relajación de los músculos faciales, dando así a la piel un aspecto más suave. Las contracciones de los párpados y los ojos cruzados también se pueden tratar con inyecciones de toxina botulínica. Otros usos de esta toxina incluyen el tratamiento de la hiperhidrosis (sudoración excesiva). De hecho, la toxina botulínica puede ser utilizada para moderar los efectos de varias otras enfermedades aparentemente no microbianas que involucran una función nerviosa inapropiada. Tales enfermedades incluyen parálisis cerebral, esclerosis múltiple y enfermedad de Parkinson. Cada una de estas enfermedades se caracteriza por una pérdida de control sobre las contracciones musculares; el tratamiento con toxina botulínica sirve para relajar los músculos contraídos.
Listeriosis
Listeria monocytogenes es una varilla grampositiva no encapsulada, no esporulante y un patógeno de transmisión alimentaria que causa listeriosis. Los grupos de riesgo incluyen mujeres embarazadas, neonatos, ancianos e inmunodeprimidos (recuerde los estudios de caso Clinical Focus en Crecimiento Microbiano y Mecanismos Microbianos de Patogenicidad). La listeriosis conduce a meningitis en aproximadamente 20% de los casos, particularmente neonatos y pacientes mayores de 60 años. El CDC identifica a la listeriosis como la tercera causa principal de muerte por enfermedades transmitidas por alimentos, con tasas de mortalidad global que alcanzan el 16%. 12 En mujeres embarazadas, la listeriosis también puede causar aborto espontáneo en mujeres embarazadas debido a la capacidad única del patógeno para atravesar la placenta.
L. monocytogenes generalmente se introduce en los alimentos por contaminación con tierra o estiércol animal utilizado como fertilizante. Los alimentos comúnmente asociados con la listeriosis incluyen frutas y verduras frescas, verduras congeladas, carnes procesadas, quesos blandos y leche cruda. 13 A diferencia de la mayoría de los otros patógenos transmitidos por los alimentos, la Listeria es capaz de crecer a temperaturas entre 0 °C y 50 °C, y por lo tanto puede continuar creciendo, incluso en alimentos refrigerados.
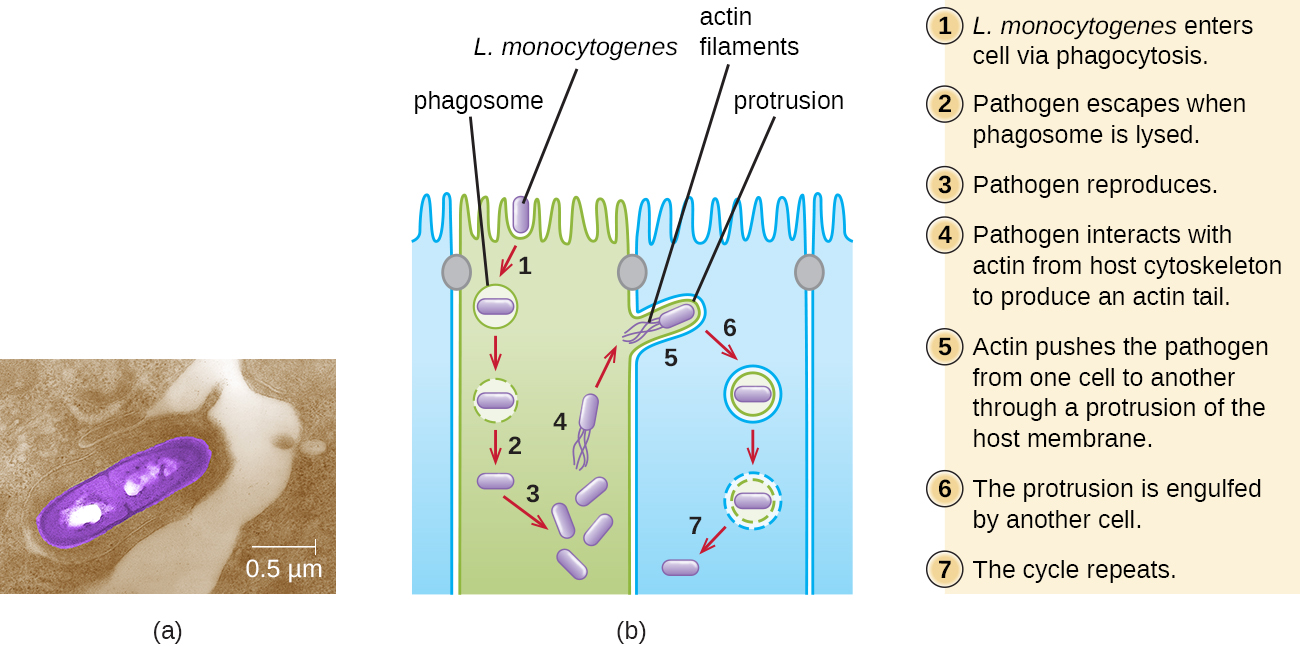
La ingestión de alimentos contaminados conduce inicialmente a la infección del tracto gastrointestinal. Sin embargo, L. monocytogenes produce varios factores de virulencia únicos que le permiten cruzar la barrera intestinal y extenderse a otros sistemas corporales. Las proteínas superficiales llamadas internalinas (InLa e InLB) ayudan a L. monocytogenes a invadir células y tejidos no fagocíticos, penetrando en la pared intestinal y llegando a diseminarse a través de los sistemas circulatorio y linfático. Las internalinas también permiten a L. monocytogenes romper otras barreras importantes, incluyendo la barrera hematoencefálica y la placenta. Dentro de los tejidos, L. monocytogenes utiliza otras proteínas llamadas listeriolisina O y ActA para facilitar el movimiento intercelular, permitiendo que la infección se propague de célula a célula (Figura\(\PageIndex{6}\)).
L. monocytogenes generalmente se identifica mediante el cultivo de muestras de un sitio normalmente estéril (por ejemplo, sangre o LCR). La recuperación de organismos viables puede potenciarse mediante enriquecimiento en frío incubando muestras en un caldo a 4 °C durante una semana o más. La distinción de tipos y subtipos de L. monocytogenes, un paso importante para el diagnóstico y la epidemiología, generalmente se realiza mediante electroforesis en gel de campo pulsado. La identificación también se puede lograr usando ensayos de sondas de ADN de quimioluminiscencia y MALDI-TOF.
El tratamiento para la listeriosis implica terapia antibiótica, más comúnmente con ampicilina y gentamicina. No hay vacuna disponible.
Ejercicio\(\PageIndex{3}\)
¿Cómo ingresa la Listeria al sistema nervioso?
Enfermedad de Hansen (Lepra)
La enfermedad de Hansen (también conocida como lepra) es causada por una bacteria larga, delgada y filamentosa en forma de varilla Mycobacterium leprae, un patógeno intracelular obligado. M. leprae se clasifica como bacteria grampositiva, pero se visualiza mejor microscópicamente con una tinción ácido-resistente y generalmente se la conoce como bacteria ácido-resistente. La enfermedad de Hansen afecta al SNP, provocando daños permanentes y pérdida de apéndices u otras partes del cuerpo.
La enfermedad de Hansen es transmisible pero no altamente contagiosa; aproximadamente el 95% de la población humana no puede infectarse fácilmente porque tiene una inmunidad natural a M. leprae. La transmisión de persona a persona ocurre por inhalación en la mucosa nasal o contacto prolongado y repetido con la piel infectada. Armadillos, uno de los cinco mamíferos susceptibles a la enfermedad de Hansen, también han sido implicados en la transmisión de algunos casos. 14
En el cuerpo humano, M. leprae crece mejor a las temperaturas más frías que se encuentran en los tejidos periféricos como la nariz, los dedos de los pies, los dedos y las orejas. Algunos de los factores de virulencia que contribuyen a la patogenicidad de M. leprae se localizan en la cápsula y la pared celular de la bacteria. Estos factores de virulencia le permiten unirse e invadir las células de Schwann, dando como resultado una desmielinización progresiva que destruye gradualmente las neuronas del SNP. La pérdida de la función neuronal conduce a hipoestesia (entumecimiento) en lesiones infectadas. M. leprae es fagocitado fácilmente por macrófagos pero es capaz de sobrevivir dentro de los macrófagos en parte neutralizando especies reactivas de oxígeno producidas en la explosión oxidativa del fagolisosoma. Al igual que L. monocytogenes, M. leprae también puede moverse directamente entre macrófagos para evitar el aclaramiento por factores inmunes.
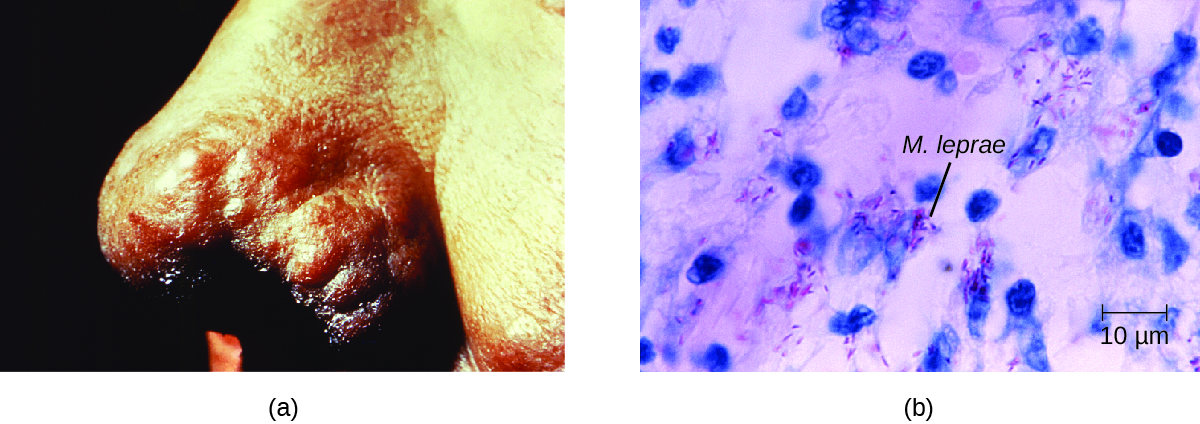
La extensión de la enfermedad está relacionada con la respuesta inmune del paciente. Los síntomas iniciales pueden no aparecer hasta 2 a 5 años después de la infección. Estos suelen comenzar con áreas pequeñas, escaldadas, entumecidas de la piel. En la mayoría de los individuos, estos se resolverán espontáneamente, pero algunos casos pueden progresar a una forma más grave de la enfermedad. La enfermedad tuberculoide (paucibacilar) de Hansen está marcada por la presencia de relativamente pocas (tres o menos) lesiones cutáneas planas y blanqueadas con pequeños nódulos en los bordes y pocas bacterias presentes en la lesión. Aunque estas lesiones pueden persistir durante años o décadas, las bacterias se mantienen bajo control por una respuesta inmune efectiva que incluye citotoxicidad mediada por células. Los individuos que no pueden contener la infección pueden desarrollar posteriormente la enfermedad lepromatosa (multibacilar) de Hansen. Esta es una forma progresiva de la enfermedad caracterizada por nódulos llenos de bacilos ácido-resistentes y macrófagos. La función alterada de las células de Schwann infectadas conduce a daño a los nervios periféricos, lo que resulta en una pérdida sensorial que conduce a úlceras, deformidades y fracturas. El daño al nervio cubital (en la muñeca) por M. leprae es una de las causas más comunes de paralización de la mano. En algunos casos, el daño tisular crónico puede conducir en última instancia a la pérdida de dedos de manos o pies. Cuando también están involucrados los tejidos mucosos, también pueden ocurrir lesiones desfigurantes de la nariz y la cara (Figura\(\PageIndex{7}\)).
La enfermedad de Hansen se diagnostica sobre la base de los signos y síntomas clínicos de la enfermedad, y se confirma por la presencia de bacilos ácido-resistentes en frotis de piel o en muestras de biopsia de piel (Figura\(\PageIndex{7}\)). M. leprae no crece in vitro en ningún medio de laboratorio conocido, pero se puede identificar cultivando in vivo en las almohadillas de los ratones de laboratorio o armadillos. Cuando sea necesario, se puede realizar PCR y genotipado del ADN de M. leprae en tejido humano infectado para diagnóstico y epidemiología.
La enfermedad de Hansen responde bien al tratamiento y, si se diagnostica y se trata a tiempo, no causa discapacidad. En Estados Unidos, la mayoría de los pacientes con la enfermedad de Hansen son atendidos en clínicas ambulatorias de las principales ciudades por el programa National Hansen Disease, la única institución en Estados Unidos dedicada exclusivamente a la enfermedad de Hansen. Desde 1995, la OMS ha puesto la terapia multifarmacológica para la enfermedad de Hansen a disposición de todos los pacientes en todo el mundo de forma gratuita. Como resultado, la prevalencia mundial de la enfermedad de Hansen ha disminuido de aproximadamente 5.2 millones de casos en 1985 a aproximadamente 176,000 en 2014. 15 La terapia multifarmacológica consiste en dapsona y rifampicina para todos los pacientes y un tercer fármaco, clofazimina, para pacientes con enfermedad multibacilar.
Actualmente, no existe una vacuna universalmente aceptada para la enfermedad de Hansen. India y Brasil utilizan una vacuna contra la tuberculosis contra la enfermedad de Hansen porque ambas enfermedades son causadas por especies de Mycobacterium. La efectividad de este método es cuestionable, sin embargo, ya que parece que la vacuna funciona en algunas poblaciones pero no en otras.
Ejercicio\(\PageIndex{4}\)
- ¿Qué impide la progresión de tuberculoide a lepra lepromatosa?
- ¿Por qué la enfermedad de Hansen suele afectar los nervios de las extremidades?
Colonias de leprosos
Enfermedades desfigurantes y mortales como la lepra han sido históricamente estigmatizadas en muchas culturas. Antes de que se entendiera la lepra, las víctimas solían estar aisladas en colonias de leprosos, práctica mencionada frecuentemente en textos antiguos, entre ellos la Biblia. Pero las colonias de leprosos no son sólo un artefacto del mundo antiguo. En Hawai, una colonia de leprosos establecida a finales del siglo XIX persistió hasta mediados del siglo XX, sus residentes se vieron obligados a vivir en condiciones deplorables. 16 Si bien la lepra es una enfermedad transmisible, no se considera contagiosa (fácilmente transmisible), y ciertamente no representa una amenaza suficiente para justificar el aislamiento permanente de sus víctimas. Hoy, reservamos las prácticas de aislamiento y cuarentena a pacientes con enfermedades más peligrosas, como el Ébola o bacterias multirresistentes como Mycobacterium tuberculosis y Staphylococcus aureus. El argumento ético para esta práctica es que aislar a los pacientes infectados es necesario para prevenir la transmisión y propagación de enfermedades altamente contagiosas, incluso cuando va en contra de los deseos del paciente.
Desde luego, es mucho más fácil justificar la práctica de la cuarentena temporal, clínica que la segregación social permanente, como ocurrió en las colonias de leprosos. En la década de 1980, hubo llamados de algunos grupos para establecer campamentos para personas infectadas con SIDA. Aunque esta idea nunca se implementó realmente, plantea la pregunta: ¿dónde trazamos la línea? ¿Los campamentos o colonias de aislamiento permanente son alguna vez médicamente o socialmente justificables? Supongamos que hubo un brote de una enfermedad mortal, contagiosa para la que no hay tratamiento. ¿Sería justificable imponer aislamiento social a quienes padecen la enfermedad? ¿Cómo equilibraríamos los derechos de los infectados con el riesgo que representan para los demás? ¿Hasta qué punto debería esperar la sociedad que los individuos pongan en riesgo su propia salud por el bien de tratar humanamente a los demás?
Infecciones Bacterianas del Sistema Nervioso
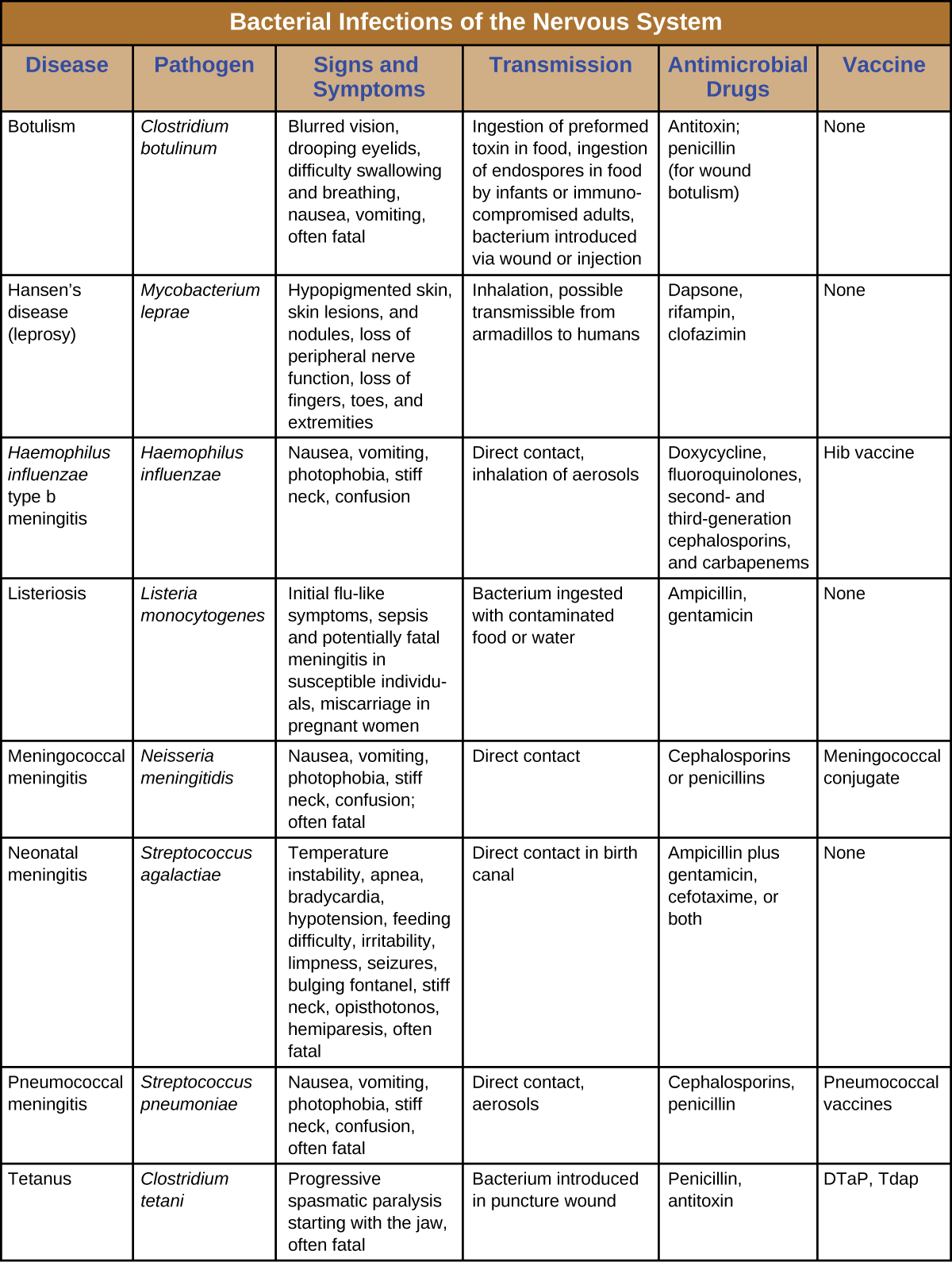
A pesar de las formidables defensas que protegen el sistema nervioso, se sabe que una serie de patógenos bacterianos causan infecciones graves del SNC o SNP. Desafortunadamente, estas infecciones suelen ser graves y potencialmente mortales. La figura\(\PageIndex{8}\) resume algunas infecciones importantes del sistema nervioso.
Conceptos clave y resumen
- La meningitis bacteriana puede ser causada por varias especies de bacterias encapsuladas, incluyendo Haemophilus influenzae, Neisseria meningitidis, Streptococcus pneumoniae y Streptococcus agalactiae (estreptococos del grupo B). H. influenzae afecta principalmente a niños pequeños y neonatos, N. meningitidis es el único patógeno transmisible y afecta principalmente a niños y adultos jóvenes, S. pneumoniae afecta principalmente a niños pequeños y S. agalactiae afecta a recién nacidos durante o poco tiempo después del nacimiento.
- Los síntomas de la meningitis bacteriana incluyen fiebre, rigidez en el cuello, dolor de cabeza, confusión, convulsiones, coma y muerte.
- El diagnóstico de meningitis bacteriana se realiza a través de observaciones y cultivo de organismos en LCR. La meningitis bacteriana se trata con antibióticos. H. influenzae y N. meningitidis tienen vacunas disponibles.
- Las especies de Clostridium causan enfermedades neurológicas, incluyendo botulismo y tétanos, al producir potentes neurotoxinas que interfieren con la liberación de neurotransmisores. El SNP se ve afectado típicamente. El tratamiento de la infección por Clostridium es efectivo solo a través del diagnóstico precoz con la administración de antibióticos para controlar la infección y antitoxinas para neutralizar la endotoxina antes de que ingresen a las células.
- Listeria monocytogenes es un patógeno de transmisión alimentaria que puede infectar el SNC, causando meningitis. La infección se puede propagar a través de la placenta a un feto. El diagnóstico es a través del cultivo de sangre o LCR. El tratamiento es con antibióticos y no hay vacuna.
- La enfermedad de Hansen (lepra) es causada por el parásito intracelular Mycobacterium leprae. Las infecciones causan desmilenación de neuronas, lo que resulta en disminución de la sensación en apéndices periféricos y sitios corporales. El tratamiento es con terapia antibiótica multimedicamentosa, y no existe una vacuna universalmente reconocida.
Notas al pie
- 1 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., “Meningitis bacteriana en Estados Unidos, 1998—2007”, New England Journal of Medicine 364, núm. 21 (2011): 2016-25.
- 2 Popovic, T., et al. Organización Mundial de la Salud, “Manual de Laboratorio para el Diagnóstico de Meningitis Causada por Neisseria meningitidis, Streptococcus pneumoniae, y Haemophilus influenza”, 1999.
- 3 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Enfermedad meningocócica”, 5 de agosto de 2015. Consultado junio 28, 2015. www.cdc.gov/meningococcal/sur... nce/index.html.
- 4 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Horario de inmunización recomendado para personas de 0 a 18 años, Estados Unidos, 2016”, 1 de febrero de 2016. Consultado el 28 de junio de 2016. www.cdc.gov/vacunas/horario... dolescent.html.
- 5 Asociación Nacional de Meningitis, “Brotes de Enfermedades Meningocócicas del Serogroup B en Campus Universitarios de Estados Unidos”, 2016. Consultado el 28 de junio de 2016. http://www.nmaus.org/disease-prevent...ase/outbreaks/.
- 6 Departamento de Salud y Servicios Humanos de Estados Unidos, “Hib (Haemophilus Influenzae Type B)”, Consultado el 28 de junio de 2016. http://www.vaccines.gov/diseases/hib/ #.
- 7 Centros para el Control y la Prevención de Enfermedades de Estados Unidos, “Enfermedades meningocócicas, tendencias de enfermedades”, 2015. Accedido septiembre 13, 2016. www.cdc.gov/meningococcal/sur... nce/index.html.
- 8 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., “Meningitis bacteriana en Estados Unidos, 1998—2007”, New England Journal of Medicine 364, núm. 21 (2011): 2016-25.
- 9 Thigpen, Michael C., Cynthia G. Whitney, Nancy E. Messonnier, Elizabeth R. Zell, Ruth Lynfield, James L. Hadler, Lee H. Harrison et al., “Meningitis bacteriana en Estados Unidos, 1998—2007”, New England Journal of Medicine 364, núm. 21 (2011): 2016-25; Heath, Paul T., Gail Balfour, Abbie M. Weisner, Androulla Efstratiou, Theresa L. Lamagni, Helen Tighe, Liam AF O'Connell et al., “Enfermedad estreptocócica del grupo B en el Reino Unido y los bebés irlandeses menores de 90 días”, The Lancet 363, núm. 9405 (2004): 292-4.
- 10 UNFPA, UNICEF OMS, “Eliminación del tétanos Materno y Neonatal para el 2005”, 2000. www.unicef.org/inmunization/f... tegy_paper.pdf.
- 11 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Vacunación contra el Tétanos” Consultado el 29 de junio de 2016. http://www.cdc.gov/tetanus/vaccination.html.
- 12 Scallan, Elaine, Robert M. Hoekstra, Frederick J. Angulo, Robert V. Tauxe, Marc-Alain Widdowson, Sharon L. Roy, Jeffery L. Jones, y Patricia M. Griffin, “Enfermedades transmitidas por alimentos adquiridas en Estados Unidos: patógenos mayores”, Enfermedades infecciosas emergentes 17, núm. 1 (2011): 7-15.
- 13 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Brotes de Listeria”, 2016. Consultado el 29 de junio de 2016. https://www.cdc.gov/listeria/outbreaks/index.html.
- 14 Sharma, Rahul, Pushpendra Singh, W. J. Loughry, J. Mitchell Lockhart, W. Barry Inman, Malcolm S. Duthie, Maria T. Pena et al., “Lepra zoonótica en el sureste de Estados Unidos”, Enfermedades Infecciosas Emergentes 21, núm. 12 (2015): 2127-34.
- 15 Organización Mundial de la Salud, “Lepra Fact Sheet”, 2016. Accedido el 13 de septiembre de 2016. http://www.who.int/mediacentre/factsheets/fs101/en/.
- 16 Servicio de Parques Nacionales, “Una breve historia de Kalaupapa”, Accedido febrero 2, 2016. www.nps.gov/kala/learn/histor... -kalaupapa.htm.


