26.4: Neuromicosis y Enfermedades Parasitarias del Sistema Nervioso
- Page ID
- 54865
Objetivos de aprendizaje
- Identificar los hongos más comunes que pueden causar infecciones del sistema nervioso
- Comparar las principales características de enfermedades fúngicas específicas que afectan al sistema nervioso
Las infecciones fúngicas del sistema nervioso, llamadas neuromicosis, son raras en individuos sanos. Sin embargo, las neuromicosis pueden ser devastadoras en pacientes inmunodeprimidos o ancianos. Varios parásitos eucariotas también son capaces de infectar el sistema nervioso de los huéspedes humanos. Aunque son relativamente poco frecuentes, estas infecciones también pueden poner en peligro la vida en individuos inmunodeprimidos. En esta sección, primero discutiremos las neuromicosis, seguidas de las infecciones parasitarias del sistema nervioso.
Meningitis Criptocócica
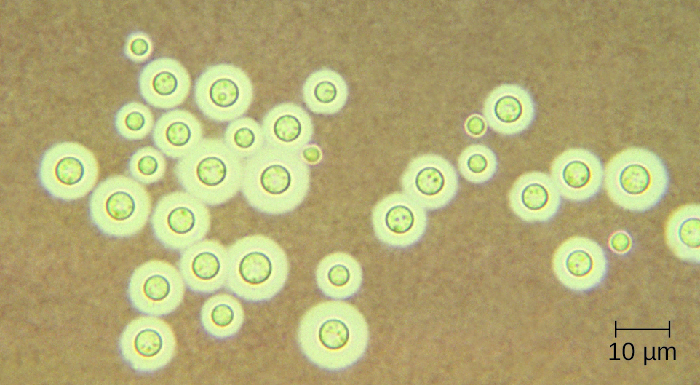
Cryptococcus neoformans es un patógeno fúngico que puede causar meningitis. Esta levadura se encuentra comúnmente en suelos y se asocia particularmente con excrementos de palomas. Tiene una cápsula gruesa que sirve como factor de virulencia importante, inhibiendo el aclaramiento por fagocitosis. La mayoría de los casos de C. neoformans resultan en infecciones respiratorias subclínicas que, en individuos sanos, generalmente se resuelven espontáneamente sin consecuencias a largo plazo (ver Micosis Respiratorias). En pacientes inmunodeprimidos o aquellos con otras enfermedades subyacentes, la infección puede progresar para causar meningitis y formación de granulomas en los tejidos cerebrales. Los antígenos de Cryptococcus también pueden servir para inhibir la inmunidad mediada por células y la hipersensibilidad de tipo retardado.
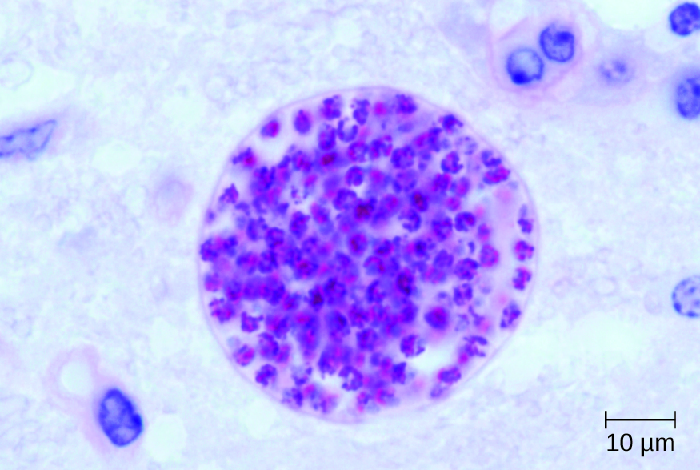
Cryptococcus puede cultivarse fácilmente en el laboratorio e identificarse en base a su extensa cápsula (Figura\(\PageIndex{1}\)). C. neoformans se cultiva frecuentemente a partir de muestras de orina de pacientes con infecciones diseminadas.
Se requiere un tratamiento prolongado con medicamentos antimicóticos para tratar las infecciones criptocócicas. Se requiere terapia combinada con anfotericina B más flucitosina durante al menos 10 semanas. Muchos fármacos antimicóticos tienen dificultad para cruzar la barrera hematoencefálica y tienen fuertes efectos secundarios que requieren dosis bajas; estos factores contribuyen a la larga duración del tratamiento. Los pacientes con SIDA son particularmente susceptibles a las infecciones por Cryptococcus debido a su estado inmune comprometido. Los pacientes con SIDA con criptococosis también pueden ser tratados con medicamentos antifúngicos, pero a menudo tienen recaídas; pueden ser necesarias dosis de fluconazol de por vida para prevenir la reinfección.
Ejercicio\(\PageIndex{1}\)
- ¿Por qué las infecciones por neuromicosis son raras en la población general?
- ¿Cómo se adquiere una infección criptocócica?
Neuromicosis
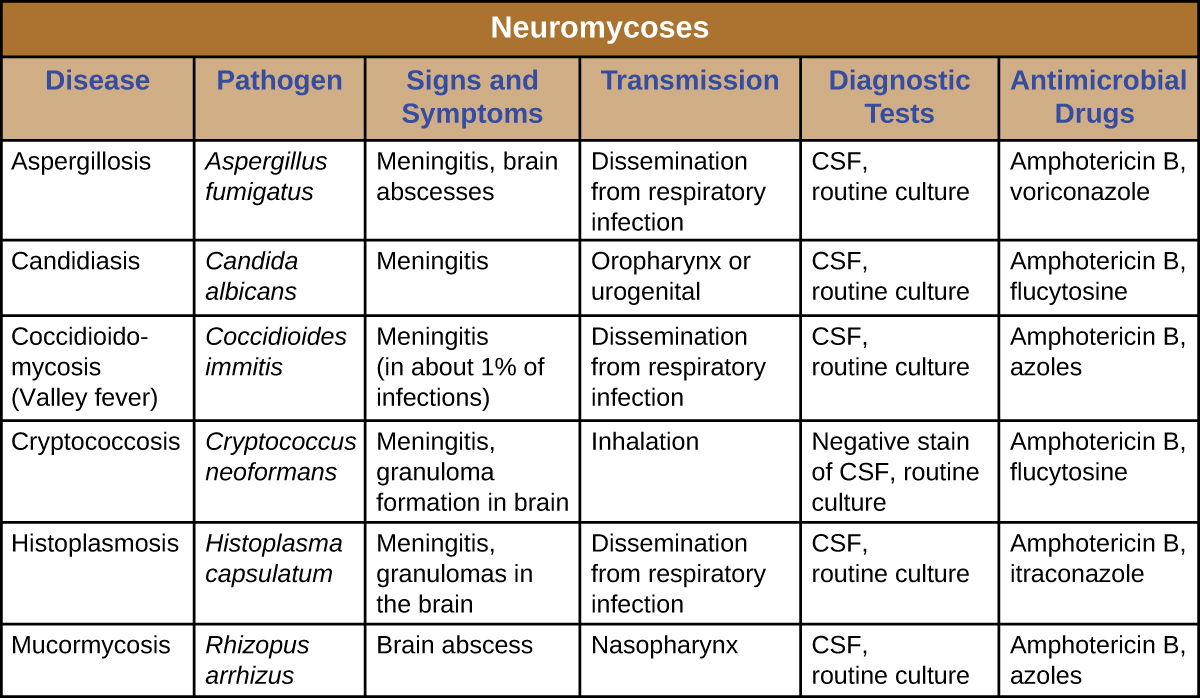
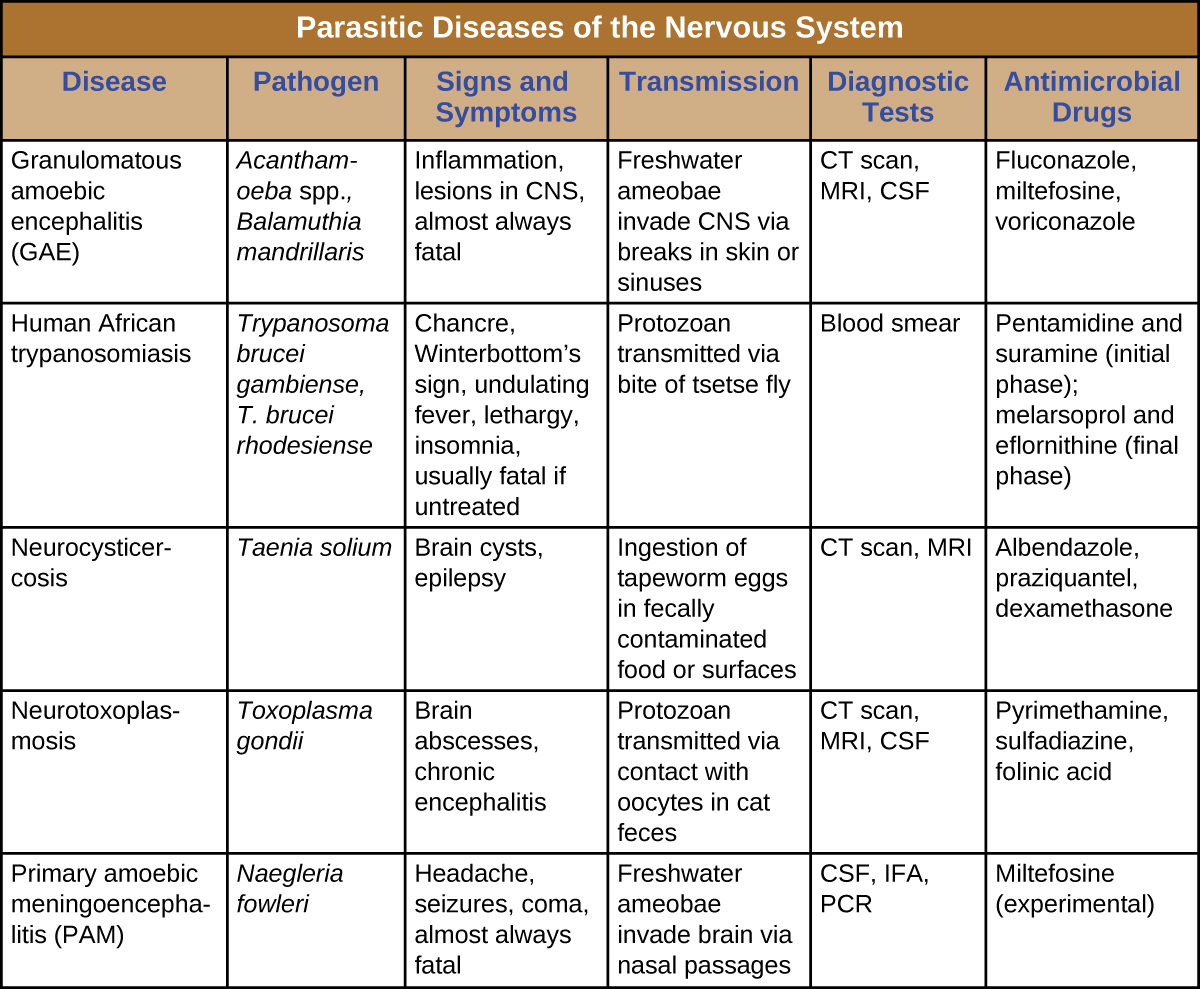
Las neuromicosis suelen ocurrir solo en individuos inmunodeprimidos y generalmente solo invaden el sistema nervioso después de infectar por primera vez un sistema corporal diferente. Como tal, muchas enfermedades que a veces afectan al sistema nervioso ya han sido discutidas en capítulos anteriores. La figura\(\PageIndex{2}\) presenta algunas de las infecciones fúngicas más comunes asociadas a enfermedades neurológicas. Esta tabla incluye únicamente los aspectos neurológicos asociados a estas enfermedades; no incluye características asociadas a otros sistemas corporales.
Foco Clínico: Resolución
La nueva receta de David para dos antimicóticos, anfotericina B y flucitosina, resultó efectiva, y su condición comenzó a mejorar. Los resultados del cultivo de muestras de esputo, piel y LCR de David confirmaron una infección fúngica. Todos fueron positivos para C. neoformans. Las pruebas serológicas de sus tejidos también fueron positivas para el antígeno polisacárido capsular de C. neoformans.
Dado que se sabe que C. neoformans se presenta en excrementos de aves, es probable que David haya estado expuesto al hongo mientras trabajaba en el granero. A pesar de esta exposición, el médico de David le explicó que las personas inmunocompetentes rara vez contraen meningitis criptocócica y que su sistema inmunológico probablemente se había visto comprometido por el medicamento antiinflamatorio que estaba tomando para tratar su enfermedad de Crohn. No obstante, para descartar otras posibles causas de inmunodeficiencia, el médico de David recomendó que se le hiciera la prueba del VIH.
Después de que David dio negativo en la prueba del VIH, su médico le quitó el corticosteroide que estaba usando para manejar su enfermedad de Crohn, reemplazándola por una clase diferente de medicamento. Después de varias semanas de tratamientos antifúngicos, David logró una recuperación completa.
Meningitis amebiana
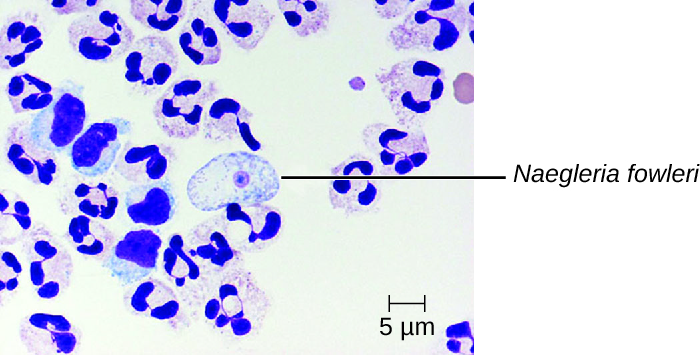
La meningoencefalitis amebiana primaria (PAM) es causada por Naegleria fowleri. Este ameboflagelado se encuentra comúnmente en vida libre en suelos y agua. Puede existir en una de tres formas: la forma de trofozoíto amebiano infeccioso, una forma flagelada móvil y una forma de quiste en reposo. La PAM es una enfermedad rara que se ha asociado con individuos jóvenes y sanos. Los individuos suelen ser infectados por la ameba mientras nadan en cuerpos cálidos de agua dulce como ríos, lagos y aguas termales. El trofozoito patógeno infecta el cerebro ingresando inicialmente a través de las fosas nasales hacia los senos paranasales; luego se mueve hacia abajo por las fibras nerviosas olfativas para penetrar en el plexo nervioso submucoso, invade la placa cribriforme y alcanza el espacio subaracnoideo. El espacio subaracnoideo está altamente vascularizado y es una vía de diseminación de los trofozoítos a otras áreas del SNC, incluyendo el cerebro (Figura\(\PageIndex{3}\)). La inflamación y destrucción de la materia gris conduce a fuertes dolores de cabeza y fiebre. En cuestión de días, ocurren confusión y convulsiones y progresan rápidamente a convulsiones, coma y muerte. La progresión puede ser muy rápida, y la enfermedad a menudo no se diagnostica hasta la autopsia.
Las infecciones por N. fowleri se pueden confirmar mediante la observación directa de LCR; las amebas a menudo se pueden ver moviéndose mientras se ve un montaje húmedo de LCR fresco a través de un microscopio. En ocasiones también se pueden encontrar formas flageladas en el LCR. Las amebas se pueden teñir con varias manchas para su identificación, incluyendo Giemsa-Wright o una tinción tricromática modificada. La detección de antígenos con inmunofluorescencia indirecta, o el análisis genético con PCR, se puede utilizar para confirmar un diagnóstico inicial. Las infecciones por N. fowleri casi siempre son fatales; solo 3 de 138 pacientes con PAM en Estados Unidos han sobrevivido. 1 Un nuevo fármaco experimental llamado miltefosina muestra cierta promesa para tratar estas infecciones. Este fármaco es un derivado de fosfotidilcolina que se cree que inhibe la función de la membrana en N. fowleri, desencadenando la apoptosis y la alteración de las vías de señalización celular dependientes de lípidos. 2 Cuando se administra temprano en la infección y se combina con hipotermia terapéutica (bajando la temperatura central del cuerpo para reducir el edema cerebral asociado a la infección), este medicamento se ha utilizado con éxito para tratar la encefalitis amebiana primaria.
Encefalitis amebiana granulomatosa
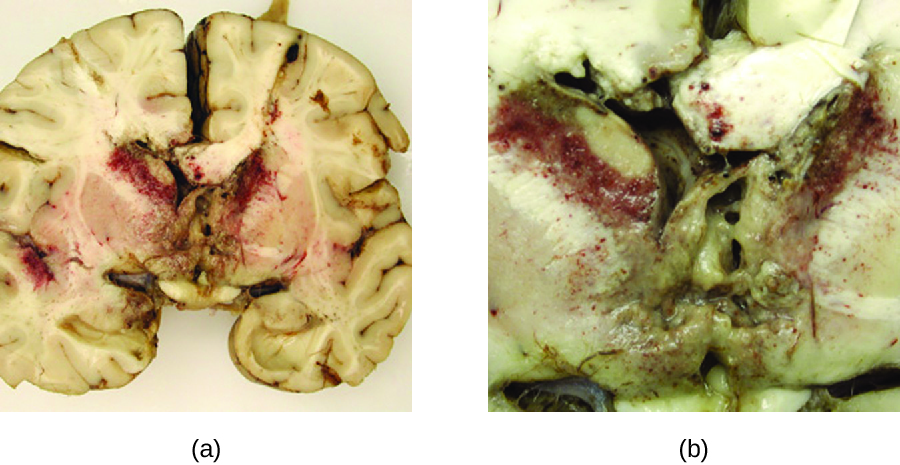
Las especies de Acanthamoeba y Balamuthia son amebas de vida libre que se encuentran en muchos cuerpos de agua dulce. Las infecciones humanas por estas amebas son raras. Sin embargo, pueden causar queratitis amebiana en usuarios de lentes de contacto (ver Infecciones oculares protozoarias y helmínticas), infecciones diseminadas en pacientes inmunodeprimidos y encefalitis amebiana granulomatosa (GAE) en casos severos. En comparación con el PAM, los GAE tienden a ser infecciones subagudas. Se cree que el microbio ingresa a través de los senos nasales o roturas en la piel. Se disemina hematógenamente y puede invadir el SNC. Allí, las infecciones conducen a inflamación, formación de lesiones y desarrollo de síntomas neurológicos típicos de encefalitis (Figura\(\PageIndex{4}\)). El GAE es casi siempre fatal.
A menudo, el GAE no se diagnostica hasta tarde en la infección. Las lesiones causadas por la infección se pueden detectar mediante TC o MRI. Las amebas vivas pueden ser detectadas directamente en LCR o biopsias de tejido. Se dispone de pruebas serológicas pero generalmente no son necesarias para hacer un diagnóstico correcto, ya que la presencia del organismo en el LCR es definitiva. Algunos medicamentos antimicóticos, como el fluconazol, se han utilizado para tratar infecciones por acantamoebales. Además, recientemente se ha utilizado una combinación de miltefosina y voriconazol (un inhibidor de la biosíntesis de ergosterol) para tratar con éxito el GAE. Aún con el tratamiento, sin embargo, la tasa de mortalidad de los pacientes con estas infecciones es alta.
Ejercicio\(\PageIndex{2}\)
¿Cómo se diagnostica la encefalitis amebiana granulomatosa?
Tripanosomiasis Africana Humana
La tripanosomiasis africana humana (también conocida como enfermedad del sueño africana) es una enfermedad grave endémica de dos regiones distintas del África subsahariana. Es causada por el hemoflagelado transmitido por insectos Trypanosoma brucei. La subespecie Trypanosoma brucei rhodesiense causa tripanosomiasis de África Oriental (EAT), y otra subespecie, Trypanosoma brucei gambiense causa tripanosomiasis de África Occidental (WAT). Actualmente se reportan unos cientos de casos de EAT cada año. 3 El WAT se reporta con mayor frecuencia y tiende a ser una enfermedad más crónica. Cada año se identifican alrededor de 7000 a 10,000 nuevos casos de WAT. 4
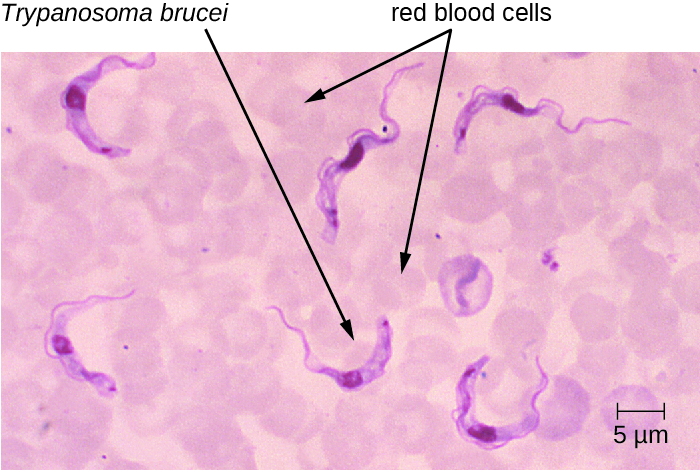
T. brucei se transmite principalmente a los humanos por la picadura de la mosca tsetsé (Glossina spp.). Poco después de la picadura de una mosca tsé, se forma un chancro en el sitio de la infección. Los flagelados luego se propagan, moviéndose hacia el sistema circulatorio (Figura\(\PageIndex{5}\)). Estas infecciones sistémicas dan como resultado una fiebre ondulante, durante la cual los síntomas persisten durante dos o tres días con remisiones de aproximadamente una semana entre los ataques. A medida que la enfermedad entra en su fase final, los patógenos se mueven de los linfáticos al SNC. Los síntomas neurológicos incluyen somnolencia diurna, insomnio y deterioro mental. En EAT, la enfermedad recorre su curso en un lapso de semanas a meses. Por el contrario, el WAT a menudo ocurre en un lapso de meses a años.
Aunque se monta una fuerte respuesta inmune contra el tripanosoma, no es suficiente para eliminar el patógeno. A través de la variación antigénica, el Trypanosoma puede cambiar sus proteínas superficiales en más de 100 tipos serológicos. Esta variación conduce a la forma ondulante de la enfermedad inicial. La septicemia inicial causada por la infección conduce a fiebres altas. A medida que el sistema inmune responde a la infección, el número de organismos disminuye y los síntomas clínicos disminuyen. Sin embargo, una subpoblación del patógeno altera sus antígenos de recubrimiento superficial por variación antigénica y evade la respuesta inmune. Estos flagelados proliferan rápidamente y causan otro ataque de enfermedad. Si no se tratan, estas infecciones suelen ser fatales.
Los síntomas clínicos se pueden utilizar para reconocer los signos tempranos de la tripanosomiasis africana. Estos incluyen la formación de un chancro en el sitio de infección y el signo de Winterbottom. El signo de Winterbottom se refiere al agrandamiento de los ganglios linfáticos en la parte posterior del cuello, a menudo indicativo de infecciones cerebrales. El tripanosoma se puede observar directamente en muestras teñidas que incluyen sangre, linfa, LCR y biopsias cutáneas de chancros de pacientes. Los anticuerpos contra el parásito se encuentran en la mayoría de los pacientes con enfermedad aguda o crónica. Las pruebas serológicas generalmente no se utilizan para el diagnóstico, sin embargo, ya que la detección microscópica del parásito es suficiente. El diagnóstico precoz es importante para el tratamiento. Antes de que el sistema nervioso esté involucrado, se pueden usar medicamentos como la pentamidina (un inhibidor del metabolismo nuclear) y la suramina (mecanismo poco claro). Estos medicamentos tienen menos efectos secundarios que los medicamentos necesarios para tratar la segunda etapa de la enfermedad. Una vez que ha comenzado la fase de enfermedad del sueño, pueden ser efectivos medicamentos más duros como el melarsoprol (un derivado del arsénico) y la eflornitina. Después de un tratamiento exitoso, los pacientes aún necesitan tener exámenes de seguimiento de su LCR durante dos años para detectar posibles recaídas de la enfermedad. El medio más efectivo para prevenir estas enfermedades es controlar las poblaciones de insectos vectores.
Ejercicio\(\PageIndex{3}\)
- ¿Cuál es el síntoma de una infección sistémica por Trypanosoma?
- ¿Cuáles son los síntomas de una infección neurológica por Trypanosoma?
- ¿Por qué son tan difíciles de erradicar las infecciones por tripanosoma?
Neurotoxoplasmosis
Toxoplasma gondii es un parásito intracelular ubicuo que puede causar infecciones neonatales. Los gatos son el huésped definitivo, y los humanos pueden infectarse después de comer carne infectada o, más comúnmente, al ingerir oocistos derramados en las heces de los gatos (ver Infecciones Parasitarias de los Sistemas Circulatorio y Linfático). T. gondii ingresa al sistema circulatorio al pasar entre las células endoteliales de los vasos sanguíneos. 5 La mayoría de los casos de toxoplasmosis son asintomáticos. Sin embargo, en pacientes inmunocomprometidos, la neurotoxoplasmosis causada por infecciones por T. gondii es una de las causas más comunes de abscesos cerebrales. 6 El organismo es capaz de atravesar la barrera hematoencefálica al infectar las células endoteliales de los capilares en el cerebro. El parásito se reproduce dentro de estas células, paso que parece ser necesario para la entrada al cerebro, y luego hace que la célula endotelial se lise, liberando la progenie a los tejidos cerebrales. Este mecanismo es bastante diferente al método que utiliza para ingresar al torrente sanguíneo en primer lugar. 7
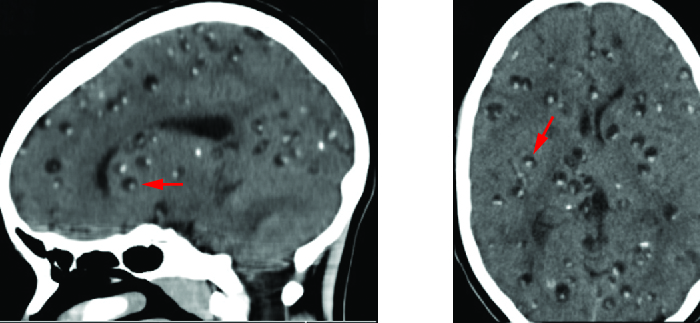
Las lesiones cerebrales asociadas a la neurotoxoplasmosis se pueden detectar radiográficamente mediante MRI o TAC (Figura\(\PageIndex{6}\)). El diagnóstico puede confirmarse mediante la observación directa del organismo en el LCR. También se pueden usar ensayos de RT-PCR para detectar T. gondii a través de marcadores genéticos.
El tratamiento de la neurotoxoplasmosis causada por infecciones por T. gondii requiere seis semanas de terapia multifarmacológica con pirimetamina, sulfadiazina y ácido folínico. A menudo se requieren dosis de mantenimiento a largo plazo para prevenir la recurrencia
Ejercicio\(\PageIndex{4}\)
- ¿En qué condiciones es grave la infección por Toxoplasma?
- ¿Cómo evita el Toxoplasma la barrera hematoencefálica?
Neurocisticercosis
La cisticercosis es una infección parasitaria causada por la forma larvaria de la tenia del cerdo, Taenia solium. Cuando las larvas invaden el cerebro y la médula espinal, la afección se conoce como neurocisticercosis. Esta afección afecta a millones de personas en todo el mundo y es la principal causa de epilepsia de inicio en adultos en el mundo en desarrollo. 8
El ciclo de vida de T. solium se discute en Infecciones Helmínticas del Tracto Gastrointestinal. Después de la ingestión, los huevos eclosionan en el intestino para formar larvas llamadas cisticercos. Las tenias adultas se forman en el intestino delgado y producen huevos que se desprenden en las heces. Estos huevos pueden infectar a otros individuos a través de la contaminación fecal de alimentos u otras superficies. Los huevos también pueden eclosionar dentro del intestino del paciente original y conducir a una autoinfección continua. Los cistercercos, pueden migrar a la sangre e invadir muchos tejidos del cuerpo, incluido el SNC.
La neurocisticercosis generalmente se diagnostica mediante técnicas no invasivas. La información epidemiológica puede ser utilizada como una prueba inicial; la cisticercosis es endémica en América Central y del Sur, África y Asia. La imagen radiológica (resonancia magnética y tomografía computarizada) es el método principal utilizado para diagnosticar la neurocisticercosis; la imagen puede usarse para detectar los quistes de uno a dos centímetros que se forman alrededor de los parásitos (Figura\(\PageIndex{7}\)). Los niveles elevados de eosinófilos en la sangre también pueden indicar una infección parasitaria. También se utilizan EIA y ELISA para detectar antígenos asociados con el patógeno.
El tratamiento de la neurocisticercosis depende de la ubicación, número, tamaño y estadio de los cisticercos presentes. La quimioterapia antihelmíntica incluye albendazol y praziquantel. Debido a que estos fármacos matan quistes viables, pueden aumentar los síntomas de forma aguda al provocar una respuesta inflamatoria causada por la liberación de antígenos de Taenia cysticerci, ya que los quistes son destruidos por los fármacos. Para aliviar esta respuesta, se pueden usar corticosteroides que cruzan la barrera hematoencefálica (p. ej., dexametasona) para mitigar estos efectos. Se puede requerir intervención quirúrgica para extirpar quistes intraventriculares.
Enfermedades Parasitarias del Sistema Nervioso
Los parásitos que invaden con éxito el sistema nervioso pueden causar una amplia gama de signos y síntomas neurológicos. A menudo, infligen lesiones que pueden visualizarse a través de imágenes radiológicas. Algunas de estas infecciones son fatales, pero algunas pueden ser tratadas (con diferentes niveles de éxito) con medicamentos antimicrobianos (Figura\(\PageIndex{8}\)).
Ejercicio\(\PageIndex{5}\)
- ¿Qué condición neurológica se asocia con la neurocisticercosis?
- ¿Cómo se diagnostica la neurocisticercosis?
Conceptos clave y resumen
- Las neuromicosis son poco frecuentes en personas inmunocompetentes, pero los individuos inmunocomprometidos con infecciones fúngicas tienen altas tasas de mortalidad. El tratamiento de las neuromicosis requiere una terapia prolongada con fármacos antifúngicos a dosis bajas para evitar efectos secundarios y superar el efecto de la barrera hematoencefálica.
- Algunas infecciones protistas del sistema nervioso son fatales si no se tratan, incluyendo meningitis amebiana primaria, encefalitis amebiana granulomatosa, tripanosomiasis africana humana y neurotoxoplasmosis.
- Las diversas formas de encefalitis ameóbica causadas por las diferentes infecciones amebianas suelen ser fatales incluso con tratamiento, pero son raras.
- La tripanosomiasis africana es una enfermedad grave pero tratable endémica de dos regiones distintas del África subsahariana causada por el hemoflagelado transmitido por insectos Trypanosoma brucei.
- La neurocisticercosis se trata con fármacos antihelmínticos o cirugía para extirpar los quistes grandes del SNC.
Notas al pie
- 1 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Naegleria fowleri —Meningoencefalitis amebiana primaria (PAM) —Encefalitis amebiana,” 2016. Consultado el 30 de junio de 2016. http://www.cdc.gov/parasites/naegleria/treatment.html.
- 2 Dorlo, Thomas PC, Manica Balasegaram, Jos H. Beijnen, y Peter J. de Vries, “Miltefosina: una revisión de su farmacología y eficacia terapéutica en el tratamiento de la leishmaniasis”, Journal of Antimicrobial Chemotherapy 67, núm. 11 (2012): 2576-97.
- 3 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Parásitos — Tripanosomiasis Africana (también conocida como Enfermedad del Sueño), Preguntas frecuentes sobre Tripanosomiasis de África Oriental”, 2012. Accedido junio 30, 2016. www.cdc.gov/parasites/sleepin... faqs-east.html.
- 4 Centros de Estados Unidos para el Control y la Prevención de Enfermedades, “Parásitos — Tripanosomiasis Africana (también conocida como Enfermedad del Sueño), Epidemiología y Factores de Riesgo”, 2012. Accedido junio 30, 2016. www.cdc.gov/parasites/sleepin... kness/epi.html.
- 5 Carruthers, Vern B., y Yasuhiro Suzuki, “Efectos de la infección por Toxoplasma gondii en el cerebro”, Boletín de Esquizofrenia 33, núm. 3 (2007): 745-51.
- 6 Uppal, Gulshan, “Toxoplasmosis del SNC en el VIH”, 2015. Accedido junio 30, 2016. emedicine.medscape.com/articl... 98-visión general #a3.
- 7 Konradt, Christoph, Norikiyo Ueno, David A. Christian, Jonathan H. Delong, Gretchen Harms Pritchard, Jasmin Herz, David J. Bzik et al., “Las células endoteliales son un nicho replicativo para la entrada de Toxoplasma gondii al sistema nervioso central”, Nature Microbiology 1 (2016): 16001.
- 8 DeGiorgio, Christopher M., Marco T. Medina, Reyna Durón, Chi Zee, y Susan Pietsch Escueta, “Neurocisticercosis”, Corrientes de Epilepsia 4, núm. 3 (2004): 107-11.


