R: Fundamentos de Física y Química Importantes para la Microbiología
- Page ID
- 54843
Como toda otra materia, la materia que comprende microorganismos se rige por las leyes de la química y la física. Las propiedades químicas y físicas de los patógenos microbianos, tanto celulares como acelulares, dictan su hábitat, controlan sus procesos metabólicos y determinan cómo interactúan con el cuerpo humano. Este apéndice proporciona una revisión de algunos de los principios fundamentales de la química y la física que son esenciales para la comprensión de la microbiología. Muchos de los capítulos de este texto —especialmente Bioquímica Microbiana y Metabolismo Microbiano — asumen que el lector ya tiene una comprensión de los conceptos revisados aquí.
Estructura atómica
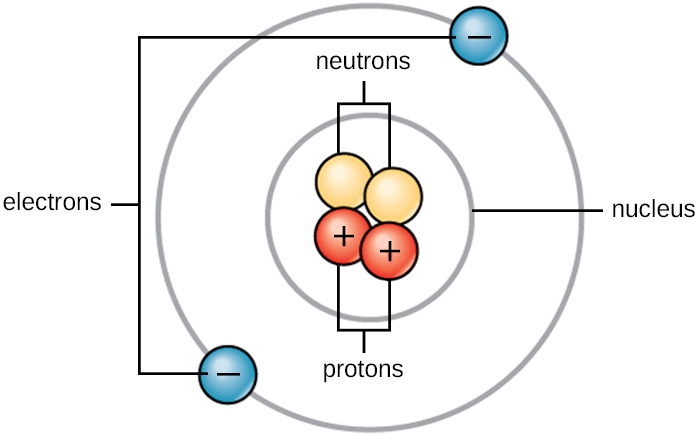
La vida se compone de materia. La materia ocupa espacio y tiene masa. Toda la materia está compuesta por átomos. Todos los átomos contienen protones, electrones y neutrones (Figura\(\PageIndex{1}\)). La única excepción es el hidrógeno (H), que está hecho de un protón y un electrón. Un protón es una partícula cargada positivamente que reside en el núcleo (el núcleo del átomo) de un átomo y tiene una masa de 1 unidad de masa atómica (amu) y una carga de +1. Un electrón es una partícula cargada negativamente que viaja en el espacio alrededor del núcleo. Los electrones se distribuyen en diferentes niveles de energía llamados conchas de electrones. Los electrones tienen una masa insignificante y una carga de —1. Los neutrones, al igual que los protones, residen en el núcleo de un átomo. Tienen una masa de 1 amu y sin carga (neutra). Las cargas positivas (protones) y negativas (electrones) se equilibran entre sí en un átomo neutro, que tiene una carga neta cero. Debido a que los protones y neutrones tienen cada uno una masa de 1 amu, la masa de un átomo es igual al número de protones y neutrones de ese átomo. El número de electrones no tiene en cuenta la masa general porque la masa de electrones es muy pequeña.
Elementos Químicos
Toda la materia está compuesta por átomos de elementos. Los elementos tienen propiedades físicas y químicas únicas y son sustancias que no pueden transformarse fácilmente ni física ni químicamente en otras sustancias. A cada elemento se le ha dado un nombre, generalmente derivado del latín o del inglés. Los elementos también tienen símbolos de una o dos letras que representan el nombre; por ejemplo, sodio (Na), oro (Au) y plata (Ag) tienen abreviaturas derivadas de sus nombres latinos originales natrium, aurum y argentum, respectivamente. Ejemplos con abreviaturas inglesas son carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N). Un total de 118 elementos diferentes (92 de los cuales ocurren naturalmente) han sido identificados y organizados en la tabla periódica de elementos. De los elementos naturales, menos de 30 se encuentran en organismos en la Tierra, y cuatro de ellos (C, H, O y N) constituyen aproximadamente 96% de la masa de un organismo. 1
Cada elemento único se identifica por el número de protones en su núcleo atómico. Además de los protones, el núcleo atómico de cada elemento contiene un número igual o mayor de neutrones (con la excepción del hidrógeno, que solo tiene un protón). El número total de protones por elemento se describe como el número atómico, y la masa combinada de protones y neutrones se denomina masa atómica o número másico. Por lo tanto, es posible determinar el número de neutrones restando el número atómico del número másico.
Los isótopos son diferentes formas del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Muchos elementos tienen varios isótopos con uno o dos isótopos que ocurren comúnmente en la naturaleza.. Por ejemplo, el carbono-12 (12 C), el isótopo más común de carbono (98.6% de todos los C encontrados en la Tierra), 2 contiene seis protones y seis neutrones. Por lo tanto, tiene un número de masa de 12 (6 protones + 6 neutrones) y un número atómico de 6.
Hay dos tipos adicionales de isótopos en la naturaleza: isótopos pesados y radioisótopos. Los isótopos pesados tienen uno o más neutrones adicionales al tiempo que mantienen un núcleo atómico estable. Un ejemplo de isótopo pesado es el carbono-13 (13 C) (1.1% de todo el carbono). 3 13 C tiene un número de masa de 13 (6 protones + 7 neutrones). Dado que el número atómico de 13 C es 6, sigue siendo el elemento carbono; sin embargo, tiene más masa que la forma más común del elemento, 12 C, debido al neutrón extra en el núcleo. Carbono-14 (14 C) (0.0001% de todo el carbono) 4 es un ejemplo de radioisótopo. 14 C tiene un número de masa de 14 (6 protones + 8 neutrones); sin embargo, los neutrones extra en 14 C dan como resultado un núcleo inestable. Esta inestabilidad conduce al proceso de desintegración radiactiva. La desintegración radiactiva implica la pérdida de uno o más neutrones y la liberación de energía en forma de rayos gamma, partículas alfa o partículas beta (dependiendo del isótopo).
Los isótopos pesados y radioisótopos de carbono y otros elementos han demostrado ser útiles en investigación, industria y medicina.
Bonos Químicos
Existen tres tipos de enlaces químicos que son importantes a la hora de describir la interacción de átomos tanto dentro como entre moléculas en microbiología: (1) enlaces covalentes, que pueden ser polares o no polares, (2) enlaces iónicos y (3) enlaces de hidrógeno. Existen otros tipos de interacciones como las fuerzas de dispersión londinenses y las fuerzas de van der Waals que también podrían discutirse al describir las propiedades físicas y químicas de las interacciones intermoleculares de los átomos, pero aquí no incluiremos descripciones de estas fuerzas.
La unión química está determinada por la capa más externa de electrones, llamada electrones de valencia (VE), de un átomo. El número de VE es importante a la hora de determinar el número y tipo de enlaces químicos que formará un átomo.
Enlaces covalentes
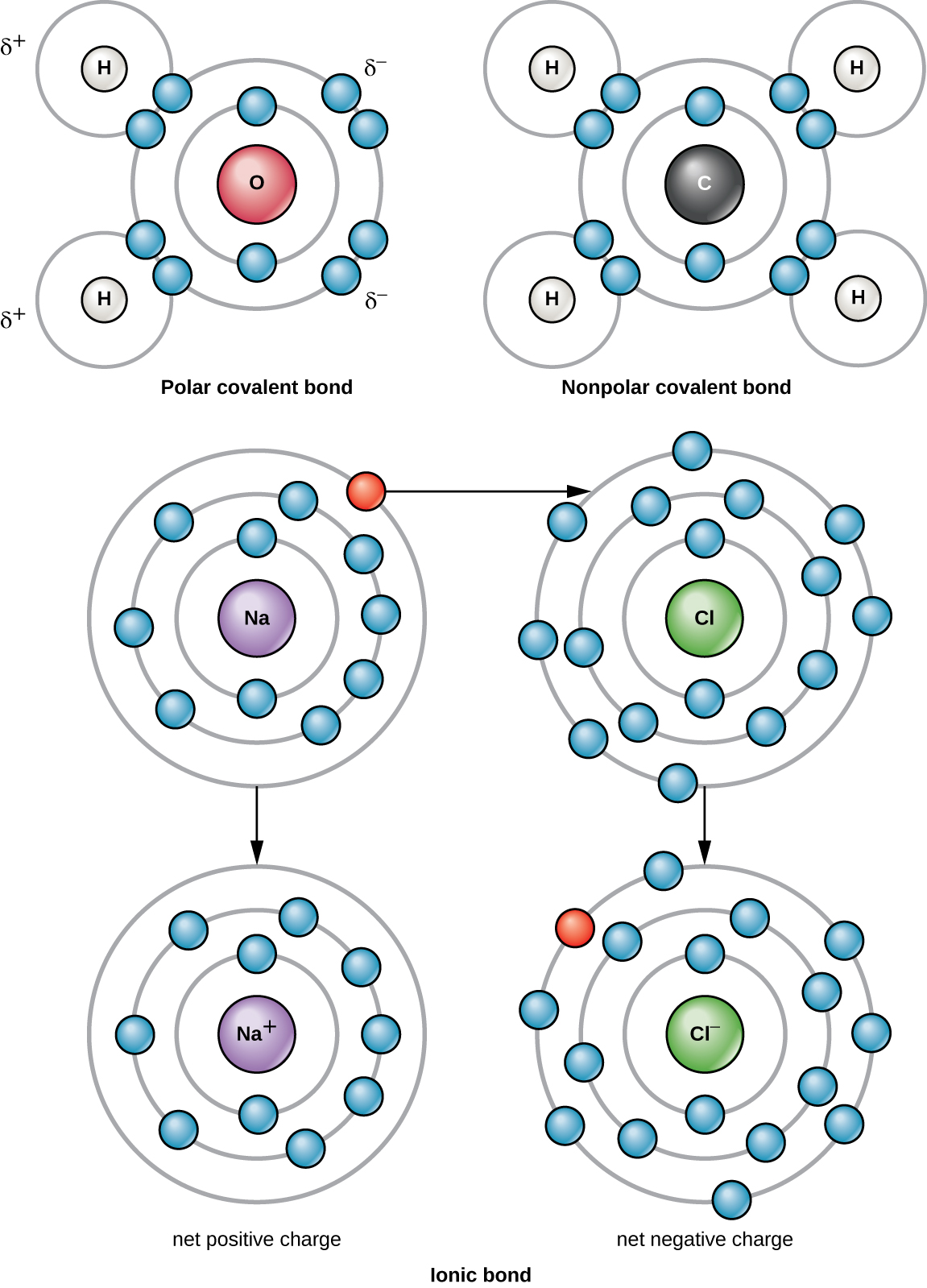
El enlace químico más fuerte entre dos o más átomos es un enlace covalente. Estos enlaces se forman cuando un electrón se comparte entre dos átomos, y estos son la forma más común de enlace químico en los organismos vivos. Se forman enlaces covalentes entre los átomos de los elementos que conforman las moléculas biológicas en nuestras células. Un ejemplo de una molécula simple formada con enlaces covalentes es el agua, H 2 O, con un VE por átomo de H y 6 VE por átomo de O. Debido a la configuración VE, cada átomo de H es capaz de aceptar un VE adicional y cada átomo de O es capaz de aceptar dos VE adicionales. Al compartir electrones, los átomos de hidrógeno y oxígeno que se combinan para formar moléculas de agua se unen entre sí por enlaces covalentes (Figura\(\PageIndex{2}\)). El electrón del átomo de hidrógeno divide su tiempo entre la capa externa del átomo de hidrógeno y la capa electrónica más externa del átomo de oxígeno. Para llenar completamente la capa externa de un átomo de oxígeno, se necesitan dos electrones de dos átomos de hidrógeno, de ahí que el subíndice “2” indique dos átomos de H en una molécula de H 2 O. Esta distribución es un estado de energía más bajo para todos los átomos involucrados que si existieran sin sus capas externas llenas.
Existen dos tipos de enlaces covalentes: polares y no polares. Se forman enlaces covalentes no polares entre dos átomos del mismo o diferentes elementos que comparten los electrones por igual (Figura\(\PageIndex{2}\)). En un enlace covalente polar, los electrones compartidos por los átomos pasan más tiempo más cerca de un núcleo que del otro núcleo. Debido a la distribución desigual de electrones entre los diferentes núcleos, se desarrolla una carga ligeramente positiva (δ+) o ligeramente negativa (δ—). El agua es un ejemplo de una molécula formada con enlaces covalentes polares (Figura\(\PageIndex{2}\)).
Iones y enlaces iónicos
Cuando un átomo no contiene igual número de protones y electrones, se le llama ion. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Los iones positivos se forman al perder electrones y se llaman cationes. Los iones negativos se forman ganando electrones y se llaman aniones.
Por ejemplo, un átomo de sodio solo tiene un electrón en su caparazón más exterior. Se necesita menos energía para que el átomo de sodio done ese electrón que para aceptar siete electrones más, que necesitaría para llenar su capa exterior. Si el átomo de sodio pierde un electrón, ahora tiene 11 protones y sólo 10 electrones, dejándolo con una carga global de +1. Ahora se le llama ion sodio (Na +).
Un átomo de cloro tiene siete electrones en su capa externa. Nuevamente, es más eficiente energéticamente para el átomo de cloro ganar un electrón que perder siete. Por lo tanto, es más probable que gane un electrón para formar un ion con 17 protones y 18 electrones, dándole una carga neta negativa (—1). Ahora se le llama ion cloruro (Cl —). Este movimiento de electrones de un átomo a otro se conoce como transferencia de electrones. Debido a que las cargas positivas y negativas se atraen, estos iones permanecen juntos y forman un enlace iónico, o un enlace entre iones. Cuando los iones Na + y Cl — se combinan para producir NaCl, un electrón de un átomo de sodio permanece con los otros siete del átomo de cloro, y los iones de sodio y cloruro se atraen entre sí en una red de iones con una carga neta cero (Figura\(\PageIndex{2}\)).
Los iones poliatómicos consisten en múltiples átomos unidos por enlaces covalentes; pero a diferencia de una molécula, un ion poliatómico tiene una carga positiva o negativa. Se comporta como un catión o anión y, por lo tanto, puede formar enlaces iónicos con otros iones para formar compuestos iónicos. Los átomos en un ion poliatómico pueden ser del mismo elemento o de diferentes elementos.
En la\(\PageIndex{1}\) tabla se enumeran algunos cationes y aniones que ocurren comúnmente en microbiología. Tenga en cuenta que esta tabla incluye iones monoatómicos así como poliatómicos.
| Cationes | Aniones | ||
|---|---|---|---|
| sodio | Na + | cloruro | Cl — |
| hidrógeno | H + | bicarbonato | \(\ce{HCO3-}\) |
| potasio | K + | carbonato | \(\ce{CO3^2-}\) |
| amonio | \(\ce{NH4+}\) | sulfato de hidrógeno | \(\ce{H2SO4^2-}\) |
| cobre (I) | Cu + | sulfuro de hidrógeno | HS — |
| cobre (II) | Cu 2+ | hidróxido | OH — |
| hierro (II) | Fe 2+ | hipoclorito | ClO — |
| hierro (III) | Fe 3+ | nitrito | \(\ce{NO2-}\) |
| nitrato | \(\ce{NO3-}\) | ||
| peróxido | \(\ce{O2^2-}\) | ||
| fosfato | \(\ce{PO4^3-}\) | ||
| pirofosfato | \(\ce{P2O7^4-}\) | ||
| sulfito | \(\ce{SO3^2-}\) | ||
| tiosulfato | \(\ce{S2O3^2-}\) | ||
Fórmula molecular, masa molecular y el topo
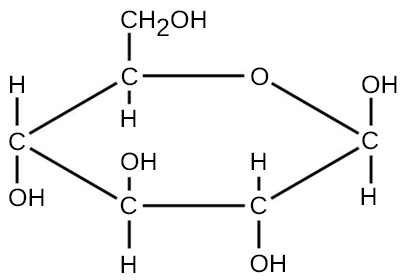
Para las moléculas formadas por enlaces covalentes, la fórmula molecular representa el número y tipos de átomos elementales que componen la molécula. Como ejemplo, considere una molécula de glucosa, que tiene la fórmula molecular C 6 H 12 O 6. Esta fórmula molecular indica que una sola molécula de glucosa está formada por seis átomos de carbono, doce átomos de hidrógeno y seis átomos de oxígeno.
La masa molecular de una molécula se puede calcular usando la fórmula molecular y la masa atómica de cada elemento en la molécula. El número de cada tipo de átomo se multiplica por la masa atómica; luego se agregan los productos para obtener la masa molecular. Por ejemplo, la masa molecular de la glucosa, C 6 H 12 O 6 (Figura\(\PageIndex{3}\)), se calcula como:
\ [\ begin {array} {l}
\ text {masa de carbono} & =12\:\ frac {\ mathrm {amu}} {\ mathrm {atom}}\ times 6\ text {atoms} =72\ text {amu}\
\ text {masa de hidrógeno} & =1\:\ frac {\ mathrm {amu}} {\ mathrm {átomo}}\ 12 veces\ texto {átomos} =12\ texto {amu}\\
\ texto {masa de oxígeno} & ; =16\:\ frac {\ mathrm {amu}} {\ mathrm {átomo}}\ veces 6\ texto {átomos} =96\ texto {amu}\
\ texto {masa molecular de glucosa} & =72\ texto {amu} +12\ texto {amu} +96\ texto {amu} =180\ texto {amu}
\ end {array}\]
Se ha determinado experimentalmente que el número de entidades que componen un mol es 6.022 × 10 23, una constante fundamental llamada número de Avogadro (NA) o la constante de Avogadro. Esta constante se reporta adecuadamente con una unidad explícita de “por mol”.
Energía
La termodinámica se refiere al estudio de la energía y la transferencia de energía que involucra la materia física.
La materia que participa en un caso particular de transferencia de energía se llama sistema, y todo lo que está fuera de esa materia se llama el entorno. Existen dos tipos de sistemas: abierto y cerrado. En un sistema abierto, la energía se puede intercambiar con su entorno. Un sistema cerrado no puede intercambiar energía con su entorno. Los organismos biológicos son sistemas abiertos. La energía se intercambia entre ellos y su entorno ya que utilizan la energía del sol para realizar la fotosíntesis o consumen moléculas de almacenamiento de energía y liberan energía al ambiente haciendo trabajo y liberando calor. Como todas las cosas en el mundo físico, la energía está sujeta a las leyes físicas. En general, la energía se define como la capacidad de hacer trabajo, o de crear algún tipo de cambio. La energía existe en diferentes formas. Por ejemplo, la energía eléctrica, la energía luminosa y la energía térmica son todos diferentes tipos de energía. La primera ley de la termodinámica, a menudo referida como la ley de conservación de la energía, establece que la cantidad total de energía en el universo es constante y conservada. La energía existe en muchas formas diferentes. Según la primera ley de la termodinámica, la energía puede transferirse de un lugar a otro o transformarse en diferentes formas, pero no puede crearse ni destruirse.
El reto para todos los organismos vivos es obtener energía de su entorno en formas que puedan transferir o transformar en energía utilizable para hacer el trabajo. Los microorganismos han evolucionado para hacer frente a este reto. La energía química almacenada dentro de moléculas orgánicas como azúcares y grasas se transfiere y transforma a través de una serie de reacciones químicas celulares en energía dentro de moléculas de ATP. La energía en las moléculas de ATP es fácilmente accesible para hacer el trabajo. Ejemplos de los tipos de trabajo que las células necesitan hacer incluyen construir moléculas complejas, transportar materiales, impulsar el movimiento de cilios o flagelos y contraer fibras musculares para crear movimiento.
Las tareas primarias de un microorganismo de obtener, transformar y usar energía para hacer el trabajo pueden parecer simples. No obstante, la segunda ley de la termodinámica explica por qué estas tareas son más difíciles de lo que parecen. Todas las transferencias y transformaciones de energía nunca son completamente eficientes. En cada transferencia de energía, se pierde cierta cantidad de energía en una forma que es inutilizable. En la mayoría de los casos, esta forma es energía térmica. Termodinámicamente, la energía térmica se define como la energía transferida de un sistema a otro que no es trabajo. Por ejemplo, se pierde algo de energía como energía térmica durante las reacciones metabólicas celulares.
Cuanta más energía pierde un sistema a su entorno, menos ordenado y más aleatorio es el sistema. Los científicos se refieren a la medida de aleatoriedad o trastorno dentro de un sistema como entropía. Alta entropía significa trastorno alto y baja energía. Las moléculas y las reacciones químicas también tienen entropía variable. Por ejemplo, la entropía aumenta a medida que las moléculas a alta concentración en un lugar se difunden y se extienden. La segunda ley de la termodinámica dice que la energía siempre se perderá como calor en las transferencias o transformaciones de energía. Los microorganismos están altamente ordenados, requiriendo un aporte constante de energía para mantenerse en un estado de baja entropía.
Reacciones Químicas
Las reacciones químicas ocurren cuando dos o más átomos se unen para formar moléculas o cuando los átomos unidos se rompen. Las sustancias utilizadas en una reacción química se llaman los reactivos (generalmente se encuentran en el lado izquierdo de una ecuación química), y las sustancias producidas por la reacción se conocen como los productos (generalmente se encuentran en el lado derecho de una ecuación química). Normalmente se dibuja una flecha entre los reactivos y los productos para indicar la dirección de la reacción química; esta dirección no siempre es una “calle unidireccional”.
Un ejemplo de una reacción química simple es la descomposición de las moléculas de peróxido de hidrógeno, cada una de las cuales consiste en dos átomos de hidrógeno unidos a dos átomos de oxígeno (H 2 O 2). El reactivo peróxido de hidrógeno se descompone en agua, que contiene un átomo de oxígeno unido a dos átomos de hidrógeno (H 2 O), y oxígeno, que consiste en dos átomos de oxígeno unidos (O 2). En la siguiente ecuación, la reacción incluye dos moléculas de peróxido de hidrógeno y dos moléculas de agua. Este es un ejemplo de una ecuación química equilibrada, en donde el número de átomos de cada elemento es el mismo en cada lado de la ecuación. De acuerdo con la ley de conservación de la materia, el número de átomos antes y después de una reacción química debe ser igual, de tal manera que ningún átomo sea, en circunstancias normales, creado o destruido.
\[\ce{2H2O2\:(hydrogen\: peroxide)⟶2H2O\:(water) + O2\:(oxygen)}\]
Algunas reacciones químicas, como la mostrada anteriormente, pueden continuar en una dirección hasta que todos los reactivos se agotan. Las ecuaciones que describen estas reacciones contienen una flecha unidireccional y son irreversibles. Las reacciones reversibles son aquellas que pueden ir en cualquier dirección. En las reacciones reversibles, los reactivos se convierten en productos, pero cuando la concentración de producto se eleva por encima de un cierto umbral (característico de la reacción particular), algunos de estos productos se convertirán de nuevo en reactivos; en este punto, se invierten las designaciones de productos y reactivos. Los cambios en la concentración continúan hasta que se produce un cierto equilibrio relativo en la concentración entre los reactivos y los productos, un estado llamado equilibrio químico. En este punto, continúan ocurriendo tanto las reacciones directa como la inversa, pero lo hacen a la misma velocidad, por lo que las concentraciones de reactivos y productos no cambian. Estas situaciones de reacciones reversibles a menudo se denotan por una ecuación química con una flecha de doble punta apuntando tanto hacia los reactivos como hacia los productos. Por ejemplo, cuando el dióxido de carbono se disuelve en agua, puede hacerlo como un gas disuelto en agua o reaccionando con agua para producir ácido carbónico. En las células de algunos microorganismos, la velocidad de producción de ácido carbónico es acelerada por la enzima anhidrasa carbónica, como se indica en la siguiente ecuación:
\[\ce{CO2 + H2O \stackrel{carbonic}{\stackrel{anhydrase}{\rightleftharpoons}} H2CO3 \rightleftharpoons H+ + HCO3-}\]
Propiedades de Agua y Soluciones
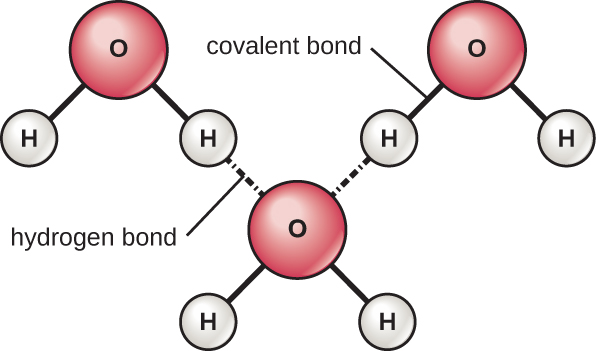
Los átomos de hidrógeno y oxígeno dentro de las moléculas de agua forman enlaces covalentes polares. No hay carga general a una molécula de agua, pero hay uno + en cada átomo de hidrógeno y dos — en el átomo de oxígeno. Cada molécula de agua atrae a otras moléculas de agua debido a las cargas positivas y negativas en las diferentes partes de la molécula (Figura\(\PageIndex{4}\)). El agua también atrae a otras moléculas polares (como los azúcares), formando enlaces de hidrógeno. Cuando una sustancia forma fácilmente enlaces de hidrógeno con el agua, puede disolverse en agua y se la conoce como hidrófila (“amante del agua”). Los enlaces de hidrógeno no se forman fácilmente con sustancias no polares como aceites y grasas. Estos compuestos no polares son hidrófobos (“temerosos del agua”) y se orientarán lejos y evitarán el agua.
Los enlaces de hidrógeno en el agua le permiten absorber y liberar energía térmica más lentamente que muchas otras sustancias. Esto significa que el agua modera los cambios de temperatura dentro de los organismos y en sus ambientes. A medida que la entrada de energía continúa, el equilibrio entre la formación de enlaces de hidrógeno y la ruptura se balancea hacia menos enlaces de hidrógeno: se rompen más enlaces de los que se forman. Este proceso da como resultado la liberación de moléculas de agua individuales en la superficie del líquido (como un cuerpo de agua, las hojas de una planta o la piel de un organismo) en un proceso llamado evaporación.
Por el contrario, a medida que el movimiento molecular disminuye y las temperaturas disminuyen, hay menos energía presente para romper los enlaces de hidrógeno entre las moléculas de agua. Estos enlaces permanecen intactos y comienzan a formar una estructura rígida similar a una celosía (por ejemplo, hielo). Cuando se congela, el hielo es menos denso (las moléculas están más separadas) que el agua líquida. Esto significa que el hielo flota en la superficie de un cuerpo de agua. En lagos, estanques y océanos, se formará hielo en la superficie del agua, creando una barrera aislante para proteger la vida animal y vegetal debajo de la congelación en el agua. Si esto no sucediera, las plantas y animales que viven en el agua se congelarían en un bloque de hielo y no podrían moverse libremente, haciendo que la vida en temperaturas frías sea difícil o imposible.
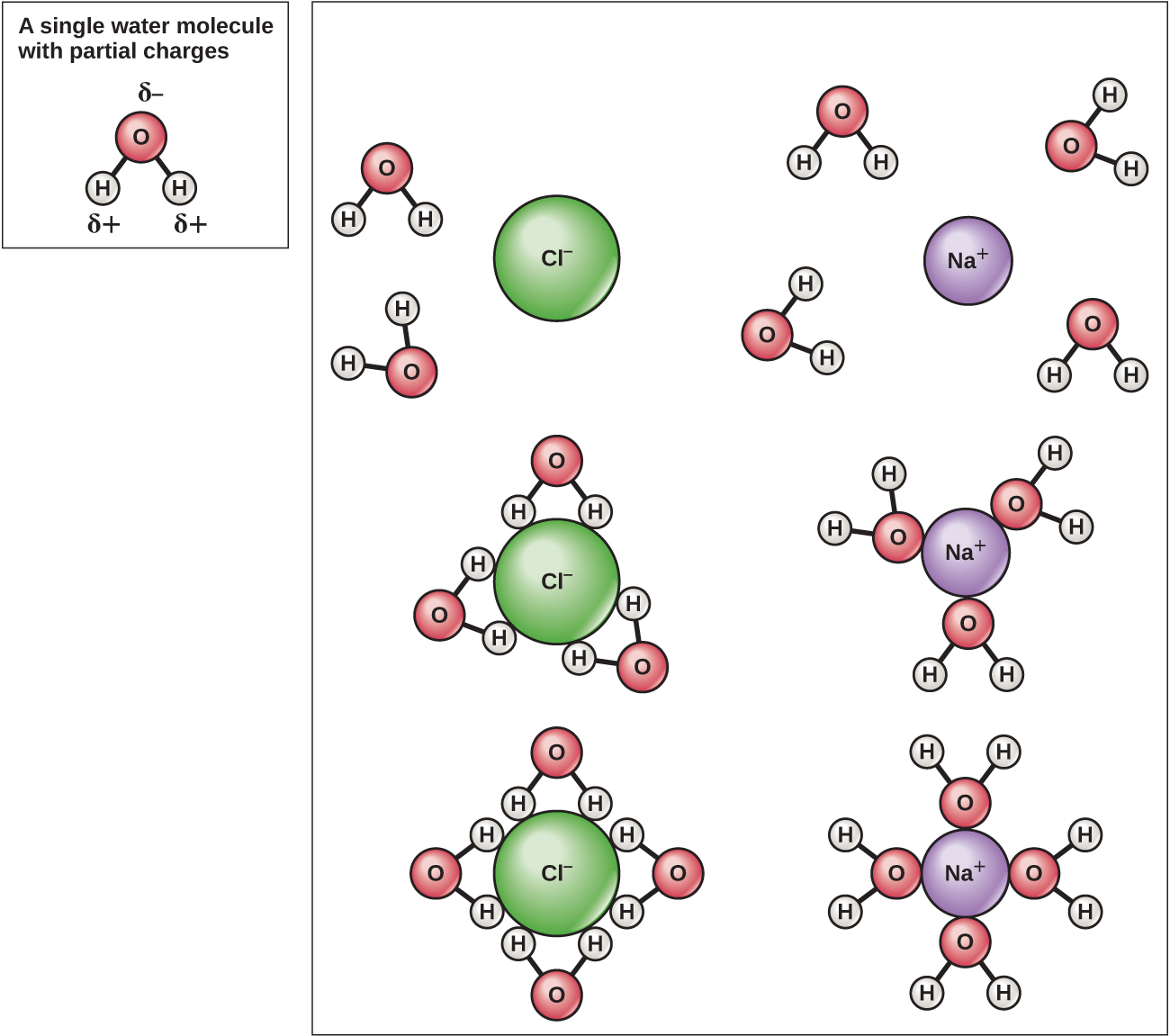
Debido a que el agua es polar, con ligeras cargas positivas y negativas, los compuestos iónicos y las moléculas polares pueden disolverse fácilmente en ella. El agua es, por lo tanto, lo que se denomina disolvente, una sustancia capaz de disolver otra sustancia. Las partículas cargadas formarán enlaces de hidrógeno con una capa circundante de moléculas de agua. Esto se conoce como una esfera de hidratación y sirve para mantener los iones separados o dispersos en el agua (Figura\(\PageIndex{5}\)). Estas esferas de hidratación también se conocen como conchas de hidratación. La polaridad de la molécula de agua la convierte en un solvente efectivo y es importante en sus múltiples roles en los sistemas vivos.
La capacidad de los insectos para flotar y patinar sobre el agua del estanque es el resultado de la propiedad de cohesión. En cohesión, las moléculas de agua son atraídas entre sí (debido a los enlaces de hidrógeno), manteniendo las moléculas juntas en la interfaz líquido-aire (gas). La cohesión da lugar a la tensión superficial, la capacidad de una sustancia para soportar la ruptura cuando se coloca bajo tensión o tensión.
Estas fuerzas cohesivas también están relacionadas con la propiedad de adhesión del agua, o la atracción entre las moléculas de agua y otras moléculas. Esto se observa cuando el agua “sube” por una pajita colocada en un vaso de agua. Notarás que el agua parece estar más alta en los lados de la paja que en el medio. Esto se debe a que las moléculas de agua son atraídas por la paja y por lo tanto se adhieren a ella.
La cohesión y adhesión también son factores en las colonias bacterianas y la formación de biopelículas. La cohesión mantiene intacta la colonia (ayuda a que se “pegue” a una superficie), mientras que la adhesión mantiene las células adheridas entre sí. Las fuerzas cohesivas y adhesivas son importantes para mantener la vida útil. Por ejemplo, debido a estas fuerzas, el agua en el entorno natural proporciona las condiciones necesarias para permitir que las células bacterianas y arqueales se adhieran y acumulen en las superficies.
Ácidos y Bases
El pH de una solución es una medida de las concentraciones de iones hidrógeno (H +) e ión hidróxido (OH —) y se describe como acidez o alcalinidad, respectivamente. La acidez y alcalinidad (también conocida como basicidad) se pueden medir y calcular. El pH puede ser simplemente representado por la ecuación matemática,\(\mathrm{pH=-\log_{10}[H^+]}\). En el lado izquierdo de la ecuación, la “p” significa “el logaritmo negativo de" y la H representa la [H +]. En el lado derecho de la ecuación, [H +] es la concentración de H + en moles/L. Lo que no se representa en esta sencilla ecuación es el aporte del OH —, que también participa en la acidez o alcalinidad. El cálculo del pH da como resultado un rango numérico de 0 a 14 denominado escala de pH (Figura\(\PageIndex{6}\)). Un valor de pH entre 0 y 6.9 indica un ácido. También se le conoce como un pH bajo, debido a una concentración alta de [H +] y baja [OH —]. Un valor de pH entre 7.1 y 14 indica un álcali o base. También se le conoce como un pH alto, debido a una concentración baja de [H +] y alta [OH —]. Un pH de 7 se describe como un pH neutro y ocurre cuando [H +] es igual a [OH —].

Un cambio de una unidad en la escala de pH representa un cambio en el [H +] por un factor de 10, un cambio en dos unidades representa un cambio en el [H +] por un factor de 100. Así, pequeños cambios en el pH representan grandes cambios en [H +].
Notas al pie
- 1 Schrijver, Karel e Iris Schrijver. Vivir con las estrellas: cómo se conecta el cuerpo humano con los ciclos de vida de la Tierra, los planetas y las estrellas. Oxford University Press, Estados Unidos, 2015.
- 2 Administración Nacional Oceánica y Atmosférica, “Isótopos Estables y de Radiocarbono del Dióxido de Carbono”. Página web. Accedido feb 19, 2016 [http://www.esrl.noaa.gov/gmd/outreac...hemistry.html]
- 3 ibíd.
- 4 ibíd.


