9.3: Flujo de Carga en Baterías y Pilas de Combustible
- Page ID
- 81806
Componentes de la batería
Se debe considerar el flujo de cargas tanto positivas como negativas para entender el funcionamiento de las baterías y las pilas de combustible. La batería más simple contiene solo un ánodo, cátodo y electrolito. Estos componentes se ilustran en la Fig. \(\PageIndex{1}\).
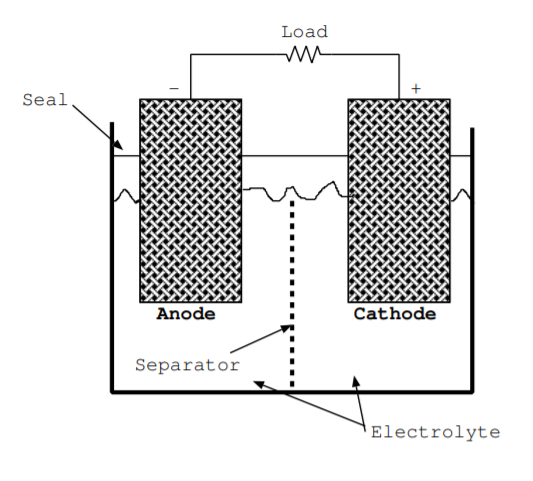
Ambos electrodos deben ser buenos conductores. A menudo son porosos para aumentar la superficie donde se produce la reacción. El cátodo es un sumidero de electrones e iones positivos, y ambos tipos de cargas son atraídos hacia este terminal. El cátodo es el electrodo positivo de una batería de descarga. El ánodo es fuente de electrones e iones positivos, y ambos tipos de cargas fluyen lejos del ánodo. El ánodo es el electrodo negativo de una batería de descarga.
El electrolito tiene alta conductividad iónica pero baja conductividad eléctrica. Por esta razón, durante la descarga de una batería, los iones fluyen desde el ánodo hasta el cátodo a través del electrolito. Mientras tanto, los electrones son forzados a fluir del ánodo al cátodo a través de la carga. El electrolito suele ser un líquido pero a veces un sólido delgado. Las baterías están contenidas en un paquete. Si el electrolito es líquido, se incluye un sello para evitar que se derrame o escape [140]. La mayoría de las baterías también contienen un separador, que generalmente está hecho de una membrana delgada de polímero [140].
El separador permite que algunos, pero no otros iones, fluyan a través, y es una barrera física que evita que los electrodos entren en contacto y cortocircuiten la batería.
| Componentes de la batería | Componentes opcionales para protección |
|---|---|
| Ánodo | Diodo |
| Cátodo | Fusible o disyuntor |
| Electrolito | Ventilación |
| Separador | Microcontrolador |
| Seal | Termopar |
A menudo se agregan componentes adicionales para mejorar la seguridad del dispositivo, y Table\(\PageIndex{1}\) enumera algunos de estos componentes opcionales. Un usuario puede insertar erróneamente una batería hacia atrás. Para evitar daños por este error, algunas baterías incorporan un diodo [128, ch. 5.1]. El voltaje a través de los terminales de una batería con un diodo interno necesariamente será menor que el voltaje a través de una batería equivalente sin el diodo presente. Otras baterías, como las típicas baterías de 9V, incorporan conectores que solo se pueden conectar de una manera. Una batería también puede dañarse si los terminales están cortocircuitados. La mayoría de las baterías incluyen respiraderos para que los gases puedan escapar de manera segura cuando una batería está dañada debido a cortocircuitos en los terminales, intento de consumo excesivo de corriente o sobrecalentamiento por otras razones [128, ch. 5.1]. Algunas baterías incluyen un fusible o disyuntor en el paquete para evitar daños en estos casos también. Adicionalmente, las baterías recargables pueden dañarse si el proceso de recarga no se controla adecuadamente [128, ch. 5.1]. Algunas baterías recargables tienen un termopar y un microcontrolador integrados en el paquete para controlar el proceso de recarga y evitar el sobrecalentamiento durante la recarga [128, ch. 5.1]. Los usuarios no deben intentar recargar baterías no recargables. Si bien la reacción química a menudo puede ir en cualquier dirección, el paquete y la estructura de una batería primaria no están diseñados para soportar el proceso de carga y normalmente se dañarán [128, ch. 5.1].
Flujo de carga en una batería de descarga
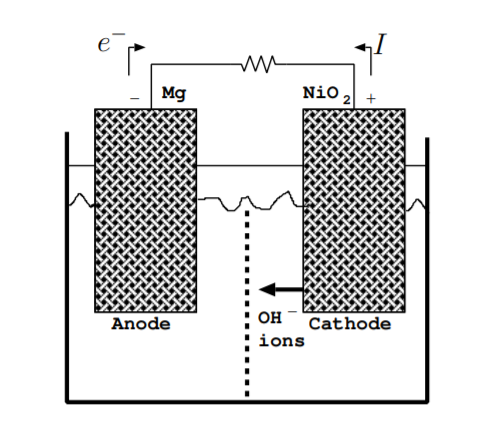
A medida que se descarga una batería, la energía química almacenada en los enlaces que mantienen unidos los electrodos se convierte en energía eléctrica en forma de corriente que fluye a través de la carga. Considera un ejemplo de batería con un ánodo de magnesio y un cátodo de óxido de níquel. La reacción en el ánodo viene dada por
\[\mathrm{Mg}+2 \mathrm{OH}^{-} \rightarrow \mathrm{Mg}(\mathrm{OH})_{2}+2 e^{-} \label{9.3.1} \]
que tiene un potencial redox de\(V_{rp} = 2.68\) V [137] [140]. La reacción en el cátodo viene dada por
\[\mathrm{NiO}_{2}+2 \mathrm{H}_{2} \mathrm{O}+2 e^{-} \rightarrow \mathrm{Ni}(\mathrm{OH})_{2}+2 \mathrm{OH}^{-} \label{9.3.2} \]
que tiene un potencial redox de\(V_{rp} = 0.49\) V [140]. La reacción general viene dada por
\[\mathrm{Mg}+\mathrm{NiO}_{2}+2 \mathrm{H}_{2} \mathrm{O} \rightarrow \mathrm{Mg}(\mathrm{OH})_{2}+\mathrm{Ni}(\mathrm{OH})_{2} \nonumber \]
Esta reacción ocurre en soluciones alcalinas que contienen\(^-\) iones OH disponibles para reaccionar, por lo que se puede usar un electrolito como el hidróxido de potasio, KOH, [140]. Otras reacciones pueden ocurrir simultáneamente en estos electrodos [137], pero por simplicidad estas otras reacciones serán ignoradas.
La figura\(\PageIndex{2}\) ilustra el flujo de carga en la batería durante el funcionamiento normal. Un circuito completo está formado no solo por el flujo de electrones sino por una combinación del flujo de electrones e iones [128]. Los electrones fluyen lejos del terminal negativo (ánodo) a través de la carga. \(^-\)Los iones OH negativos fluyen lejos del terminal positivo (cátodo) a través del electrolito. El separador debe permitir que el OH\(^-\) fluya desde el terminal positivo al terminal negativo. Para algunos electrodos, aunque no en este ejemplo, los iones positivos, en lugar de iones negativos, completan el circuito fluyendo alejándose del terminal negativo. Como se muestra en la figura, la dirección del flujo de corriente es opuesta a la dirección del flujo de electrones. La batería continúa descargándose hasta que uno de los electrodos se agota [3, p. 226].
Flujo de carga en una batería de carga
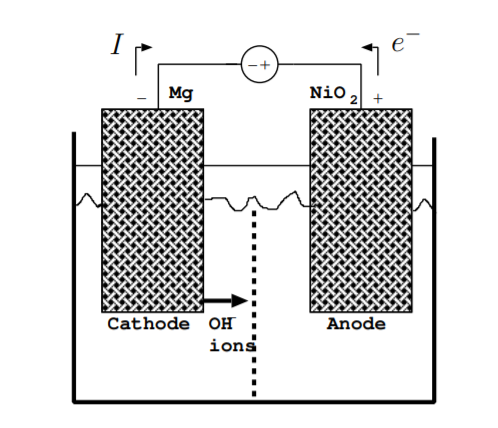
La figura\(\PageIndex{3}\) ilustra el flujo de cargas cuando la batería se está cargando. Durante la carga, la energía se convierte de energía eléctrica debido a la fuente de voltaje externa de nuevo a energía química almacenada en los enlaces químicos que mantienen juntos los electrodos. Nuevamente, se debe considerar el flujo tanto de electrones como de iones, no solo de electrones. Como anteriormente, la dirección de la corriente es la opuesta a la dirección del flujo de electrones. Las reacciones que ocurren son lo opuesto a las reacciones dadas por las Ecuaciones\ ref {9.3.1} y\ ref {9.3.2}. Por definición, el cátodo es el electrodo hacia el que fluyen los electrones, y el ánodo es el electrodo del que fluyen los electrones. Durante la carga, a diferencia de durante la descarga, el cátodo es el terminal negativo y el ánodo es el terminal positivo. Para este ejemplo, la reacción en el cátodo es
\[\mathrm{Mg}(\mathrm{OH})_{2}+2 e^{-} \rightarrow \mathrm{Mg}+2 \mathrm{OH}^{-} \nonumber \]
y la reacción en el ánodo es
\[\mathrm{Ni}(\mathrm{OH})_{2}+2 \mathrm{OH}^{-} \rightarrow \mathrm{NiO}_{2}+2 \mathrm{H}_{2} \mathrm{O}+2 e^{-}. \nonumber \]
En este ejemplo,\(^-\) los iones OH fluyen lejos del cátodo durante la carga. Sin embargo, en algunas reacciones, tanto el flujo de iones negativos fuera del cátodo como los iones positivos fuera del ánodo deben considerarse durante la carga.
Flujo de carga en celdas de combustible
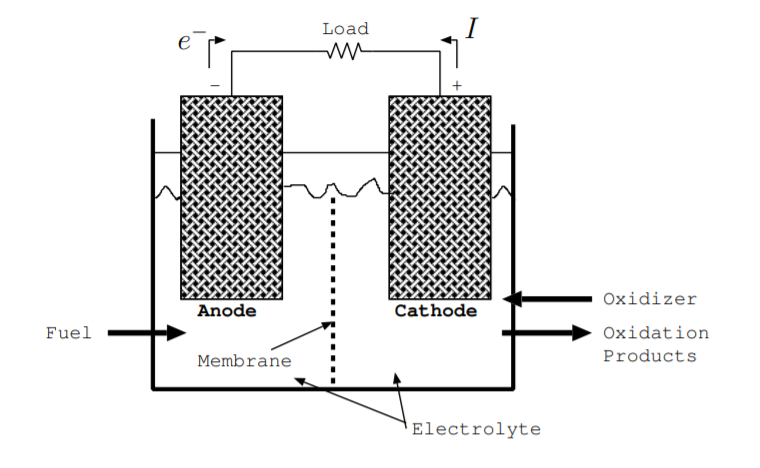
Una pila de combustible contiene muchos de los mismos componentes que una batería [3, p. 226] [128, p. 376] [141]. Al igual que una batería, una pila de combustible contiene un ánodo y un cátodo. Estos electrodos deben ser buenos conductores, y a menudo son porosos para que tengan una gran superficie. Los electrodos están en un electrolito líquido o sólido a través del cual pueden fluir iones. Los electrodos suelen estar recubiertos con un catalizador, como el platino, para acelerar las reacciones químicas [141]. Una celda de combustible contiene un separador, típicamente llamado membrana, que permite selectivamente que los iones fluyan. Al igual que con el separador de una batería, normalmente está hecho de un polímero delgado. Se agrega combustible en el ánodo y se agrega un oxidante en el cátodo. Normalmente, tanto el combustible como el oxidante son líquidos o gases. Se consumen durante la operación mientras que el ánodo y el cátodo no se consumen ya que están en una batería de descarga. Estos componentes se ilustran en la Fig. \(\PageIndex{4}\).
Como ejemplo, una pila de combustible puede usar\(_2\) gas H como combustible y\(_2\) gas O como oxidante. El ánodo puede ser tela de carbono [141], y esta reacción es acelerada por un catalizador de platino [108]. Una solución alcalina como KOH puede ser el electrolito. Para este combustible en un electrolito alcalino, la reacción en el ánodo es
\[\mathrm{H}_{2}+2 \mathrm{OH}^{-} \rightarrow 2 \mathrm{H}_{2} \mathrm{O}+2 e^{-} \nonumber \]
y la reacción en el cátodo es
\[\frac{1}{2} \mathrm{O}_{2}+2 e^{-}+\mathrm{H}_{2} \mathrm{O} \rightarrow 2 \mathrm{OH}^{-} \nonumber \]
La figura\(\PageIndex{4}\) también ilustra el flujo de carga en una pila de combustible de ejemplo [3, p. 226] [128, p. 376] [141]. La oxidación, el proceso de arrancar electrones del combustible dejando iones positivos, ocurre en el ánodo. Estos electrones fluyen del ánodo al cátodo a través de la carga. En el cátodo se reduce el oxidante. Es decir, en el cátodo, el oxidante reacciona incorporando estos electrones para formar iones negativos. Estos iones negativos fluyen del cátodo al ánodo, y los iones positivos fluyen del ánodo al cátodo. La membrana evita que las cargas fluyan en la dirección inversa, y evita que los iones positivos y los iones negativos se combinen entre sí directamente. Una pila de combustible puede continuar operando siempre y cuando se agreguen el combustible y el oxidante y se eliminen los productos de oxidación.


