4.1: Materia
- Page ID
- 82812
Átomos, Moléculas, Compuestos
En su nivel más fundamental, la vida está conformada por la materia. La materia ocupa espacio y tiene masa. Toda la materia está compuesta por elementos, sustancias que no pueden descomponerse ni transformarse químicamente en otras sustancias. Cada elemento está hecho de átomos, cada uno con un número constante de protones y propiedades únicas. Se han definido un total de 118 elementos; sin embargo, solo 92 ocurren de forma natural, y menos de 30 se encuentran en las células vivas. Los 26 elementos restantes son inestables y, por lo tanto, no existen por mucho tiempo o son teóricos y aún no se han detectado. Cada elemento está designado por su símbolo químico (como\(\ce{H}\),\(\ce{N}\),\(\ce{O}\)\(\ce{C}\), y\(\ce{Na}\)), y posee propiedades únicas. Estas propiedades únicas permiten que los elementos se combinen y se unan entre sí de maneras específicas.
Un átomo es el componente más pequeño de un elemento que conserva todas las propiedades químicas de ese elemento. Por ejemplo, un átomo de hidrógeno tiene todas las propiedades del elemento hidrógeno, tal como existe como gas a temperatura ambiente, y se une con el oxígeno para crear una molécula de agua. Los átomos de hidrógeno no se pueden descomponer en nada más pequeño sin dejar de conservar las propiedades del hidrógeno. Si un átomo de hidrógeno se descomponía en partículas subatómicas, ya no tendría las propiedades del hidrógeno. En el nivel más básico, todos los organismos están hechos de una combinación de elementos. Contienen átomos que se combinan para formar moléculas. En los organismos multicelulares, como los animales, las moléculas pueden interactuar para formar células que se combinan para formar tejidos, que conforman órganos. Estas combinaciones continúan hasta que se forman organismos multicelulares enteros.
En el nivel más básico, todos los organismos están hechos de una combinación de elementos. Contienen átomos que se combinan para formar moléculas. En los organismos multicelulares, como los animales, las moléculas pueden interactuar para formar células que se combinan para formar tejidos, que conforman órganos. Estas combinaciones continúan hasta que se forman organismos multicelulares enteros. Todos los átomos contienen protones, electrones y neutrones (Figura abajo). La única excepción es el hidrógeno (\(\ce{H}\)), que está hecho de un protón y un electrón. Un protón es una partícula cargada positivamente que reside en el núcleo (el núcleo del átomo) de un átomo y tiene una masa de 1 y una carga de +1. Un electrón es una partícula cargada negativamente que viaja en el espacio alrededor del núcleo. En otras palabras, reside fuera del núcleo. Tiene una masa insignificante y tiene una carga de —1.
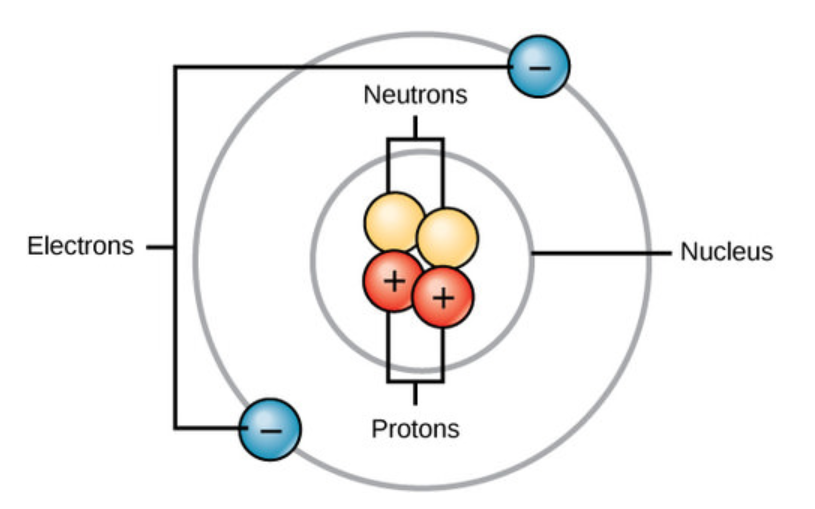
Los neutrones, al igual que los protones, residen en el núcleo de un átomo. Tienen una masa de 1 y sin cargo. Las cargas positivas (protones) y negativas (electrones) se equilibran entre sí en un átomo neutro, que tiene una carga neta cero.
Cada elemento contiene un número diferente de protones y neutrones, dándole su propio número atómico y número másico. El número atómico de un elemento es igual al número de protones que contiene ese elemento. El número de masa es el número de protones más el número de neutrones de ese elemento. Por lo tanto, es posible determinar el número de neutrones restando el número atómico del número másico.
Los isótopos son diferentes formas del mismo elemento que tienen el mismo número de protones, pero un número diferente de neutrones. Algunos elementos, como el carbono, el potasio y el uranio, tienen isótopos naturales. El carbono-12, el isótopo más común del carbono, contiene seis protones y seis neutrones. Por lo tanto, tiene un número de masa de 12 (seis protones y seis neutrones) y un número atómico de 6 (lo que lo convierte en carbono). El Carbono-14 contiene seis protones y ocho neutrones. Por lo tanto, tiene un número de masa de 14 (seis protones y ocho neutrones) y un número atómico de 6, lo que significa que sigue siendo el elemento carbono. Estas dos formas alternas de carbono son isótopos. Algunos isótopos son inestables y perderán protones, otras partículas subatómicas o energía para formar elementos más estables. Estos se denominan isótopos radiactivos o radioisótopos.
Evolución en Acción
El carbono-14 (14C) es un radioisótopo natural que es creado en la atmósfera por los rayos cósmicos. Este es un proceso continuo, por lo que siempre se está creando más 14C. A medida que se desarrolla un organismo vivo, el nivel relativo de 14C en su cuerpo es igual a la concentración de 14C en la atmósfera. Cuando un organismo muere, ya no está ingiriendo 14C, por lo que la proporción disminuirá. 14C decae a 14N por un proceso llamado decaimiento beta; emite energía en este lento proceso. Después de aproximadamente 5,730 años, sólo la mitad de la concentración inicial de 14C habrá sido convertida a 14N. El tiempo que tarda la mitad de la concentración original de un isótopo en descomponerse a su forma más estable se llama su vida media.
Debido a que la vida media del 14C es larga, se utiliza para envejecer objetos anteriormente vivos, como los fósiles. Utilizando la relación entre la concentración de 14C encontrada en un objeto y la cantidad de 14C detectada en la atmósfera, se puede determinar la cantidad del isótopo que aún no se ha descompuesto. Con base en esta cantidad, la edad del fósil se puede calcular en aproximadamente 50,000 años (Figura a continuación). Los isótopos con vidas medias más largas, como el potasio-40, se utilizan para calcular las edades de los fósiles más antiguos. Mediante el uso de la datación por carbono, los científicos pueden reconstruir la ecología y biogeografía de organismos que viven en los últimos 50,000 años.

Enlaces químicos
La forma en que los elementos interactúan entre sí depende de cómo están dispuestos sus electrones y cuántas aberturas para los electrones existen en la región más externa donde los electrones están presentes en un átomo. Los electrones existen a niveles de energía que forman conchas alrededor del núcleo. El caparazón más cercano puede contener hasta dos electrones. El caparazón más cercano al núcleo siempre se llena primero, antes de que se pueda llenar cualquier otra concha. El hidrógeno tiene un electrón; por lo tanto, solo tiene un punto ocupado dentro de la capa más baja. El helio tiene dos electrones; por lo tanto, puede llenar completamente la capa más baja con sus dos electrones. Si miras la tabla periódica, verás que el hidrógeno y el helio son los únicos dos elementos en la primera fila. Esto se debe a que sólo tienen electrones en su primer caparazón. El hidrógeno y el helio son los únicos dos elementos que tienen el caparazón más bajo y ningún otro caparazón.
No todos los elementos tienen suficientes electrones para llenar sus cáscaras más externas, pero un átomo está en su punto más estable cuando se llenan todas las posiciones de los electrones en la capa más externa. Debido a estas vacantes en las conchas más externas, vemos la formación de enlaces químicos, o interacciones entre dos o más elementos iguales o diferentes que resultan en la formación de moléculas. Para lograr una mayor estabilidad, los átomos tenderán a llenar completamente sus capas externas y se unirán con otros elementos para lograr este objetivo compartiendo electrones, aceptando electrones de otro átomo o donando electrones a otro átomo. Debido a que las conchas más externas de los elementos con números atómicos bajos (hasta calcio, con número atómico 20) pueden contener ocho electrones, esto se conoce como la regla del octeto. Un elemento puede donar, aceptar o compartir electrones con otros elementos para llenar su capa exterior y satisfacer la regla del octeto.
Cuando un átomo no contiene igual número de protones y electrones, se le llama ion. Debido a que el número de electrones no es igual al número de protones, cada ion tiene una carga neta. Los iones positivos se forman al perder electrones y se llaman cationes. Los iones negativos se forman ganando electrones y se llaman aniones. Los nombres aniónicos elementales se cambian para terminar en -ide. Por ejemplo, el sodio solo tiene un electrón en su caparazón más externo. Se necesita menos energía para que el sodio done ese electrón que para aceptar siete electrones más para llenar la capa externa. Si el sodio pierde un electrón, ahora tiene 11 protones y sólo 10 electrones, dejándolo con una carga general de +1. Ahora se le llama ion de sodio.
Los enlaces iónicos y covalentes son enlaces fuertes o interacciones que requieren un mayor aporte de energía para romperse. Cuando un elemento dona un electrón de su capa externa, como en el ejemplo del átomo de sodio anterior, se forma un ion positivo. El elemento que acepta el electrón está ahora cargado negativamente. Debido a que las cargas positivas y negativas se atraen, estos iones permanecen juntos y forman un enlace iónico, o un enlace entre iones. Los elementos se unen con el electrón de un elemento permaneciendo predominantemente con el otro elemento.
Otro tipo de enlace químico fuerte entre dos o más átomos es un enlace covalente. Estos enlaces se forman cuando un electrón se comparte entre dos elementos y son la forma más fuerte y común de enlace químico en los organismos vivos. Se forman enlaces covalentes entre los elementos que componen las moléculas biológicas en nuestras células. A diferencia de los enlaces iónicos, los enlaces covalentes no se disocian en agua.
Los átomos de hidrógeno y oxígeno que se combinan para formar moléculas de agua están unidos entre sí por enlaces covalentes. El electrón del átomo de hidrógeno divide su tiempo entre la capa externa del átomo de hidrógeno y la capa externa incompleta del átomo de oxígeno. Para llenar completamente la capa externa de un átomo de oxígeno, se necesitan dos electrones de dos átomos de hidrógeno, de ahí el subíndice “2” en\(\ce{H2O}\). Los electrones se comparten entre los átomos, dividiendo su tiempo entre ellos para “llenar” la capa exterior de cada uno. Este reparto es un estado de menor energía para todos los átomos involucrados que si existieran sin sus cáscaras externas llenas.
Cuando se forman enlaces covalentes polares que contienen un átomo de hidrógeno, el átomo de hidrógeno en ese enlace tiene una carga ligeramente positiva. Esto se debe a que el electrón compartido es arrastrado con mayor fuerza hacia el otro elemento y lejos del núcleo de hidrógeno. Debido a que el átomo de hidrógeno es ligeramente positivo (δ+), será atraído por cargas parciales negativas vecinas (δ—). Cuando esto sucede, se produce una interacción débil entre la carga δ+ del átomo de hidrógeno de una molécula y la carga δ— de la otra molécula. Esta interacción se llama un enlace de hidrógeno. Este tipo de enlace es común; por ejemplo, la naturaleza líquida del agua es causada por los enlaces de hidrógeno entre las moléculas de agua. Los enlaces de hidrógeno le dan al agua las propiedades únicas que sostienen la vida. Si no fuera por enlaces de hidrógeno, el agua sería un gas en lugar de un líquido a temperatura ambiente.
El agua es crucial para mantener la vida
¿Alguna vez te has preguntado por qué los científicos pasan tiempo buscando agua en otros planetas? Es porque el agua es esencial para la vida; incluso las huellas diminutas de ella en otro planeta pueden indicar que la vida podría o existió en ese planeta. El agua es una de las moléculas más abundantes en las células vivas y la más crítica para la vida tal como la conocemos. Aproximadamente el 60—70 por ciento de tu cuerpo está compuesto por agua. Sin ella, la vida simplemente no existiría.
- EL AGUA ES POLAR. Los átomos de hidrógeno y oxígeno dentro de las moléculas de agua forman enlaces covalentes polares. Los electrones compartidos pasan más tiempo asociados con el átomo de oxígeno que con los átomos de hidrógeno. No hay carga general a una molécula de agua, pero hay una ligera carga positiva en cada átomo de hidrógeno y una ligera carga negativa en el átomo de oxígeno. Debido a estas cargas, los átomos de hidrógeno ligeramente positivos se repelen entre sí y forman la forma única. Cada molécula de agua atrae a otras moléculas de agua debido a las cargas positivas y negativas en las diferentes partes de la molécula. El agua también atrae a otras moléculas polares (como los azúcares) que pueden disolverse en el agua y se conocen como hidrófilas (“amantes del agua”).
- El agua estabiliza la temperatura. Los enlaces de hidrógeno en el agua le permiten absorber y liberar energía térmica más lentamente que muchas otras sustancias. La temperatura es una medida del movimiento (energía cinética) de las moléculas. A medida que aumenta el movimiento, la energía es mayor y por lo tanto la temperatura es mayor. El agua absorbe una gran cantidad de energía antes de que suba su temperatura. El aumento de la energía interrumpe los enlaces de hidrógeno entre las moléculas de agua. Debido a que estos enlaces se pueden crear e interrumpir rápidamente, el agua absorbe un aumento en la energía y los cambios de temperatura solo mínimamente. Esto significa que el agua modera los cambios de temperatura dentro de los organismos y en sus ambientes.
- El agua es un excelente disolvente. Debido a que el agua es polar, con ligeras cargas positivas y negativas, los compuestos iónicos y las moléculas polares pueden disolverse fácilmente en ella. El agua es, por lo tanto, lo que se denomina disolvente, una sustancia capaz de disolver otra sustancia. Las partículas cargadas formarán enlaces de hidrógeno con una capa circundante de moléculas de agua.
- EL AGUA ES COHESIVO. ¿Alguna vez has llenado un vaso de agua hasta la parte superior y luego lentamente agregaste algunas gotas más? Antes de que se desborde, el agua en realidad forma una forma de cúpula sobre el borde del vidrio. Esta agua puede permanecer por encima del cristal debido a la propiedad de cohesión. En cohesión, las moléculas de agua son atraídas entre sí (debido a los enlaces de hidrógeno), manteniendo las moléculas juntas en la interfaz líquido-aire (gas), aunque no hay más espacio en el vidrio. La cohesión da lugar a la tensión superficial, la capacidad de una sustancia para soportar la ruptura cuando se coloca bajo tensión o tensión. Cuando se deja caer un pequeño trozo de papel sobre una gotita de agua, el papel flota sobre la gotita de agua, aunque el objeto es más denso (más pesado) que el agua. Esto ocurre debido a la tensión superficial que crean las moléculas de agua. La cohesión y la tensión superficial mantienen intactas las moléculas de agua y el artículo flotando en la parte superior. Incluso es posible “flotar” una aguja de acero sobre un vaso de agua si la colocas suavemente, sin romper la tensión superficial. Estas fuerzas cohesivas también están relacionadas con la propiedad de adhesión del agua, o la atracción entre las moléculas de agua y otras moléculas. Esto se observa cuando el agua “sube” por una pajita colocada en un vaso de agua. Notarás que el agua parece estar más alta en los lados de la paja que en el medio. Esto se debe a que las moléculas de agua son atraídas por la paja y por lo tanto se adhieren a ella. Las fuerzas cohesivas y adhesivas son importantes para mantener la vida útil. Por ejemplo, debido a estas fuerzas, el agua puede fluir desde las raíces hasta la parte superior de las plantas para alimentar a la planta.
Tampones, pH, ácidos y bases
El pH de una solución es una medida de su acidez o alcalinidad. La escala de pH oscila entre 0 y 14. Un cambio de una unidad en la escala de pH representa un cambio en la concentración de iones hidrógeno por un factor de 10, un cambio en dos unidades representa un cambio en la concentración de iones hidrógeno por un factor de 100. Por lo tanto, pequeños cambios en el pH representan grandes cambios en las concentraciones de iones hidrógeno. El agua pura es neutra. No es ni ácida ni básica, y tiene un pH de 7.0. Cualquier cosa por debajo de 7.0 (que va de 0.0 a 6.9) es ácida, y cualquier cosa por encima de 7.0 (de 7.1 a 14.0) es alcalina. La sangre en tus venas es ligeramente alcalina (pH = 7.4). El ambiente en tu estómago es altamente ácido (pH = 1 a 2). El jugo de naranja es ligeramente ácido (pH = aproximadamente 3.5), mientras que el bicarbonato de sodio es básico (pH = 9.0). Los ácidos son sustancias que proporcionan iones de hidrógeno (\(\ce{H+}\)) y pH más bajo, mientras que las bases proporcionan iones hidróxido (\(\ce{OH-}\)) y elevan el pH. Cuanto más fuerte es el ácido, más fácilmente dona\(\ce{H+}\). Por ejemplo, el ácido clorhídrico y el jugo de limón son muy ácidos y\(\ce{H+}\) se rinden fácilmente cuando se agregan al agua. Por el contrario, las bases son aquellas sustancias que donan fácilmente\(\ce{OH-}\). Los\(\ce{OH-}\) iones se combinan\(\ce{H+}\) para producir agua, lo que eleva el pH de una sustancia. El hidróxido de sodio y muchos limpiadores domésticos son muy alcalinos y se rinden\(\ce{OH-}\) rápidamente cuando se colocan en agua, elevando así el pH.

¿Cómo es que podemos ingerir o inhalar sustancias ácidas o básicas y no morir? Los búferes son la clave. Los tampones absorben fácilmente el exceso\(\ce{H+}\) o\(\ce{OH-}\), manteniendo el pH del cuerpo cuidadosamente mantenido en el rango estrecho mencionado anteriormente. El dióxido de carbono es parte de un sistema tampón prominente en el cuerpo humano; mantiene el pH dentro del rango adecuado. Este sistema tampón involucra ácido carbónico (\(\ce{H2CO3}\)) y anión bicarbonato (\(\ce{HCO3-}\)). Si\(\ce{H+}\) entra demasiado al cuerpo, el bicarbonato se combinará con el\(\ce{H+}\) para crear ácido carbónico y limitar la disminución del pH. De igual manera, si\(\ce{OH-}\) se introduce demasiado en el sistema, el ácido carbónico se combinará con él para crear bicarbonato y limitar el aumento del pH. Si bien el ácido carbónico es un producto importante en esta reacción, su presencia es fugaz porque el ácido carbónico se libera del cuerpo como gas dióxido de carbono cada vez que respiramos. Sin este sistema tampón, el pH en nuestros cuerpos fluctuaría demasiado y no lograríamos sobrevivir.
Moléculas Biológicas
Las moléculas grandes necesarias para la vida que se construyen a partir de moléculas orgánicas más pequeñas se denominan macromoléculas biológicas. Hay cuatro clases principales de macromoléculas biológicas (carbohidratos, lípidos, proteínas y ácidos nucleicos), y cada una es un componente importante de la célula y realiza una amplia gama de funciones. Combinadas, estas moléculas constituyen la mayor parte de la masa celular. Las macromoléculas biológicas son orgánicas, es decir, que contienen carbono. Además, pueden contener hidrógeno, oxígeno, nitrógeno, fósforo, azufre y elementos menores adicionales.
Carbono
A menudo se dice que la vida es “a base de carbono”. Esto significa que los átomos de carbono, unidos a otros átomos de carbono u otros elementos, forman los componentes fundamentales de muchas, si no la mayoría, de las moléculas que se encuentran de manera única en los seres vivos. Otros elementos juegan un papel importante en las moléculas biológicas, pero el carbono ciertamente califica como el elemento “fundamento” de las moléculas en los seres vivos. Son las propiedades de unión de los átomos de carbono las que son responsables de su importante papel.
Adhesión de carbono
El carbono contiene cuatro electrones en su capa externa. Por lo tanto, puede formar cuatro enlaces covalentes con otros átomos o moléculas. La molécula de carbono orgánico más simple es el metano (\(\ce{CH4}\)), en el que cuatro átomos de hidrógeno se unen a un átomo de carbono (Figura a continuación).
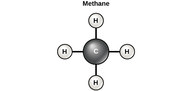 Figura\(\PageIndex{4}\): El carbono puede formar cuatro enlaces covalentes para crear una molécula orgánica. La molécula de carbono más simple es el metano (\(\ce{CH4}\)), representada aquí
Figura\(\PageIndex{4}\): El carbono puede formar cuatro enlaces covalentes para crear una molécula orgánica. La molécula de carbono más simple es el metano (\(\ce{CH4}\)), representada aquíLos lípidos incluyen un grupo diverso de compuestos que están unidos por una característica común. Los lípidos son hidrófobos (“temerosos del agua”), o insolubles en agua, porque son moléculas no polares. Los lípidos realizan muchas funciones diferentes en una célula. Las células almacenan energía para su uso a largo plazo en forma de lípidos llamados grasas. Los lípidos también proporcionan aislamiento del ambiente para plantas y animales. Por ejemplo, ayudan a mantener secos a las aves y mamíferos acuáticos debido a su naturaleza repelente al agua. Los lípidos también son los bloques de construcción de muchas hormonas y son un constituyente importante de la membrana plasmática. Los lípidos incluyen grasas, aceites, ceras, fosfolípidos y esteroides.
Las proteínas son una de las moléculas orgánicas más abundantes en los sistemas vivos y tienen el rango de funciones más diverso de todas las macromoléculas. Todos ellos son polímeros de aminoácidos, dispuestos en una secuencia lineal. Las funciones de las proteínas son muy diversas porque hay 20 aminoácidos diferentes químicamente distintos que forman cadenas largas, y los aminoácidos pueden estar en cualquier orden. Por ejemplo, las proteínas pueden funcionar como enzimas u hormonas.
Las enzimas, que son producidas por las células vivas, son catalizadores en reacciones bioquímicas (como la digestión) y suelen ser proteínas. Cada enzima es específica para el sustrato (un reactivo que se une a una enzima) sobre el cual actúa. Las enzimas pueden funcionar para romper enlaces moleculares, reorganizar enlaces o formar nuevos enlaces.
Los ácidos nucleicos son macromoléculas clave en la continuidad de la vida. Llevan el plano genético de una célula y llevan instrucciones para el funcionamiento de la célula. Los dos tipos principales de ácidos nucleicos son el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN). El ADN es el material genético que se encuentra en todos los organismos vivos, desde bacterias unicelulares hasta mamíferos multicelulares. El otro tipo de ácido nucleico, el ARN, está principalmente involucrado en la síntesis de proteínas. Las moléculas de ADN nunca abandonan el núcleo, sino que utilizan un intermediario de ARN para comunicarse con el resto de la célula. Otros tipos de ARN también están involucrados en la síntesis de proteínas y su regulación. El ADN y el ARN están constituidos por monómeros conocidos como nucleótidos. Los nucleótidos se combinan entre sí para formar un polinucleótido, ADN o ARN. Cada nucleótido se compone de tres componentes: una base nitrogenada, un azúcar pentosa (cinco carbonos) y un grupo fosfato. Cada base nitrogenada en un nucleótido está unida a una molécula de azúcar, que está unida a un grupo fosfato. El ADN tiene una estructura de doble hélice (Figura a continuación).
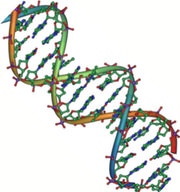 Figura\(\PageIndex{5}\): El modelo de doble hélice muestra el ADN como dos cadenas paralelas de moléculas entrelazadas.
Figura\(\PageIndex{5}\): El modelo de doble hélice muestra el ADN como dos cadenas paralelas de moléculas entrelazadas.Se compone de dos cadenas, o polímeros, de nucleótidos. Las cadenas se forman con enlaces entre grupos fosfato y azúcar de nucleótidos adyacentes. Las hebras están unidas entre sí en sus bases con enlaces de hidrógeno, y las hebras se enrollan alrededor de otras a lo largo de su longitud, de ahí la descripción de “doble hélice”, que significa una doble espiral. Los grupos alternos de azúcar y fosfato se encuentran en el exterior de cada cadena, formando la columna vertebral del ADN. Las bases nitrogenadas se apilan en el interior, como los escalones de una escalera, y estas bases se emparejan; los pares están unidos entre sí por enlaces de hidrógeno. Las bases se emparejan de tal manera que la distancia entre las cadenas principales de las dos cadenas es la misma a lo largo de la molécula.

