6.2: Ozono
- Page ID
- 81113
El ozono (O 3) es una molécula en la que tres átomos de oxígeno están unidos entre sí. El gas oxígeno en el aire que respiramos tiene dos átomos de oxígeno unidos entre sí (O 2). El ozono es relativamente inestable y libera su tercer átomo de oxígeno fácilmente por lo que se oxida y quema las cosas más fácilmente que el gas oxígeno. Esta característica hace que el ozono en la troposfera (ozono a nivel del suelo) sea un contaminante del aire (ver sección 6.3) pero en la estratosfera, el ozono es esencial para proteger la vida en la Tierra. El ozono en la estratosfera se forma cuando una molécula de oxígeno (O 2) se divide en dos átomos de oxígeno separados (O) por radiación solar ultravioleta (UV) de alta energía. Cada uno de los átomos de oxígeno resultantes (O) reacciona a su vez con una molécula de oxígeno (O 2) creando ozono (O 3) (Figura 6.2.1). Una vez producido, el ozono puede absorber la radiación UV rompiendo la molécula para regenerar una molécula de oxígeno y un solo átomo de oxígeno. Entonces, mientras el ozono se repone continuamente, también se está destruyendo continuamente. Si la tasa de creación de ozono es igual a la tasa de destrucción, la cantidad total seguirá siendo la misma. Debido a que hay tanto oxígeno en nuestra atmósfera, este “ciclo ozono-oxígeno” está absorbiendo continuamente la radiación UV.
.png)
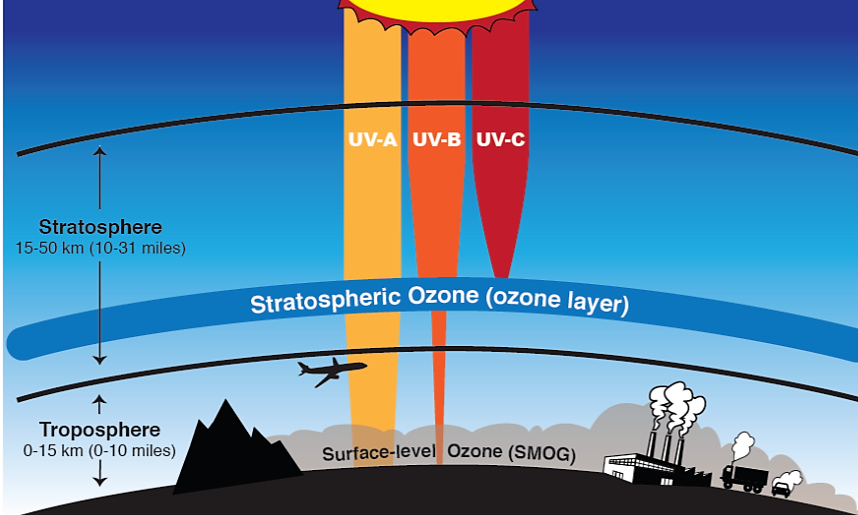
6.2.1: La Capa de Ozono
El ozono constituye una proporción muy pequeña de los gases en nuestra atmósfera y la mayor parte se concentra en una porción de la estratosfera aproximadamente 17—30 km sobre la superficie. Esta región, llamada capa de ozono, actúa como un escudo protector que protege la vida en la superficie de la Tierra al absorber la mayor parte de las porciones dañinas de la radiación UV de alta energía proveniente del sol. UV se subdivide en tres tipos, a saber, UV-A, UV-B y UV-C (Figura 6.2.2). De estos tres tipos, UV-A es el menos energético y menos dañino pero puede causar algún daño a las células vivas, resultando en quemaduras solares y daños en la piel. La UV-A tampoco es absorbida por el ozono en la estratosfera y, por lo tanto, se transmite a través de la atmósfera a la superficie de la Tierra. UV-C es el UV más dañino y energético de todos, pero se absorbe fuertemente tanto en la termosfera como en la estratosfera y no llega a la superficie de la Tierra. UV-C es el responsable de la división de las moléculas de oxígeno en la estratosfera que conduce a la formación de ozono. Cuando el ozono absorbe los rayos UV regenera los átomos de oxígeno y libera calor que calienta la parte superior de la estratosfera. Dado que UV-C no llega a la superficie de la Tierra, la forma más dañina de radiación UV que llega a la superficie es la UV-B. Sin embargo, la cantidad de UV-B que llega a la superficie de la Tierra se reduce significativamente debido a que la mayor parte es absorbida por el ozono en la estratosfera. El ozono es el único gas conocido que absorbe UV-B.
Las condiciones naturales en la estratosfera mantienen un equilibrio dinámico entre la creación y destrucción del ozono que ayuda a asegurar la existencia continua de la capa de ozono. Cualquier alteración de este equilibrio que resulte en una mayor tasa de destrucción de ozono que la creación de ozono resultaría en el agotamiento del ozono. El agotamiento del ozono, en consecuencia, conduce a un aumento significativo en la cantidad de radiación UV-B dañina que llega a la superficie de la Tierra y de esto de lo que estamos hablando cuando discutimos el problema del ozono.
.png)
6.2.2: El Agujero del Ozono
El Ozono Hole no es realmente un “agujero” sino más bien un área donde el grosor de la capa de ozono se reduce considerablemente. Este agujero es resultado del agotamiento del ozono que ocurre cada año durante la primavera antártica (Figura\(\PageIndex{3}\)) y fue reportado por primera vez al público por el British Antarctic Survey en 1985. El espesor de la capa de ozono por encima de la Antártida continuó disminuyendo mientras que el área geográfica cubierta por el agujero de ozono siguió aumentando, alcanzando su menor concentración (espesor) en 1994 y mayor área geográfica en 2000. Datos recientes muestran que la concentración de ozono a nivel mundial y en el Ártico y la Antártida ya no está disminuyendo.
Durante los largos meses invernales de oscuridad sobre la Antártida, las temperaturas atmosféricas bajan, creando condiciones únicas para reacciones químicas que no se encuentran en ningún otro lugar de la atmósfera. Durante este tiempo, la masa aérea antártica se aísla del resto de la atmósfera y circula alrededor del polo en lo que se conoce como el vórtice polar. Este aislamiento permite que las temperaturas bajen lo suficiente como para crear cristales de hielo a altas altitudes. El ozono, el ácido nítrico, el ácido sulfúrico y otras moléculas que contienen cloro se absorben en las superficies de estas partículas de hielo. Cuando el sol sale sobre la Antártida en la primavera meridional (octubre), la luz libera rápidamente átomos de cloro libres en la estratosfera. Los átomos de cloro reaccionan con el ozono descomponiéndolo en oxígeno molecular y un átomo de oxígeno. El vórtice polar evita que el aire empobrecido en ozono dentro del vórtice se mezcle con el aire no agotado fuera del vórtice, de ahí la formación de un agujero de ozono.
.png)
6.2.3: Agotamiento del ozono
Las concentraciones globales de ozono cambian periódicamente con ciclos naturales regulares, como el cambio de estaciones, vientos y variaciones del sol de larga escala de tiempo. Las concentraciones de ozono en la atmósfera se miden en partes por mil millones (ppb). Los científicos han estado midiendo el ozono desde la década de 1920 utilizando instrumentos terrestres que miran hacia el cielo. Las mediciones satelitales de las concentraciones de ozono atmosférico comenzaron en 1970 y continúan hoy en día.
El agotamiento del ozono ocurre cuando la velocidad a la que se descompone el ozono es mayor que la velocidad de su creación, interfiriendo con el equilibrio dinámico entre creación y destrucción que mantiene la capa de ozono. Cuando esto sucede, aumenta la cantidad de radiación UV-B dañina que llega a la superficie de la Tierra. El agotamiento del ozono se identificó por primera vez sobre la Antártida. Los científicos sugirieron que las reacciones que involucran compuestos que contienen cloro artificiales fueron responsables de agotar el ozono en la estratosfera. Esta hipótesis se basó principalmente en las propiedades físicas y químicas de estos compuestos y en el conocimiento sobre las condiciones atmosféricas.
Los clorofluorocarbonos (CFC) son compuestos artificiales compuestos por cloro, flúor y carbono. Estos compuestos se utilizaron comúnmente como propulsores en productos cotidianos como crema de afeitar, spray para el cabello, desodorantes, pinturas e insecticidas y como refrigerantes en refrigeradores y aires acondicionados. Los CFC son moléculas extremadamente estables y no reaccionan con otros químicos en la atmósfera inferior, parte de la razón por la que se consideraron una opción segura. Su estabilidad significa que tienden a permanecer en la atmósfera por mucho tiempo. Con el constante movimiento del aire en la atmósfera inferior, los CFC finalmente se abren paso en la estratosfera. La exposición a la radiación ultravioleta en la estratosfera los descompone, liberando átomos de cloro. Los átomos de cloro libre (Cl) reaccionan entonces con las moléculas de ozono, tomando un átomo de oxígeno para formar monóxido de cloro (ClO) y dejando una molécula de oxígeno (O 2) (Figura\(\PageIndex{4}\)). El ClO reacciona con otros átomos liberando el Cl haciéndolo disponible para reaccionar con otra molécula de ozono, repitiendo el ciclo una y otra vez dando como resultado el agotamiento del ozono.
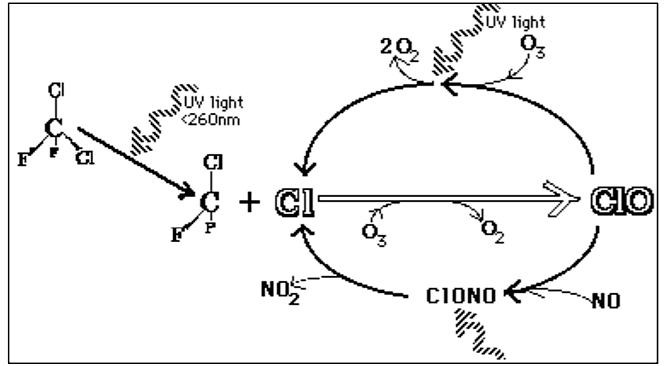.png)
Si cada átomo de cloro liberado de una molécula de CFC destruyera solo una molécula de ozono, los CFC representarían muy poca amenaza para la capa de ozono. Sin embargo, cuando una molécula de monóxido de cloro se encuentra con un átomo libre de oxígeno, el átomo de oxígeno descompone el monóxido de cloro, robando el átomo de oxígeno y liberando el átomo de cloro de nuevo a la estratosfera para destruir otra molécula de ozono. Estas dos reacciones ocurren una y otra vez, de manera que un solo átomo de cloro, actuando como catalizador, destruye muchas moléculas (alrededor de 100.000) de ozono. La consecuencia del agotamiento del ozono estratosférico es el aumento de los niveles de radiación UV-B que llega a la superficie de la Tierra, lo que representa una amenaza para la salud humana y el medio ambiente. La figura\(\PageIndex{}5\) muestra una cantidad menor al promedio de ozono estratosférico sobre América del Norte en 1997 cuando estaba anormalmente frío en comparación con 1984, que fue más cálido que el promedio, mostrando que el agotamiento del ozono no afecta exclusivamente solo al Polo Sur (Antártico).
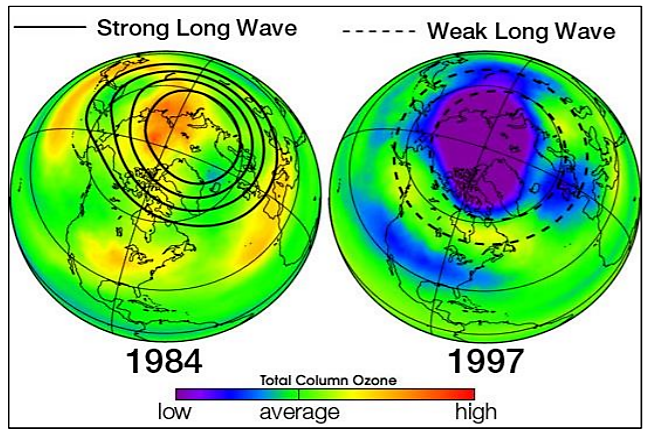.png)
6.2.4: El Protocolo de Montreal
Los esfuerzos de política internacional para restringir la producción de CFC que agotan el ozono culminaron en el tratado de 1987 conocido como el Protocolo de Montreal en el que las naciones firmantes acordaron reducir la producción de CFC a la mitad para 1998. Al menos cinco acuerdos de seguimiento desde entonces ayudaron a profundizar los recortes, adelantaron horarios para el cumplimiento y abordaron sustancias adicionales que agotan el ozono como halones, metilcloroformo, tetracloruro de carbono e hidroclorofluorocarbonos (HCFC). La mayoría de los países alrededor del mundo han ido eliminando gradualmente la producción de las sustancias cubiertas por los acuerdos y la industria ha podido cambiar a productos químicos alternativos más seguros. En consecuencia, hay evidencias de que el agujero de ozono antártico ha dejado de crecer peor, aunque no se espera una recuperación en el corto plazo. La eliminación gradual de los CFC y los HCFC también es beneficiosa para proteger el clima de la tierra, ya que estas sustancias también son gases de efecto invernadero muy dañinos.
Como parte del compromiso de Estados Unidos de implementar el Protocolo de Montreal, el Congreso de Estados Unidos modificó la Ley de Aire Limpio (sección 6.7), agregando disposiciones para la protección de la capa de ozono. Lo más importante es que la Ley reformada requería el fin gradual de la producción de productos químicos que agotan la capa de ozono. Las enmiendas a la Ley de Aire Limpio aprobadas por el Congreso requieren que la Agencia de Protección Ambiental (EPA) desarrolle e implemente regulaciones para el manejo responsable de las sustancias que agotan el ozono en Estados Unidos. Bajo la Ley de Aire Limpio, la EPA ha creado varios programas regulatorios para abordar numerosos temas, entre ellos:
- poner fin a la producción de sustancias que agotan el ozono,
- asegurar que los refrigerantes y los agentes extintores de incendios halones se reciclen adecuadamente,
- determinar alternativas seguras y eficaces a las sustancias que agotan la capa de ozono,
- prohibir la liberación de refrigerantes que agotan la capa de ozono durante el servicio, mantenimiento y eliminación de aires acondicionados y otros equipos de refrigeración,
- requiriendo que los fabricantes etiqueten los productos que contengan o estén hechos con las sustancias que agotan el ozono más dañinas.

