6.6: Lluvia ácida
- Page ID
- 81107
La precipitación pura es ligeramente ácida, pH 5.6, porque el agua reacciona con el dióxido de carbono atmosférico para producir ácido carbónico débil. Cuando se presentan en la atmósfera cantidades superiores a lo normal de ácido nítrico y sulfúrico, el resultado es la precipitación con un pH por debajo de 5.6 que se conoce como lluvia ácida. La lluvia ácida incluye tanto la deposición húmeda (lluvia, nieve, niebla) como la deposición seca (partículas). La formación de lluvia ácida resulta tanto de fuentes naturales, como volcanes y vegetación en descomposición, como de fuentes artificiales, principalmente emisiones de dióxido de azufre (SO 2) y óxidos de nitrógeno (NO x) resultantes de la combustión de combustibles fósiles. En Estados Unidos, aproximadamente 2/3 de todos los SO 2 y ¼ de todos los NO x provienen de la generación de energía eléctrica que depende de la quema de combustibles fósiles, como el carbón. La lluvia ácida ocurre cuando estos gases reaccionan en la atmósfera con agua, oxígeno y otros químicos para formar diversos compuestos ácidos (Figura\(\PageIndex{1}\)). El resultado es una solución suave de ácido sulfúrico y ácido nítrico. Cuando se liberan dióxido de azufre y óxidos de nitrógeno de las centrales eléctricas y otras fuentes, los vientos predominantes soplan estos compuestos a través de las fronteras estatales y nacionales, a veces a lo largo de cientos de millas Las regiones de mayor acidificación tienden a ser a favor del viento de áreas de fuente de contaminación fuertemente industrializadas.
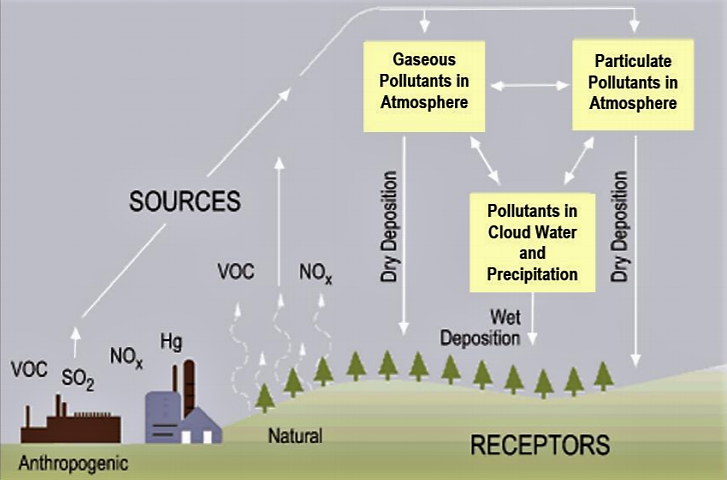.png)
- La lluvia ácida es un grave problema ambiental que es particularmente perjudicial para los lagos, arroyos y bosques y las plantas y animales que viven en estos ecosistemas, así como para la infraestructura. Algunos de los impactos incluyen:
- Lixiviación de nutrientes del suelo como calcio, magnesio y potasio de la capa superior del suelo, alterando la química del suelo y dañando plantas y organismos del suelo.
- La lluvia ácida provoca la liberación de sustancias que son tóxicas para los árboles y otras plantas, como el aluminio, en el suelo. Los científicos plantean la hipótesis de que esta combinación de pérdida de nutrientes del suelo y aumento de aluminio tóxico puede ser una forma en que la lluvia ácida dañe a los árboles (Figura 6.6.2). Tales sustancias también se lavan en la escorrentía y son transportadas a arroyos, ríos y lagos.
- Daños a pinturas automotrices y otros recubrimientos. El daño reportado generalmente ocurre en superficies horizontales y aparece como áreas de forma irregular, permanentemente grabadas.
- Las partículas ácidas contribuyen a la corrosión de los metales (como el bronce) y al deterioro de la pintura y la piedra (como el mármol y la piedra caliza). Estos efectos reducen significativamente el valor social de edificios, puentes, objetos culturales (como estatuas, monumentos y lápidas) (Figura 6.6.3).
- Los sulfatos y nitratos que se forman en la atmósfera contribuyen al deterioro de la visibilidad, lo que significa que no podemos ver tan lejos ni con tanta claridad a través del aire. Las partículas de sulfato representan del 50 al 70 por ciento de la reducción de visibilidad en la parte este de Estados Unidos, afectando nuestro disfrute de parques nacionales, como Shenandoah y Great Smoky Mountains
.png)
.png)

