6.3: Orbitales moleculares
- Page ID
- 84243
Desafortunadamente, incluso cuando aplicamos la aproximación Born-Oppenheimer y mantenemos fijas las coordenadas nucleares, la solución a la ecuación de Schrödinger (Ecuación (6.2.5)) es extremadamente compleja en todas menos en las moléculas más simples. Por lo general, se prefieren métodos numéricos. Pero se puede obtener alguna visión conceptual asumiendo que los orbitales moleculares son combinaciones lineales de orbitales atómicos, es decir, escribimos:
\[ \varphi = \sum_{r} c_{r}\phi_{r} \nonumber \]
donde\(\varphi\) está el orbital molecular y\(\phi\) es un orbital atómico. Un orbital molecular relleno con menor energía que los orbitales atómicos constituyentes estabiliza la molécula y se conoce como enlace químico.
Podemos definir dos tipos de orbitales moleculares construidos a partir de orbitales atómicos s y p:
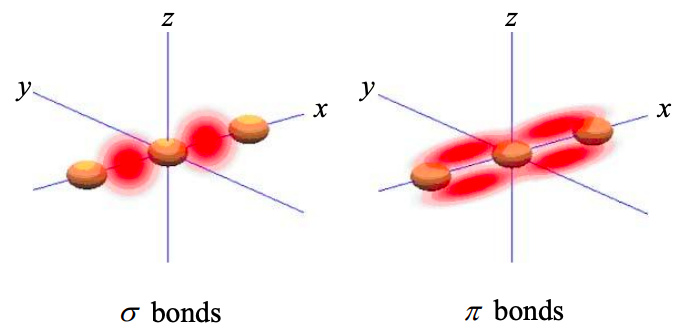
\(\sigma\)Orbitales moleculares: Estos se localizan entre átomos y son invariantes con respecto a las rotaciones alrededor del eje internuclear. Si podemos tomar el eje x como eje internuclear, entonces tanto los orbitales s como los\(p_{x}\) atómicos pueden participar en los orbitales\(sigma\) moleculares. \(p_{y}\)y los orbitales\(p_{z}\) atómicos no pueden contribuir a los orbitales moleculares porque cada uno tiene densidad de probabilidad cero en el eje x.
\(\pi\)Orbitales moleculares: Los electrones en los orbitales\(\pi\) moleculares se comparten más fácilmente entre los átomos. La densidad de probabilidad no está tan localizada como en un orbital\(\sigma\) molecular. Un orbital\(\pi\) molecular tampoco es invariante con respecto a las rotaciones alrededor del eje internuclear. combinaciones lineales de orbitales\(p_{z}\) atómicos\(p_{y}\) y orbitales forman orbitales\(\pi\) moleculares.