8.3: Apéndice 2 - El átomo de hidrógeno
- Page ID
- 84317
El modelo de caja del átomo de hidrógeno
El hidrógeno es el elemento más simple. Solo hay dos componentes: un electrón y un núcleo cargado positivamente compuesto por un solo protón.
Quizás el modelo más simple del átomo de hidrógeno emplea nuestros ya familiares pozos de potencial cuadrado. Esta aproximación no puede llevarse muy lejos, pero sí ilustra el origen de las formas de algunos orbitales. Si comparamos el potencial de Coulomb suave y esféricamente simétrico con nuestro modelo de caja de un átomo, es claro que la aproximación de la caja renunciará a mucha precisión en el cálculo de orbitales atómicos y energía. La caja, sin embargo, arroja percepciones sobre la forma de los diversos orbitales atómicos posibles.
La caja es un potencial separable. Así, los orbitales atómicos pueden ser descritos por un producto:
Si la pared tiene un potencial infinito, las posibles energías del electrón son dadas por
\[ E_{n_{x},n_{y},n_{z}} = \frac{\hbar^{2} \pi^{2}}{2m} \left( \frac{n_{x}^{2}}{L_{x}^{2}} + \frac{n_{y}^{2}}{L_{y}^{2}} + \frac{n_{z}^{2}}{L_{z}^{2}} \right) \label{8.3.1} \]
donde las dimensiones de la caja son\(L_{x} \times L_{y} \times L_{z}\) y\(n_{x}\),\(n_{y}\) y\(n_{z}\) son números enteros que corresponden al estado del electrón dentro de la caja.
Por ejemplo, considere el estado fundamental de una caja con infinitas paredes potenciales. \((n_{x},n_{y},n_{z})=(1,1,1)\)
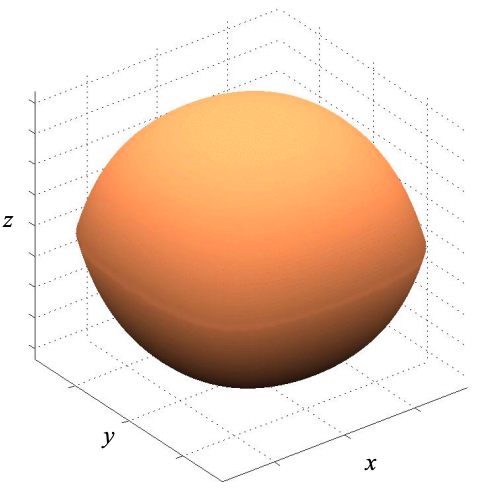
Ahora, considere la forma del orbital si cualquiera\(\psi_{x}(x)\) o\(\psi_{y}(y)\) o\(\psi_{z}(z)\) está en el primer estado excitado:\((n_{x},n_{y},n_{z})=(2,1,1)\),\((n_{x},n_{y},n_{z})=(1,2,1)\) o\((n_{x},n_{y},n_{z})=(1,1,2)\)
El orbital 1s es similar a\((n_{x},n_{y},n_{z})=(1,1,1)\). Los orbitales p son similares al primer estado excitado de la caja,\((n_{x},n_{y},n_{z})=(2,1,1)\) es decir, es similar a un\(p_{x}\) orbital,\((n_{x},n_{y},n_{z})=(1,2,1)\) es similar a un\(p_{y}\) orbital y\((n_{x},n_{y},n_{z})=(1,1,2)\) es similar a un\(p_{z}\) orbital.
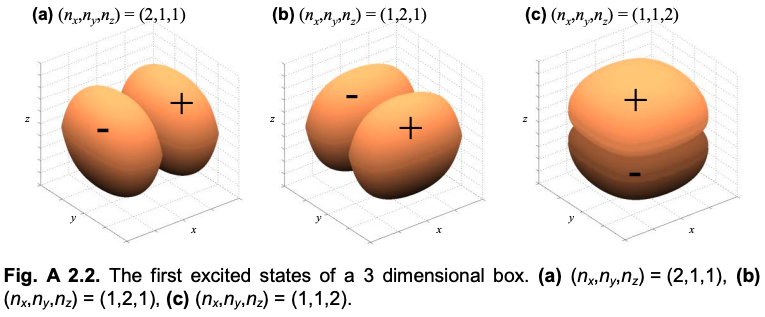
La aproximación pronto se descompone, sin embargo. El orbital 2s, que tiene la misma energía que los orbitales 2p, es más similar al orbital de caja\((n_{x},n_{y},n_{z})=(3,3,3)\), que tiene una energía significativamente mayor. Sin embargo, la caja sí ilustra la alineación de los tres orbitales p con los ejes x, y y z.

