1.2: Las fases y la clasificación de la materia
- Page ID
- 1794
HABILIDADES PARA DESARROLLAR
- Describir las propiedades básicas de cada estado físico de la materia: sólido, líquido y gas
- Definir y dar ejemplos de átomos y moléculas
- Clasificar la materia como un elemento, compuesto, una mezcla homogénea o mezcla heterogénea dependiendo de su estado físico y composición
- Distinguir entre la masa y el peso
- Aplicar la ley de conservación de la materia
La materia se define como cualquier cosa que ocupa espacio, tiene masa, y está a nuestro alrededor. Los sólidos y los líquidos son más obvios: podemos ver que ocupan espacio y su peso nos dice que tienen masa. Los gases también son materia; si los gases no ocuparan espacio, un globo se colapsaría en vez de inflarse cuando se llenará de gas.
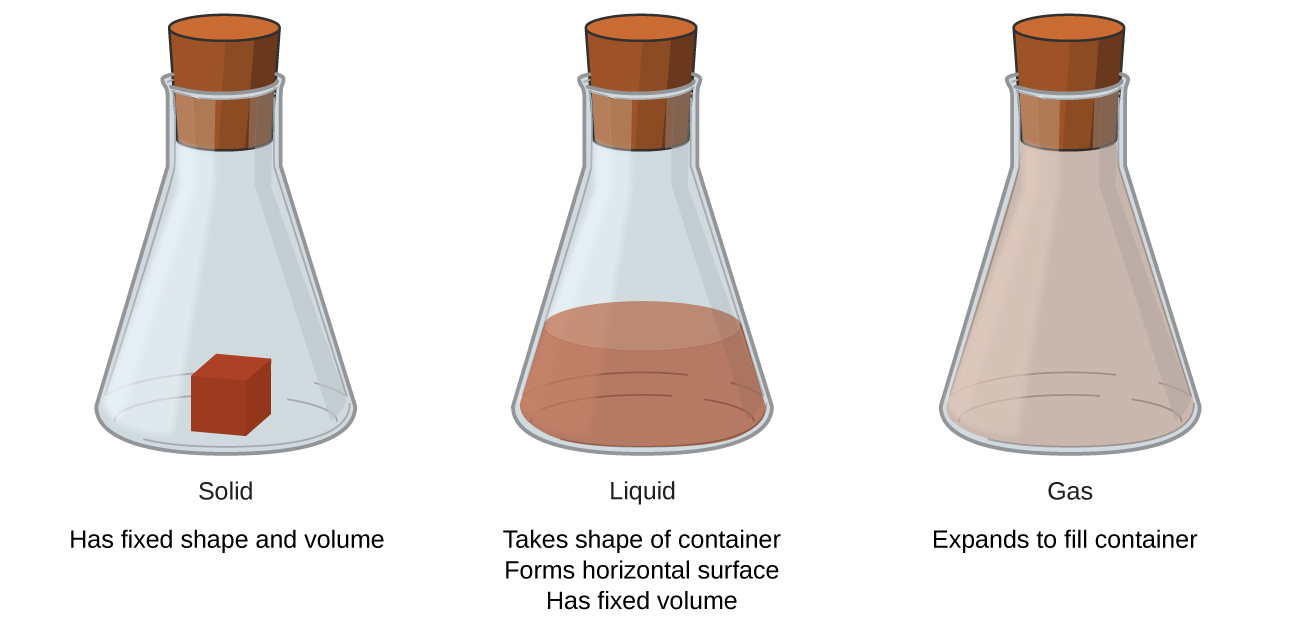
Sólidos, líquidos y gases son los tres estados de la materia que se encuentran comúnmente en la tierra (Figura \(\PageIndex{1}\)). Un sólido es rígido y tiene una forma definida. Un líquido fluye y toma la forma de un recipiente, excepto que forma una superficie superior plana o un poco curvada cuando se actúa por la gravedad. (En gravedad cero, los líquidos adoptan una forma esférica). Tanto las muestras líquidas como las sólidas tienen volúmenes que son casi independientes de la presión. Un gas toma tanto la forma como el volumen de su recipiente.
Un cuarto estado de la materia, el plasma, ocurre naturalmente en los interiores de las estrellas. El plasma es un estado gaseoso de la materia que contiene cantidades apreciables de partículas cargadas eléctricamente (Figura \(\PageIndex{2}\)). La presencia de estas partículas cargadas imparte propiedades únicas a los plasmas que justifican su clasificación como un estado de materia distinto de los gases. Además de las estrellas, los plasmas se encuentran en otros ambientes de alta temperatura (tanto naturales como artificiales), como rayos, ciertas pantallas de televisión e instrumentos analíticos especializados utilizados para detectar trazas de metales.

Video \(\PageIndex{1}\): En una pequeña célula de una televisión de plasma, el plasma emite luz ultravioleta, que en turno hace que la pantalla en ese lugar aparezca de un color específico. El compuesto de estos pequeños puntos de color conforma la imagen que se ve. Mire este video para obtener más información sobre el plasma y los lugares donde se encuentra.
Algunas muestras de materia parecen tener propiedades de sólidos, líquidos y / o gases al mismo tiempo. Esto puede ocurrir cuando la muestra está compuesta de muchas piezas pequeñas. Por ejemplo, podemos verter arena como si fuera un líquido porque está compuesta de muchos granos pequeños de arena sólida. La materia también puede tener propiedades de más de un estado cuando se trata como una mezcla, por ejemplo las nubes. Las nubes parecen comportarse de manera similar a los gases, pero en realidad son mezclas de aire (gas) y pequeñas partículas de agua (líquida o sólida).
La masa de un objeto es una medida de la cantidad de materia que contiene. Una forma de medir la masa de un objeto es medir la fuerza que se necesita para acelerar el objeto. Se necesita mucha más fuerza para acelerar un automóvil que una bicicleta porque el automóvil tiene mucha más masa. Una forma más común de determinar la masa de un objeto es usar un equilibrio para comparar su masa con una masa estándar.
Aunque el peso está relacionado con la masa, no es lo mismo. El peso se refiere a la fuerza que la gravedad ejerce sobre un objeto. Esta fuerza es directamente proporcional a la masa del objeto. El peso de un objeto cambia cuando cambia la fuerza de la gravedad, pero su masa no cambia. La masa de un astronauta no cambia solo porque va a la luna, pero su peso en la luna es solo una sexta parte de su peso en la Tierra porque la gravedad de la luna es solo una sexta parte de la de la Tierra. Puede sentirse "sin peso" durante su viaje cuando experimenta fuerzas externas insignificantes (gravitacionales o de otro tipo), aunque, por supuesto, nunca está "sin masa".
La ley de conservación de la materia resume muchas observaciones científicas sobre la materia: establece que no hay cambios detectables en la cantidad total de materia presente cuando la materia se convierte de un tipo a otro (un cambio químico) o cambios entre sólidos a estados líquidos o gaseosos (un cambio físico). La elaboración de cerveza y el funcionamiento de las baterías dan ejemplos de la conservación de la materia (Figura \(\PageIndex{4}\)). Durante la elaboración de la cerveza, los ingredientes (agua, levadura, granos, malta, lúpulo y azúcar) se convierten en cerveza (agua, alcohol, carbonatación y sustancias aromatizantes) sin pérdida real de la sustancia. Esto se ve más claramente durante el proceso del embotellado, cuando la glucosa se convierte en etanol y dióxido de carbono, y la masa total de las sustancias no cambia. Esto también se puede ver en una batería de plomo con ácido: las sustancias originales (plomo, óxido de plomo y ácido sulfúrico), que son capaces de producir electricidad, se convierten en otras sustancias (sulfato de plomo y agua) que no producen electricidad, sin cambio en la cantidad real de la materia.
Aunque esta ley de conservación es válida para todas las conversiones de materia, los ejemplos convincentes son muy pocos, fuera de las condiciones controladas en un laboratorio, rara vez recopilamos todo el material que se produce durante una conversión en particular. Por ejemplo, cuando usted come, digiere y asimila alimentos, toda la materia en el alimento original se conserva. Pero debido a que parte de la materia está incorporada en su cuerpo, y gran parte se excreta como varios tipos de desechos, es difícil de verificar por la medición.
Átomos y Moléculas
Un átomo es la partícula más pequeña de un elemento que tiene las propiedades de ese elemento y puede entrar en una combinación química. Por ejemplo, considere el elemento oro. Imagínese cortando una pepita de oro por la mitad, luego cortando una de las mitades por la mitad y repetir este proceso hasta que quede una pieza de oro que sea tan pequeña que no se pueda cortar por la mitad (independientemente de lo pequeño que pueda ser tu cuchillo). Esta pieza de oro de tamaño mínimo es un átomo (del griego atomos que significa "indivisible") (Figura 1.2.4). Este átomo ya no sería oro si se siguiera dividiendo.

La primera sugerencia de que la materia está compuesta de átomos se atribuye a los filósofos griegos Leucipo y Demócrito, quienes desarrollaron sus ideas en el siglo quinto antes de Cristo. Sin embargo, no fue hasta principios del siglo XIX que John Dalton (1766–1844), un maestro de escuela británico con un gran interés por la ciencia, apoyó esta hipótesis con medidas cuantitativas. Desde entonces, los experimentos repetidos han confirmado muchos aspectos de esta hipótesis, y se han convertido en una de las teorías centrales de la química. Otros aspectos de la teoría atómica de Dalton todavía se utilizan, pero con revisiones menores (los detalles de la teoría de Dalton se dan en el capítulo sobre átomos y moléculas).
Un átomo es tan pequeño que su tamaño es difícil de imaginar. Una de las cosas más pequeñas que podemos ver a simple vista es un solo hilo de una telaraña: estas hebras tienen un diámetro de aproximadamente 1/10,000 de un centímetro (0.0001 cm). Aunque la sección transversal de una hebra es casi imposible de ver sin un microscopio, es enorme en una escala atómica. Un solo átomo de carbono en la telaraña tiene un diámetro de alrededor de 0.000000015 centímetros, y tomaría alrededor de 7000 átomos de carbono para abarcar el diámetro de la cadena. Para poner esto en perspectiva, si un átomo de carbono fuera del tamaño de una moneda de diez centavos, la sección transversal de una hebra sería más grande que un campo de fútbol, lo que requeriría unos 150 millones de átomos de carbono para cubrirlo. (Figura \(\PageIndex{5}\)) muestra vistas microscópicas y atómicas cada vez más cercanas del algodón común.
Un átomo es tan ligero que su masa también es difícil de imaginar. Un billón de átomos de plomo (1,000,000,000 de átomos) pesan aproximadamente 3×10−13 gramos, una masa que es demasiado liviana para pesarla incluso en las balanzas más sensibles del mundo. Requeriría pesar más de 300,000,000,000,000 de átomos de plomo (300 trillones, o 3 × 1014) y pesaría solo 0.0000001 gramos.
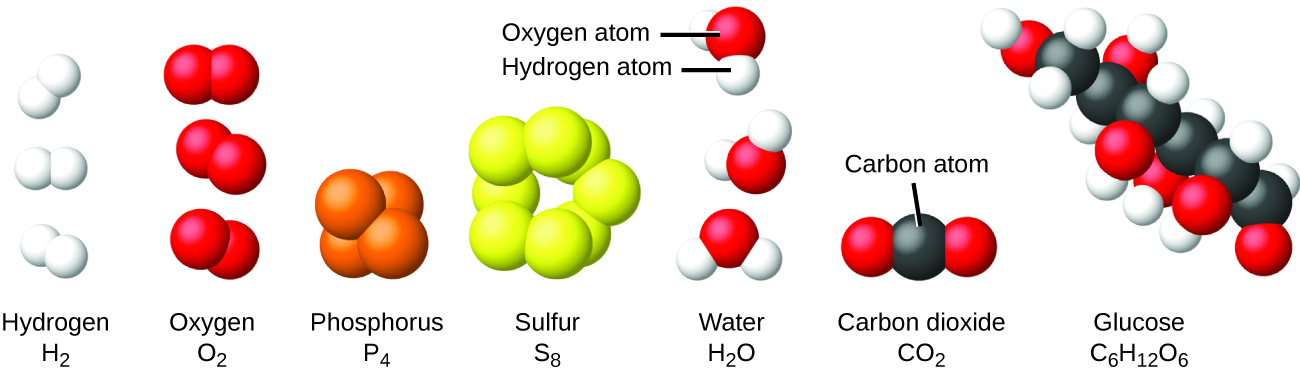
Es raro encontrar colecciones de átomos individuales. Solo unos pocos elementos, como los gases de helio, neón y argón, consisten en una colección de átomos individuales que se mueven de forma independiente unos de los otros. Otros elementos, como los gases de hidrógeno, nitrógeno, oxígeno y cloro, están compuestos de unidades que consisten en pares de átomos (Figura \(\PageIndex{6}\)). Una forma del elemento fósforo consiste en unidades compuestas de cuatro átomos de fósforo. El elemento azufre existe en varias formas, una de las cuales consiste en unidades compuestas de ocho átomos de azufre. Estas unidades se llaman moléculas. Una molécula consiste en dos o más átomos unidos por fuerzas fuertes llamadas enlaces químicos. Los átomos en una molécula se mueven como una unidad, al igual que las latas de soda en un paquete de seis o un montón de llaves unidas en un solo llavero. Una molécula puede consistir en dos o más átomos idénticos, como en las moléculas que se encuentran en los elementos hidrógeno, oxígeno y azufre, o puede consistir en dos o más átomos diferentes, como en las moléculas que se encuentran en el agua. Cada molécula de agua es una unidad que contiene dos átomos de hidrógeno y un átomo de oxígeno. Cada molécula de glucosa es una unidad que contiene 6 átomos de carbono, 12 átomos de hidrógeno y 6 átomos de oxígeno. Al igual que los átomos, las moléculas son increíblemente pequeñas y ligeras. Si un vaso de agua ordinario se ampliara al tamaño de la tierra, las moléculas de agua en su interior serían aproximadamente del tamaño de pelotas de golf.
Clasificando la materia
Podemos clasificar la materia en varias categorías. Dos amplias categorías son las mezclas y las sustancias puras. Una sustancia pura tiene una composición constante. Todas las muestras de una sustancia pura tienen exactamente la misma composición y propiedades. Cualquier muestra de sacarosa (azúcar de mesa) consiste de 42.1% de carbono, un 6.5% de hidrógeno y un 51.4% de oxígeno en masa. Cualquier muestra de sacarosa también tiene las mismas propiedades físicas, como el punto de fusión, el color y el dulzor, independientemente de la fuente de la que se aísla.
Podemos dividir las sustancias puras en dos clases: elementos y compuestos. Las sustancias puras que no se pueden descomponer a sustancias más simples por cambios químicos se llaman elementos. El hierro, la plata, el oro, el aluminio, el azufre, el oxígeno y el cobre son ejemplos familiares de los más de 100 elementos conocidos, de los cuales alrededor de 90 están presentes de forma natural en la Tierra, y aproximadamente dos docenas se han creado en laboratorios.
Las sustancias puras que se pueden descomponer por cambios químicos se llaman compuestos. Esta descompostura puede producir elementos u otros compuestos, o ambos. El óxido de mercurio (II), una naranja o sólido cristalino, se puede descomponer por calor a los elementos mercurio y oxígeno (Figura \(\PageIndex{7}\)). Cuando se calienta en ausencia del aire, el compuesto de sacarosa se descompone a el elemento carbono y el agua. (La etapa inicial de este proceso, cuando el azúcar se está volviendo marrón, se conoce como la caramelización, esto imparte el sabor característico dulce a las manzanas de caramelo, las cebollas caramelizadas y el caramelo). El cloruro de plata (I) es un sólido blanco que se puede descomponer en sus elementos, plata y cloro, por absorción de la luz. Esta propiedad es la base para el uso de este compuesto en películas fotográficas y gafas fotocromáticas (aquellas con lentes que se oscurecen cuando se exponen a la luz).

Las propiedades de los elementos combinados son diferentes de aquellas en el estado libre o no combinado. Por ejemplo, el azúcar blanco cristalino (sacarosa) es un compuesto resultante de la combinación química del elemento carbono, que es un sólido negro en una de sus formas no combinadas, y los dos elementos hidrógeno y oxígeno, que son gases sin color cuando no están combinados. El sodio libre, un elemento que es un sólido metálico brillante y el cloro libre, un elemento que es un gas amarillo verdoso, se combinan para formar el cloruro de sodio (sal de mesa), un compuesto que es un sólido blanco y cristalino.
Una mezcla se compone de dos o más tipos de materia que pueden estar presentes en cantidades variables y pueden estar separadas por cambios físicos, como la evaporación (aprenderá más sobre esto más adelante). Una mezcla con una composición que varía de un punto a otro se llama una mezcla heterogénea. El aderezo italiano es un ejemplo de una mezcla heterogénea (Figura \(\PageIndex{1a}\)). Su composición puede variar porque podemos hacerlo a partir de cantidades variables de aceite, vinagre y hierbas. No es lo mismo de un punto a otro de la mezcla: una gota puede ser principalmente vinagre, mientras que otra gota diferente puede ser principalmente aceite o hierbas porque el aceite y el vinagre se separan y las hierbas se asientan. Otros ejemplos de mezclas heterogéneas son las galletas con chispas de chocolate (podemos ver los trozos separados de chocolate, nueces y masa en las galletas) y el granito (podemos ver el cuarzo, la mica, el feldespato y más).
Una mezcla homogénea, también llamada una solución, exhibe una composición uniforme y aparece visualmente igual. Un ejemplo de una solución es una bebida deportiva, que consiste de agua, azúcar, colorantes, saborizantes y electrolitos mezclados uniformemente (Figura \(\PageIndex{1b}\)). Cada gota de una bebida deportiva sabe igual porque cada gota contiene las mismas cantidades de agua, azúcar y otros componentes. Tenga en cuenta que la composición de una bebida deportiva puede variar: se puede hacer con algo más o menos azúcar, saborizantes u otros componentes, y aun así es una bebida deportiva. Otros ejemplos de mezclas homogéneas incluyen aire, jarabe de arce, gasolina y una solución de sal en agua.

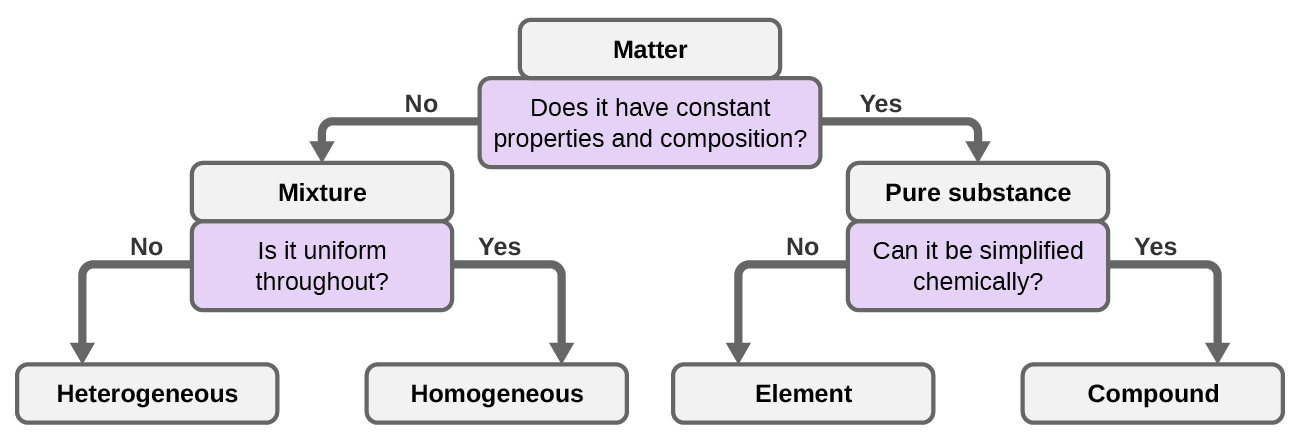
Aunque hay poco más de 100 elementos, decenas de millones de compuestos químicos resultan de diferentes combinaciones de estos elementos. Cada compuesto tiene una composición específica y tiene propiedades químicas y físicas definidas por las cuales podemos distinguirlo de todos los demás compuestos. Y, por supuesto, hay innumerables formas de combinar elementos y compuestos para formar diferentes mezclas. Un resumen de cómo distinguir entre las varias clasificaciones principales de materia se muestra en (Figura 1.2.8).
| Elemento | Símbolo | Porcentaje de Masa | Elemento | Símbolo | Porcentaje de Masa | |
|---|---|---|---|---|---|---|
| oxígeno | O | 49.20 | cloro | Cl | 0.19 | |
| silicio | Si | 25.67 | fósforo | P | 0.11 | |
| aluminio | Al | 7.50 | magnesio | Mn | 0.09 | |
| hierro | Fe | 4.71 | carbón | C | 0.08 | |
| calcio | Ca | 3.39 | azufre | S | 0.06 | |
| sodio | Na | 2.63 | bario | Ba | 0.04 | |
| potasio | K | 2.40 | nitrógeno | N | 0.03 | |
| magnesio | Mg | 1.93 | fluor | F | 0.03 | |
| hidrógeno | H | 0.87 | estroncio | Sr | 0.02 | |
| titanio | Ti | 0.58 | todos los otros | - | 0.47 |
Descomposición del agua / la producción del hidrógeno
El agua se compone de los elementos hidrógeno y oxígeno combinados en una proporción de 2 a 1. El agua se puede descomponer en el hidrógeno y los gases de oxígeno mediante la adición de la energía. Una forma de hacerlo es con una batería o fuente de alimentación, como se muestra en (Figura \(\PageIndex{9}\)).
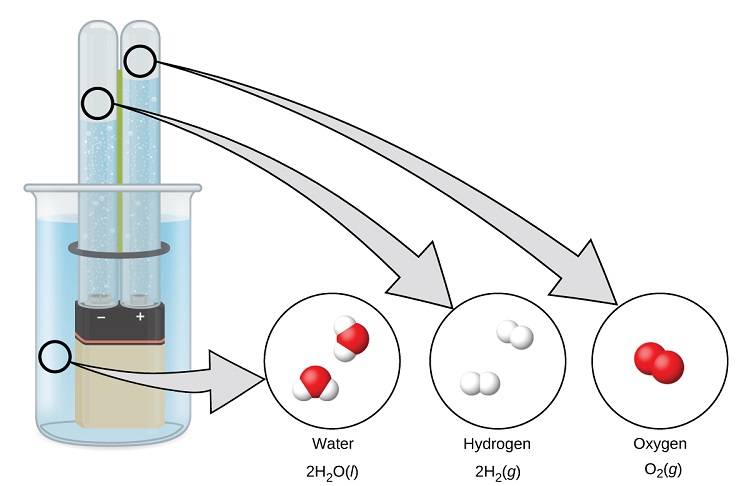
La descomposición del agua implica un reordenamiento de los átomos en las moléculas del agua a moléculas diferentes, cada una compuesta de dos átomos de hidrógeno y dos átomos de oxígeno. Dos moléculas de agua forman una molécula de oxígeno y dos moléculas de hidrógeno. La representación de lo que ocurre, \(\ce{2H2O}(l)\rightarrow \ce{2H2}(g)+\ce{O2}(g)\), se explorará con mayor profundidad en los capítulos que siguen.
Los dos gases producidos tienen propiedades claramente diferentes. El oxígeno no es inflamable, pero se requiere para la combustión de un combustible, y el hidrógeno es altamente inflamable y una potente fuente de energía. ¿Cómo se puede aplicar este conocimiento a nuestro mundo? Una aplicación involucra la investigación de un transporte más eficiente en el uso del combustible. Los vehículos de pila de combustible (FCVs) funcionan con el hidrógeno en lugar de la gasolina (Figura 1.2.10). Son más eficientes que los vehículos con motores de combustión interna no son contaminantes y reducen las emisiones de los gases de efecto invernadero, lo que nos hace menos dependientes de los combustibles fósiles. Sin embargo, los FCVs aún no son económicamente viables y la producción actual de hidrógeno depende del gas natural. Si podemos desarrollar un proceso para descomponer económicamente el agua, o producir hidrógeno de otra manera ambientalmente racional, los FCVs pueden ser el camino del futuro.
La química de los teléfonos celulares
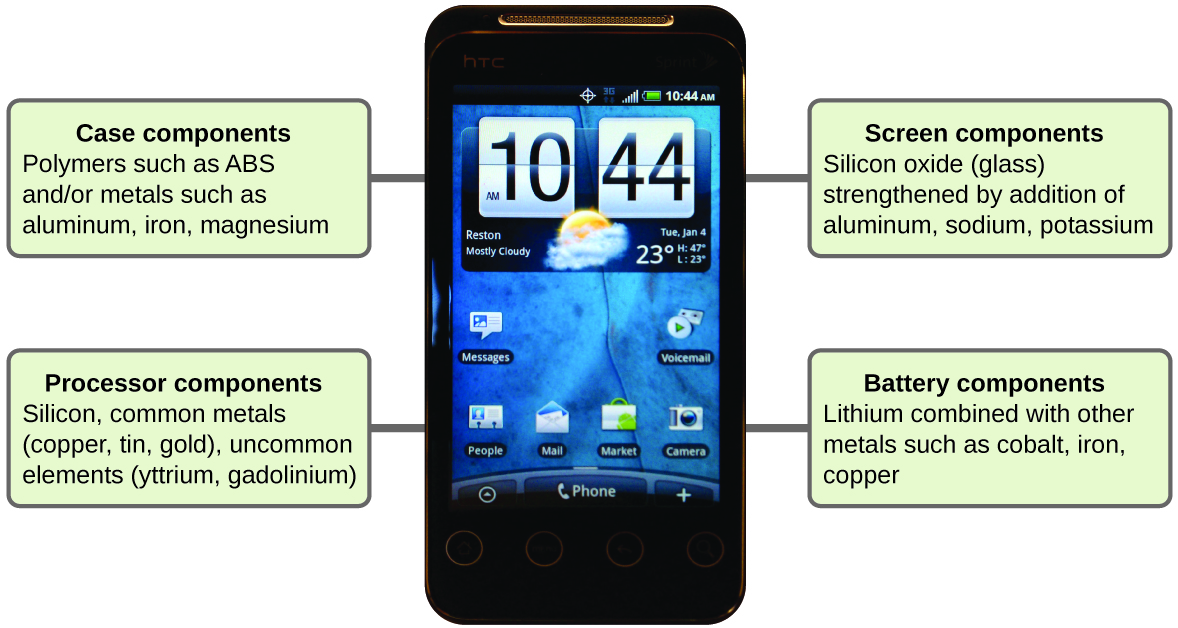
Imagine que diferente sería su vida sin los teléfonos celulares (Figura \(\PageIndex{11}\)) y otros dispositivos inteligentes. Los teléfonos celulares están hechos de numerosas sustancias químicas, que se extraen, refinan, purifican y ensamblan utilizando una comprensión extensa y profunda usando los principios químicos. Alrededor del 30% de los elementos que se encuentran en la naturaleza se encuentran dentro de un teléfono inteligente típico. El estuche/cuerpo/armazón consiste en una combinación de polímeros resistentes y duraderos compuestos principalmente del carbono, hidrógeno, oxígeno y nitrógeno [acrilonitrilo butadieno estireno (ABS) y termoplásticos de policarbonato] y metales estructurales livianos y fuertes, como el aluminio, magnesio, y el hierro. La pantalla de visualización está hecha de un vidrio especialmente templado (vidrio de sílice reforzado por la adición de aluminio, sodio y potasio) y recubierto con un material para hacerlo conductor (como el óxido de indio y estaño). La placa de circuito utiliza un material semiconductor (generalmente silicio); usa metales comúnmente usados como cobre, estaño, plata y oro; y elementos más desconocidos como itrio, praseodimio y gadolinio. La batería se basa en iones de litio y una variedad de otros materiales, incluyendo hierro, cobalto, cobre, óxido de polietileno y poliacrilonitrilo.
Resumen
La materia es cualquier cosa que ocupa espacio y tiene masa. El bloque de construcción básico de la materia es el átomo, la unidad más pequeña de un elemento que puede entrar en combinaciones con átomos del mismo u otros elementos. En muchas sustancias, los átomos se combinan en moléculas. En la tierra, la materia comúnmente existe en tres estados: sólidos, de forma y volumen fijos; líquidos, de forma variable, pero de volumen fijo; y gases, de forma y volumen variables. Bajo condiciones de alta temperatura, la materia también puede existir como plasma. La mayoría de la materia es una mezcla: se compone de dos o más tipos de materia que pueden estar presentes en cantidades variables y se pueden separar por medios físicos. Las mezclas heterogéneas varían en composición de un punto a otro; las mezclas homogéneas tienen la misma composición de un punto a otro. Las sustancias puras consisten en solo un tipo de materia. Una sustancia pura puede ser un elemento, que consiste de solo un tipo de átomo y no se puede descomponer por un cambio químico, o un compuesto, que consiste en dos o más tipos de átomos.
Glosario
- átomo
- Partícula más pequeña de un elemento que puede entrar en una combinación química.
- compuesto
- Sustancia pura que se puede descomponer en dos o más elementos.
- elemento
- Sustancia que se compone de un solo tipo de átomo; una sustancia que no se puede descomponer por un cambio.
- gas
- Estado en el que la materia no tiene volumen definido ni forma.
- mezcla heterogénea
- Combinación de sustancias con una composición que varía de un punto a otro.
- mezcla homogénea
- (también, solución) Combinación de sustancias con una composición que es uniforme en todo.
- líquido
- Estado de la materia que tiene un volumen definido, pero forma indefinida.
- Ley de conservación de la materia
- Cuando la materia se convierte de un tipo a otro o cambia de forma, no hay ningún cambio detectable en la cantidad total de la materia presente.
- masa
- Propiedad fundamental que indica la cantidad de materia.
- materia
- Todo lo que ocupa espacio y tiene masa.
- mezcla
- Materia que puede ser separada en sus componentes por medios físicos.
- molécula
- Colección unida de dos o más átomos de elementos iguales o diferentes.
- plasma
- Estado gaseoso de la materia que contiene un gran número de átomos y / o moléculas con carga eléctrica.
- sustancia pura
- Sustancia homogénea que tiene una composición constante.
- sólido
- El estado de la materia es rígido, tiene una forma definida y tiene un volumen bastante constante.
- peso
- Fuerza que la gravedad ejerce sobre un objeto.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


