8.3: Los enlaces múltiples
- Page ID
- 1864
Habilidades para desarrollar
- Describir los enlaces covalentes múltiples en términos de superposición orbital atómica.
- Relacionar el concepto de resonancia con los enlaces π y la deslocalización de los electrones
El modelo orbital híbrido parece explicar bien la geometría de las moléculas que involucran enlaces covalentes únicos. ¿También es capaz de describir moléculas que contienen enlaces dobles y triples? Ya hemos discutido que los enlaces múltiples consisten en enlaces σ y π. A continuación, podemos considerar cómo visualizamos estos componentes y cómo se relacionan con los orbitales híbridos. La estructura de Lewis del eteno, C2H4, nos muestra que cada átomo de carbono está rodeado por otro átomo de carbono y dos átomos de hidrógeno.
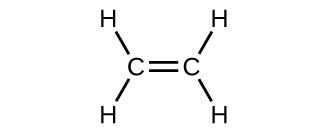
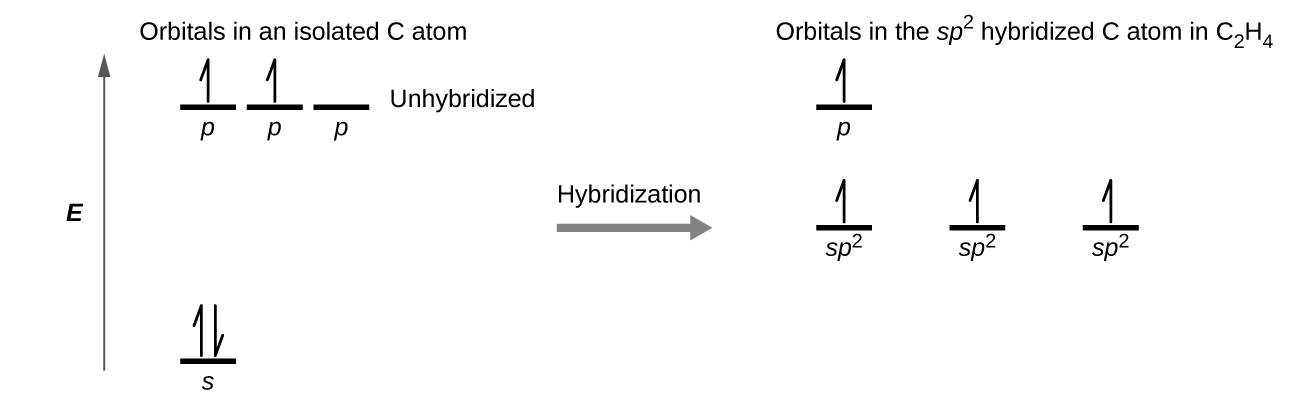
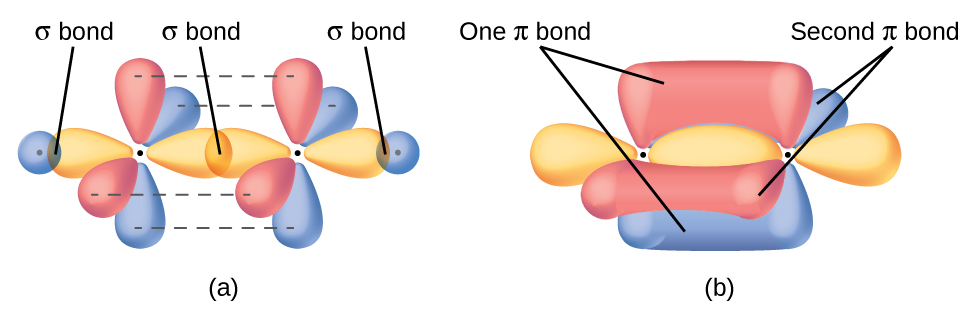
El enlace π en el enlace doble de C = C resulta de la superposición del tercer orbital 2p (restante) en cada átomo de carbono que no está involucrado en la hibridación. Este orbital p no hibridado (lóbulos que se muestran en rojo y azul en la Figura \(\PageIndex{2}\)) es perpendicular al plano de los orbitales híbridos sp2. Por lo tanto, los orbitales 2p no hibridados se superponen uno al lado del otro, por encima y por debajo del eje internuclear y forman un enlace π.
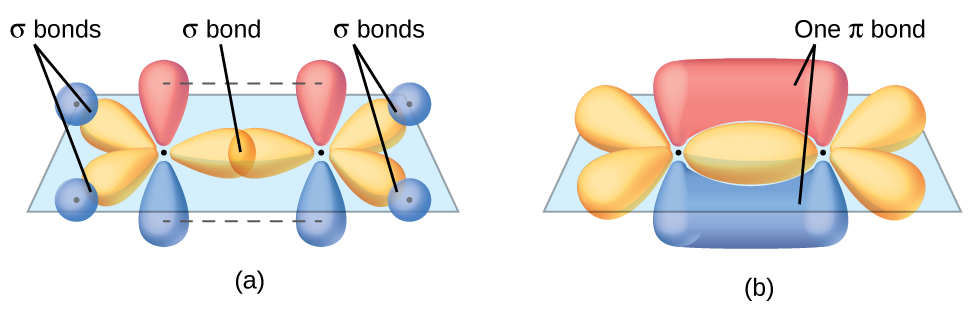
En una molécula del eteno, los cuatro átomos de hidrógeno y los dos átomos de carbono están todos en el mismo plano. Si los dos planos de los orbitales híbridos sp2 se inclinaran uno con respecto al otro, los orbitales p no estarían orientados para superponerse de manera eficiente para crear el enlace π. La configuración plana para la molécula del eteno ocurre porque es la disposición de unión más estable. Esta es una diferencia significativa entre los enlaces σ y π; la rotación alrededor de enlaces simples (σ) ocurre fácilmente porque la superposición orbital de extremo a extremo no depende de la orientación relativa de los orbitales en cada átomo en el enlace. En otras palabras, la rotación alrededor del eje internuclear no cambia la medida en que los orbitales de enlace σ se superponen porque la densidad del electrón de enlace es simétrica alrededor del eje. La rotación sobre el eje internuclear es mucho más difícil para enlaces múltiples; sin embargo, esto alteraría drásticamente la superposición fuera del eje de los orbitales de enlace π, esencialmente rompiendo el enlace π.
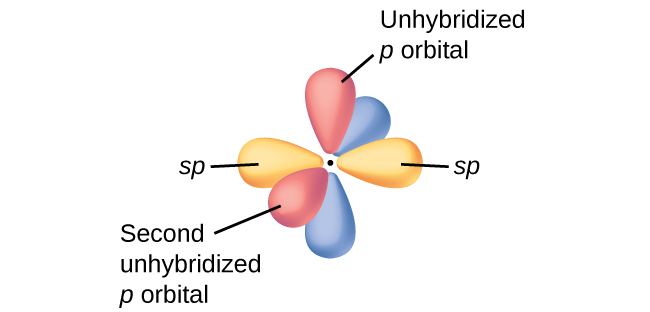
En las moléculas con orbitales híbridos sp, quedan dos orbitales p no hibridados en el átomo (Figura \(\PageIndex{3}\)). Encontramos esta situación en el acetileno, H − C≡C − H, que es una molécula lineal. Los orbitales sp híbridos de los dos átomos de carbono se superponen de extremo a extremo para formar un enlace σ entre los átomos de carbono (Figura \(\PageIndex{4}\)). Los orbitales sp restantes forman enlaces σ con átomos de hidrógeno. Los dos orbitales p no hibridados por el carbono se colocan de tal manera que se superponen uno al lado del otro y, por lo tanto, forman dos enlaces π. Los dos átomos de carbono del acetileno están unidos por un enlace σ y dos enlaces π, dando un triple enlace.
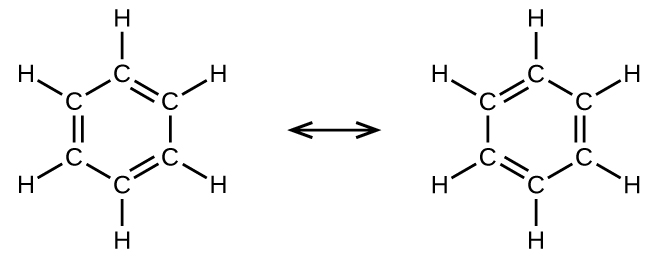
La hibridación involucra solo enlaces σ, pares de electrones solitarios y electrones únicos no apareados (radicales). Las estructuras que explican estas características describen la hibridación correcta de los átomos. Sin embargo, muchas estructuras también incluyen formas de resonancia. Recuerde que las formas de resonancia ocurren cuando son posibles varios arreglos de enlaces π. Dado que la disposición de los enlaces π involucra solo los orbitales no hibridados, la resonancia no influye en la asignación de la hibridación.
Por ejemplo, la molécula de benceno tiene dos formas de resonancia (Figura \(\PageIndex{5}\)). Podemos usar cualquiera de estas formas para determinar que cada uno de los átomos de carbono está unido a otros tres átomos sin pares solitarios, por lo que la hibridación correcta es sp2. Los electrones en los orbitales p no hibridados forman enlaces π. Ninguna estructura de resonancia describe completamente los electrones en los enlaces π. Los electrones no están ubicados en una posición u otra, pero en realidad están deslocalizados a lo largo de la molécula. La teoría del enlace de valencia no describe fácilmente la deslocalización. La unión en moléculas con formas de resonancia se describe mejor mediante la teoria orbital molecular.
Ejemplo \(\PageIndex{1}\): Asignación de Hibridación que involucra la resonancia
Alguna lluvia ácida resulta por la reacción del dióxido de azufre con el vapor del agua atmosférico, seguido por la formación del ácido sulfúrico. El dióxido de azufre, \(\ce{SO2}\), es un componente principal de los gases volcánicos, así como un producto de la combustión del carbón que contiene azufre. ¿Cuál es la hibridación del átomo \(S\) en \(\ce{SO2}\)?
Solución
Las estructuras de resonancia de \(\ce{SO2}\) son

El átomo de azufre está rodeado por dos enlaces y un par solitario de electrones en cualquier estructura de resonancia. Por lo tanto, la geometría del par de electrones es trigonal plana, y la hibridación del átomo de azufre es sp2.
Ejercicio \(\PageIndex{1}\)
Otro ácido en la lluvia ácida es el ácido nítrico, HNO3, que se produce por la reacción del dióxido de nitrógeno, NO2, con el vapor del agua atmosférico. ¿Cuál es la hibridación del átomo de nitrógeno en NO2? (Nota: el electrón solitario en nitrógeno ocupa un orbital hibridado como lo haría un par solitario).
- Respuesta
-
sp2
Resumen
Los enlaces múltiples consisten en un enlace σ ubicado a lo largo del eje entre dos átomos y uno o dos enlaces π. Los enlaces σ generalmente se forman por la superposición de los orbitales atómicos hibridados, mientras que los enlaces π se forman por la superposición de los orbitales no hibridados uno al lado del otro. La resonancia ocurre cuando hay múltiples orbitales no hibridados con la alineación apropiada para superponerse, por lo que la colocación de los enlaces π puede variar.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


