11.1: El proceso de la disolución
- Page ID
- 1886
habilidades para desarrollar
- Describir las propiedades básicas de las soluciones y cómo se forman.
- Predecir si una mezcla dada producirá una solución basada en las propiedades moleculares de sus componentes
- Explicar por qué algunas soluciones producen o absorben calor cuando se forman
Un capítulo anterior de este texto introdujo las soluciones, definidas como mezclas homogéneas de dos o más sustancias. A veces, un componente de una solución está presente en una concentración significativamente mayor, en cual caso se llama el solvente. Los otros componentes de la solución presentes en concentraciones relativamente bajas se llaman los solutos. El azúcar es un sólido covalente compuesto de moléculas de sacarosa, \(\ce{C12H22O11}\). Cuando este compuesto se disuelve en el agua, sus moléculas se distribuyen uniformemente entre las moléculas del agua:
\[\ce{C12H22O11 (s) ⟶ C12H22O11 (aq) } \label{Eq1}\]
El subíndice "aq" en la ecuación química significa que las moléculas de sacarosa son solutos y, por lo tanto, se dispersan individualmente en toda la solución acuosa (el agua es el disolvente). Aunque las moléculas de sacarosa son más pesadas que las moléculas del agua, permanecen dispersas por toda la solución; la gravedad no hace que se "asienten" con el tiempo.
El dicromato de potasio, \(\ce{K_2Cr_2O_7}\), es un compuesto iónico hecho de iones de potasio sin color, \(\mathrm{K^+}\) y los iones de dicromato de color naranja, \(\ce{Cr_2O_7^{2−}}\). Cuando se agrega una pequeña cantidad de dicromato de potasio sólido al agua, el compuesto se disuelve y se disocia para producir iones de potasio e iones de dicromato distribuidos uniformemente en toda la mezcla (Figura \(\PageIndex{1}\)), como se indica en esta ecuación:
\[\ce{K2Cr2O7(s) ⟶ 2K^{+} (aq) + Cr2O7^{2-} (aq)} \label{Eq2}\]
Al igual que con la mezcla del azúcar y el agua, esta mezcla también es una solución acuosa. Sus solutos, los iones de potasio y de dicromato, permanecen dispersos individualmente entre las moléculas del solvente (el agua).

El agua se usa con tanta frecuencia como solvente que la palabra solución ha llegado a implicar una solución acuosa para muchas personas. Sin embargo, casi cualquier gas, líquido o sólido puede actuar como un solvente. Muchas aleaciones son soluciones sólidas de un metal disuelto en otro; por ejemplo, las monedas estadounidenses de cinco centavos contienen el níquel disuelto en el cobre. El aire es una solución gaseosa, una mezcla homogénea de nitrógeno, oxígeno y varios otros gases. El oxígeno (un gas), el alcohol (un líquido) y el azúcar (un sólido) se disuelven en el agua (un líquido) para formar soluciones líquidas. La tabla \(\PageIndex{1}\) da ejemplos de varias soluciones diferentes y las fases de los solutos y los solventes.
| Solución | Soluto | Solvente |
|---|---|---|
| aire | O2(g) | N2(g) |
| refresco | CO2(g) | H2O(l) |
| hidrógeno en paladio | H2(g) | Pd(s) |
| alcohol desinfectante | H2O(l) | C3H8O(l) (2-propanol) |
| agua salada | NaCl(s) | H2O(l) |
| cobre | Zn(s) | Cu(s) |
Las soluciones exhiben estas características definitorias:
- Son homogéneos; es decir, después de mezclar una solución, tiene la misma composición en todos los puntos de la solución (su composición es uniforme).
- El estado físico de una solución (sólido, líquido o gaseoso) es típicamente el mismo que el del solvente, como lo demuestran los ejemplos en la Tabla \(\PageIndex{1}\).
- Los componentes de una solución se dispersan a una escala molecular; es decir, consisten en una mezcla de moléculas separadas, átomos y/o iones.
- El soluto disuelto en una solución no se asentará ni se separará del solvente.
- La composición de una solución, o las concentraciones de sus componentes, se pueden variar continuamente, dentro de ciertos límites.
La formación de las soluciones
La formación de una solución es un ejemplo de un proceso espontáneo, un proceso que ocurre bajo condiciones específicas sin el requerimiento de energía de alguna fuente externa. Algunas veces removemos una mezcla para acelerar el proceso de disolución, pero esto no es necesario; se formará una solución homogénea si esperamos lo suficiente. El tema de la espontaneidad es de importancia crítica para el estudio de la termodinámica química y se discute en más profundidad en un capítulo posterior de este texto. Para los propósitos de la discusión de este capítulo, será suficiente considerar dos criterios que favorecen, pero no garantizan, la formación espontánea de una solución:
1. una disminución en la energía interna del sistema (un cambio exotérmico, como se discutió en el capítulo anterior sobre la termoquímica)
2. un aumento en el desorden en el sistema (que indica un aumento en la entropía del sistema, como aprenderá en el capítulo posterior sobre la termodinámica)
A veces, pero no siempre, en el proceso de la disolución se produce un cambio de energía interna a medida que el calor se absorbe o evoluciona. Un aumento en el desorden siempre resulta cuando se forma una solución.
Cuando la intensidad de las fuerzas de atracción intermoleculares entre los solutos y los solventes en una solución no son diferentes a las fuerzas de atracción intermoleculares presentes en los componentes separados, la solución se forma sin cambios de energía. Tal solución se llama una solución ideal. Una mezcla de gases ideales (o gases como el helio y el argón, que se acercan mucho al comportamiento ideal) es un ejemplo de una solución ideal, ya que las entidades que comprenden estos gases no experimentan atracciones intermoleculares significativas.
Cuando se conectan contenedores de helio y argón, los gases se mezclan espontáneamente debido a la difusión y forman una solución (Figura \(\PageIndex{2}\)). La formación de esta solución claramente implica un aumento en el desorden, ya que los átomos de helio y argón ocupan un volumen dos veces mayor que el que cada gas ocupaba antes de mezclar.
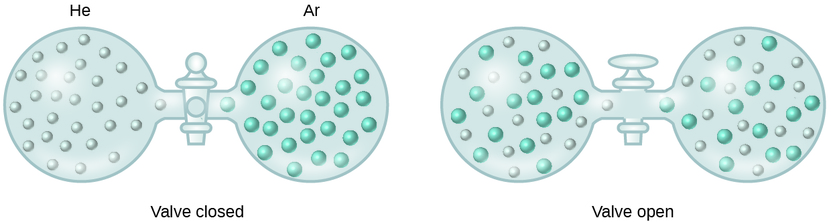
También se pueden formar soluciones ideales cuando se mezclan líquidos con estructuras similares. Por ejemplo, las mezclas de los alcoholes como el metanol (CH3OH) y el etanol (C2H5OH) forman soluciones ideales, al igual que las mezclas de los hidrocarburos del pentano, \(\ce{C5H12}\) y el hexano, \(\ce{C6H14}\). La colocación del metanol y el etanol, o el pentano y el hexano, en las bombillas que se muestran en la Figura \(\PageIndex{2}\) dará como resultado la misma difusión y posteriormente la mezcla de estos líquidos como se observa para los gases He y Ar (aunque a una tasa mucho más lenta), dando soluciones sin cambios significativos en la energía. Diferente a una mezcla de gases, los componentes de estas soluciones de líquido-líquido experimentan fuerzas de atracción intermoleculares. Pero dado que las moléculas de las dos sustancias que se mezclan son estructuralmente muy similares, las fuerzas de atracción intermoleculares entre moléculas similares y distintas son esencialmente las mismas, y el proceso de la disolución, por lo tanto, no implica ningún aumento o disminución apreciable de energía. Estos ejemplos ilustran cómo la difusión sola puede proporcionar la fuerza impulsora requerida para causar la formación espontánea de una solución. Sin embargo, en algunos casos, las magnitudes relativas de las fuerzas de atracción intermoleculares entre las especies de solutos y solventes pueden evitar la disolución.
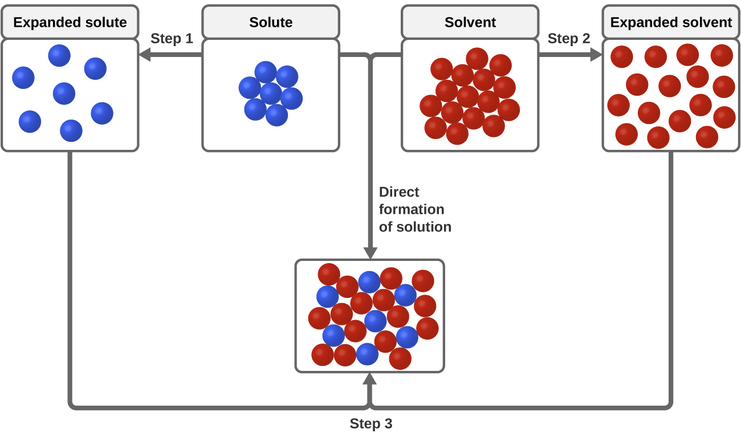
Tres tipos de fuerzas de atracción intermoleculares son relevantes para el proceso de la disolución: soluto-soluto, solvente-solvente y soluto-solvente. Como se ilustra en la Figura \(\PageIndex{3}\), la formación de una solución se puede ver como un proceso paso a paso en el que la energía se consume para superar las atracciones de soluto-soluto y de solvente-solvente (procesos endotérmicos) y se libera cuando las atracciones de soluto-solvente se establecen (un proceso exotérmico llamado la solvatación). Las magnitudes relativas de los cambios de energía asociados con estos procesos por etapas determinan si el proceso de disolución en general liberará o absorberá la energía. En algunos casos, las soluciones no se forman porque la energía requerida para separar las especies de soluto y solvente es mucho mayor que la energía liberada por la solvatación.

Por ejemplo, los aceites de cocina y el agua no se mezclarán de manera apreciable para obtener soluciones (Figura \(\PageIndex{4}\)). El enlace de hidrógeno es la fuerza de atracción intermolecular dominante presente en el agua líquida; las moléculas de hidrocarburos no polares de los aceites de cocina no son capaces de unirse al hidrógeno, sino que se mantienen unidas por las fuerzas de dispersión. La formación de una solución de agua y aceite requeriría superar el enlace fuerte de hidrógeno en el agua, así como las fuerzas de dispersión significativamente fuertes entre las moléculas de aceite relativamente grandes. Y, dado que las moléculas de agua son polares y las moléculas de aceite son no polares no experimentarían una atracción intermolecular muy fuerte, la solvatación liberaría muy poca energía.
Por otro lado, una mezcla del etanol y el agua se mezclará en cualquier proporción para producir una solución. En este caso, ambas sustancias son capaces de unirse con el hidrógeno, por lo que el proceso de solvatación es suficientemente exotérmico para compensar las separaciones endotérmicas de las moléculas del soluto y del solvente.

Como se explicó al comienzo de este módulo, los procesos de la disolución exotérmica favorecen, pero no garantizan, la formación de las soluciones espontáneas. Mientras que muchos compuestos solubles, de hecho, se disuelven con la liberación de calor, algunos se disuelven endotérmicamente. El nitrato de amonio (NH4NO3) es uno de esos ejemplos y se usa para hacer compresas frías instantáneas para tratar lesiones como la que se muestra en la Figura \(\PageIndex{5}\). Una bolsa plástica de agua de paredes delgadas está sellada dentro de una bolsa más grande con NH4NO3 sólido. Cuando se rompe la bolsa más pequeña, se forma una solución de NH4NO3, que absorbe el calor de los alrededores (el área lesionada a la que se aplica el paquete) y proporciona una compresa fría que disminuye la hinchazón. Las disoluciones endotérmicas como esta requieren una mayor entrada de energía para separar las especies de solutos que la que se recupera cuando los solutos están solvatados, pero no obstante son espontáneos debido al aumento del desorden que acompaña la formación de la solución.
Video \(\PageIndex{1}\): Mire este breve video que ilustra los procesos de la disolución endotérmica y exotérmica.
Resumen
Se forma una solución cuando dos o más sustancias se combinan físicamente para producir una mezcla que es homogénea a nivel molecular. El solvente es el componente más concentrado y determina el estado físico de la solución. Los solutos son los otros componentes típicamente presentes en concentraciones menores que la del solvente. Las soluciones se pueden formar endotérmicamente o exotérmicamente, dependiendo de las magnitudes relativas de las fuerzas de atracción intermoleculares del soluto y del disolvente. Se forman soluciones ideales sin un cambio apreciable en la energía.
Notas al pie de la página
- Si se observan burbujas de gas dentro del líquido, la mezcla no es homogénea y, por lo tanto, no es una solución.
Glosario
- aleación
- mezcla sólida de un elemento metálico y uno o más elementos adicionales
- solución ideal
- solución que se forma sin un cambio de energía que lo acompañe
- solvatación
- proceso exotérmico en el que se establecen fuerzas de atracción intermoleculares entre el soluto y el disolvente en una solución
- proceso espontáneo
- cambio físico o químico que ocurre sin la adición de energía de una fuente externa
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


