19.1: Las propiedades de los metales de transición y sus compuestos
- Page ID
- 1966
Habilidades para desarrollar
- Resumir el enfoque general usado en el aislamiento de los metales de transición de las fuentes naturales
- Describir las propiedades físicas y químicas típicas de los metales de transición
- Identificar las clases de compuestos simples para los metales de transición y describir sus propiedades químicas
Tenemos contacto diario con muchos metales de transición. El hierro se encuentra en todas las partes, desde los anillos en su cuaderno de espiral y los cubiertos en su cocina hasta los automóviles, los barcos, los edificios y en la hemoglobina en su sangre. El titanio es útil en la fabricación de productos ligeros y duraderos como los cuadros de bicicleta, las caderas artificiales y las joyas. El cromo es útil como un revestimiento protector en los accesorios de plomería y detalles de automóviles.
Los metales de transición se definen como aquellos elementos que tienen (o forman fácilmente) orbitales d parcialmente llenos. Como se muestra en la Figura \(\PageIndex{2}\), los elementos del bloque d en los grupos 3–11 son elementos de transición. Los elementos del bloque f, también llamados los metales de transición internos (los lantánidos y actínidos), también completan este criterio porque el orbital d está parcialmente ocupado antes que los orbitales f. Los orbitales d se llenan con la familia del cobre (grupo 11); por esta razón, la siguiente familia (grupo 12) técnicamente no son elementos de transición. Sin embargo, los elementos del grupo 12 muestran algunas de las mismas propiedades químicas y se incluyen comúnmente en las discusiones sobre los metales de transición. Algunos químicos tratan los elementos del grupo 12 como los metales de transición.

Figura \(\PageIndex{1}\): Los metales de transición a veces forman complejos con colores vibrantes. Los minerales malaquita (verde), azurita (azul) y proustita (rojo) son algunos ejemplos. (crédito de la izquierda: modificación del trabajo de James St. John; crédito del medio: modificación del trabajo de Stephanie Clifford; crédito de la derecha: modificación del trabajo de Terry Wallace)
Los elementos del bloque d se dividen en la primera serie de transición (los elementos Sc a Cu), la segunda serie de transición (los elementos Y a Ag) y la tercera serie de transición (el elemento La y los elementos Hf a Au). El actinio, Ac, es el primer miembro de la cuarta serie de transición, que también incluye Rf a Rg.

Figura \(\PageIndex{2}\): Los metales de transición se encuentran en los grupos 3-11 de la tabla periódica. Los metales de transición internos están en las dos filas debajo del centro de la tabla.
Los elementos del bloque f son los elementos Ce a Lu, que constituyen la serie de los lantánidos (o la serie de los lantanoides), y los elementos Th a Lr, que constituyen la serie de los actínidos (o la serie de los actinoides). Debido a que el lantano actúa muy similarmente a los elementos lantánidos, se considera un elemento lantánido, aunque su configuración electrónica lo convierte en el primer miembro de la tercera serie de transición. Similarmente, el comportamiento del actinio significa que es parte de la serie de los actínidos, aunque su configuración electrónica lo convierte en el primer miembro de la cuarta serie de transición.
Ejemplo \(\PageIndex{1}\): Los electrones de valencia en los metales de transición
Repase cómo escribir las configuraciones electrónicas, que se discute en el capítulo sobre la estructura electrónica y las propiedades periódicas de los elementos. Recuerde que para los metales de transición y de transición internos, es necesario eliminar los electrones s antes que los electrones d o f. Luego, para cada ion, dé la configuración electrónica:
- cerio (III)
- plomo (II)
- Ti2+
- Am3+
- Pd2+
Para los ejemplos que son metales de transición, determine a qué serie pertenecen.
Solución
Para los iones, los electrones de valencia se pierden antes que los electrones de los orbitales d o f.
- Ce3+[Xe]4f1; Ce3+es un elemento de transición interno en la serie de los lantánidos.
- Pb2+[Xe]6s25d104f14; los electrones se pierden del orbital p. Este es un elemento principal del grupo.
- titanio (II) [Ar]3d2; primera serie de transición
- americio (III) [Rn]5f6; actínido
- paladio (II) [Kr]4d8; segunda serie de transición
Ejercicio \(\PageIndex{1}\)
Verifique su aprendizaje Dé un ejemplo de un ion de la primera serie de transición sin electrones del orbital d.
- Respuesta
-
V5+ es una posibilidad. Otros ejemplos incluyen Sc3+, Ti4+, Cr6+, y Mn7+.
Los usos de los lantánidos en los dispositivos
Los lantánidos (elementos 57–71) son bastante abundantes en la corteza terrestre, a pesar de su caracterización histórica como elementos de tierras raras. El tulio, el lantanoide natural más raro, es más común en la corteza terrestre que la plata (4.5 x 10−5 % versus 0.79 x 10−5 % en masa). Hay 17 elementos de tierras raras, que consisten en los 15 lantanoides más el escandio y el itrio. Estos elementos se consideran raros porque alguna vez fueron difíciles de extraer económicamente, por eso muy raro tener una muestra pura; debido a las propiedades químicas similares, es difícil separar un lantánido de los demás. Sin embargo, los métodos de separación más nuevos, como las resinas de intercambio iónico similares a las que se encuentran en los ablandadores de agua domésticos, hacen que la separación de estos elementos sea más fácil y económica. La mayoría de los minerales que contienen estos elementos tienen concentraciones bajas de todos los elementos de tierras raras mezclados.
Las aplicaciones comerciales de los lantánidos están creciendo rápidamente. Por ejemplo, el europio es importante en las pantallas planas que se encuentran en los monitores de las computadoras, los teléfonos celulares y los televisores. El neodimio es útil en los discos duros de las computadoras portátiles y en los procesos que convierten el petróleo crudo en gasolina (Figura \(\PageIndex{3}\)). El holmio se encuentra en los equipos médicos y dentales. Además, muchas tecnologías de energía alternativa dependen de los lantanoides. El neodimio y el disprosio son componentes clave de los motores de vehículos híbridos y los imanes utilizados en las turbinas eólicas.

Figura \(\PageIndex{3}\): (a) El europio se usa en las pantallas de visualización de los televisores, los monitores de ordenador y los teléfonos móviles. (b) Los imanes de neodimio se encuentran comúnmente en los discos duros de las computadoras. (crédito b: modificación del trabajo de “KUERT Datenrettung” / Flickr)
Dado que la demanda de los materiales conteniendo lantánidos ha aumentado más rápidamente que el suministro, los precios también han aumentado. En 2008, el disprosio costaba 110 dólares el kg; para 2014, el precio había aumentado a $470/kg. Aumentando el suministro de los elementos lantanoides es uno de los desafíos más importantes que enfrentan las industrias que dependen de las propiedades ópticas y magnéticas de estos materiales.
Los elementos de transición tienen muchas propiedades en común con otros metales. Casi todos son sólidos duros con un alto punto de fusión que conducen el calor y la electricidad muy bien. Pueden fácilmente producir aleaciones y pierden electrones para formar cationes estables. Además, los metales de transición forman una extensa variedad de compuestos con coordinaciones estables, en los que el átomo o ión metálico central actúa como un ácido de Lewis y acepta uno o más pares de electrones. Muchas moléculas e iones diferentes pueden donar pares solitarios al metal en el centro, sirviendo como bases de Lewis. En este capítulo, nos enfocaremos principalmente en el comportamiento químico de los elementos de la primera serie de transición.
Las propiedades de los elementos de transición
Los metales de transición demuestran varios comportamientos químicos. Como se puede ver en sus potenciales de reducción (Tabla P1), algunos metales de transición son agentes reductores fuertes, mientras que otros tienen una reactividad muy baja. Por ejemplo, todos los lantánidos forman cationes 3+ acuosos estables. La fuerza impulsora de estas oxidaciones es similar a la de los metales alcalinotérreos como Be o Mg, que forman Be2+ y Mg2+. Por otro lado, los materiales como el platino y el oro tienen un potencial de reducción mucho más grande. Su capacidad para resistir la oxidación los convierte en materiales útiles para la construcción de los circuitos y la joyería.
Los iones de los elementos d-block más ligeros, como Cr3+, Fe3+ y Co2+, forman iones hidratados coloridos que son estables en el agua. Sin embargo, los iones en el período por debajo de estos (Mo3+, Ru3+ e Ir2+) son inestables y reaccionan fácilmente con el oxígeno en el aire. La mayoría de los iones simples estables en el agua formados por los elementos del bloque d más pesados son oxianiones como \(\ce{MoO4^2-}\) y \(\ce{ReO4-}\).
El rutenio, el osmio, el rodio, el iridio, el paladio y el platino son los metales del platino. Con dificultad, forman cationes simples que son estables en el agua y diferentemente a los elementos de la segunda y tercera serie de transición, no forman oxianiones estables.
Ambos elementos del bloque d y f reaccionan con los no metales para formar los compuestos binarios; a veces se necesita el calentamiento. Estos elementos reaccionan con los halógenos para formar una variedad de haluros que varían en estado de oxidación desde 1+ a 6+. Al calentarse, el oxígeno reacciona con todos los elementos de transición excepto el paladio, platino, plata y oro. Los óxidos de estos últimos metales se pueden formar usando otros reactivos, pero se descomponen al calentarlos. Los elementos del bloque f, los elementos del grupo 3 y los elementos de la primera serie de transición, excepto el cobre, reaccionan con las soluciones acuosas de ácidos y forman el gas hidrógeno y soluciones de las sales correspondientes.
Los metales de transición pueden formar compuestos con varios estados de oxidación. Algunos de los estados de oxidación observados de los elementos de la primera serie de transición se muestran en la Figura \(\PageIndex{4}\). A medida que nos movemos de izquierda a derecha a lo largo de la primera serie de transición, observamos que los estados de oxidación comunes suben al principio hasta un máximo hacia el centro de la tabla y luego disminuye. Los valores de la tabla son valores típicos; existen otros valores conocidos, y es posible sintetizar nuevas adiciones. Por ejemplo, en 2014, los investigadores lograron sintetizar un nuevo estado de oxidación del iridio (9+).
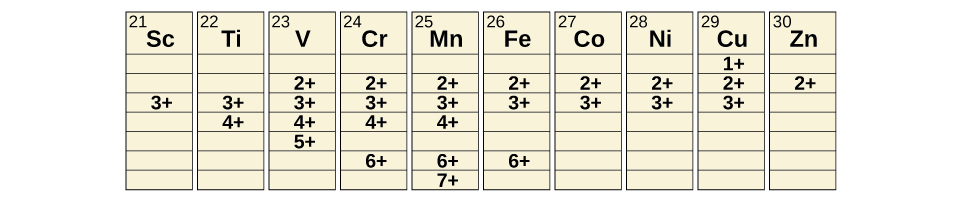
Figura \(\PageIndex{4}\): Los metales de transición de la primera serie de transición pueden formar compuestos con diferentes estados de oxidación.
Para los elementos desde escandio a manganeso (la primera mitad de la primera serie de transición), el estado de oxidación más alto corresponde a la pérdida de todos los electrones en los orbitales s y d de sus capas de valencia. Por ejemplo, el ion titanio (IV) se forma cuando el átomo de titanio pierde sus dos electrones 3d y sus dos electrones 4s. Estos estados de oxidación más altos son las formas más estables de escandio, titanio y vanadio. Sin embargo, no se pueden eliminar todos los electrones de valencia de los metales a medida que avanzamos en la serie. Se sabe que el hierro forma estados de oxidación desde 2+ a 6+, siendo el hierro (II) y el hierro (III) los más comunes. La mayoría de los elementos de la primera serie de transición forman iones con una carga de 2+ o 3+ que son estables en el agua, aunque los de los primeros miembros de la serie se pueden oxidar fácilmente por el aire.
Los elementos de la segunda y tercera serie de transición generalmente son más estables en estados de oxidación más altos que los elementos de la primera serie. Generalmente, el radio atómico aumenta en un grupo, lo que hace que los iones de la segunda y tercera serie sean más grandes que los de la primera. Es más fácil eliminar electrones de los orbitales que se encuentran más lejos del núcleo que eliminar electrones cerca del núcleo. Por ejemplo, el molibdeno y el tungsteno, miembros del grupo 6, están limitados principalmente a un estado de oxidación de 6+ en una solución acuosa. El cromo, el miembro más ligero del grupo, forma iones Cr3+ estables en el agua y, en la ausencia del aire, iones Cr2+ menos estables. El sulfuro con el estado de oxidación más alto para el cromo es Cr2S3, que contiene el ion Cr3+. El molibdeno y el tungsteno forman sulfuros en los que los metales exhiben estados de oxidación de 4+ y 6+.
Ejemplo \(\PageIndex{2}\): La actividad de los metales de transición
¿Cuál es el agente oxidante más fuerte en una solución ácida: el ión dicromato, que contiene cromo (VI), el ión permanganato, que contiene manganeso (VII), o el dióxido de titanio, que contiene titanio (IV)?
Solución
Primero, necesitamos buscar las medias reacciones de reducción (Tabla P1) para cada óxido en el estado de oxidación especificado:
\[\ce{Cr2O7^2- + 14H+ + 6e- ⟶ 2Cr^3+ + 7H2O} \hspace{20px} \mathrm{+1.33\: V}\]
\[\ce{MnO4- + 8H+ + 5e- ⟶ Mn^2+ + H2O} \hspace{20px} \mathrm{+1.51\: V}\]
\[\ce{TiO2 + 4H+ + 2e- ⟶ Ti^2+ + 2H2O} \hspace{20px} \mathrm{−0.50\: V}\]
Un potencial de reducción mayor significa que es más fácil de reducir que el reactivo. El permanganato, con el mayor potencial de reducción, es el oxidante más fuerte en estas condiciones. El dicromato es el siguiente, seguido por el dióxido de titanio como el agente oxidante más débil (el más difícil de reducir) de este conjunto.
Ejercicio \(\PageIndex{2}\)
Prediga cuál reacción (si la hubiera) ocurrirá entre HCl y Co(s), y entre HBr y Pt(s). Necesitarás usar los potenciales de reducción estándar de (Tabla P1).
- Respuesta
-
\(\ce{Co}(s)+\ce{2HCl}⟶\ce{H2}+\ce{CoCl2}(aq)\); no reacciona porque Pt(s) no es oxidado por by H+
La preparación de los elementos de transición
Las civilizaciones antiguas sabían del hierro, el cobre, la plata y el oro. Los períodos de tiempo en la historia de la humanidad conocidos como la Edad del Bronce y la Edad del Hierro marcan los avances en los que las sociedades aprendieron a aislar ciertos metales y usarlos para fabricar herramientas y bienes. Los minerales naturales de cobre, plata y oro pueden contener altas concentraciones de estos metales en forma elemental (Figura \(\PageIndex{5}\)). El hierro, por otro lado, se encuentra en la tierra casi exclusivamente en formas oxidadas, como el óxido (Fe2O3). Los primeros implementos del hierro se hicieron a partir de los meteoritos de hierro. Los artefactos de hierro sobrevivientes que datan de aproximadamente 4000 a 2500 B.C. son raros, pero todos los ejemplos conocidos contienen aleaciones específicas de hierro y níquel que se encuentran solo en objetos extraterrestres, no en la tierra. Se necesitaron miles de años de avances tecnológicos antes de que las civilizaciones desarrollaran la fundición de hierro, la capacidad de extraer un elemento puro de sus minerales naturales y que las herramientas de hierro se volvieran comunes.

Figura \(\PageIndex{5}\): Los metales de transición se presentan en la naturaleza en varias formas. Los ejemplos incluyen (a) una pepita de cobre, (b) un depósito de oro y (c) un mineral que contiene el hierro oxidado. (crédito a: modificación del trabajo por http://images-of-elements.com/copper-2.jpg; crédito c: modificación del trabajo por http://images-of-elements.com/iron-ore.jpg)
Generalmente, los elementos de transición se extraen de minerales que se encuentran en una variedad de minerales. Sin embargo, la facilidad de su extracción varía mucho, dependiendo de la concentración del elemento en el mineral, la identidad de los otros elementos presentes y la dificultad de reducir el elemento a un metal libre.
En general, no es difícil reducir los iones de los elementos del bloque d a un elemento libre. El carbono es un agente reductor suficientemente fuerte en la mayoría de los casos. Sin embargo, al igual que los iones de los metales del grupo principal más activos, los iones de los elementos del bloque f deben aislarse usando la electrólisis o la reducción con un metal activo como el calcio.
Discutiremos los procesos usados para aislar el hierro, cobre y plata porque estos tres procesos ilustran los procesos principales usados para aislar la mayoría de los metales del bloque d. En general, cada uno de estos procesos involucra tres pasos principales: el tratamiento preliminar, la fundición y la refinación.
-
El tratamiento preliminar. Generalmente, hay un tratamiento inicial de los minerales para adecuarlos a la extracción de los metales. Esto generalmente involucra triturando o moliendo el mineral, concentrando los componentes que contienen metal y, a veces, tratando estas sustancias químicamente para convertirlas en compuestos que son más fáciles de reducir a un metal libre.
-
La fundición. El siguiente paso es la extracción del metal en un estado fundido, usando un proceso llamado la fundición, que incluye la reducción del compuesto metálico a un metal. Las impurezas se pueden eliminar mediante la adición de un compuesto que forma una escoria, una sustancia con un punto de fusión bajo que se puede separar fácilmente del metal fundido.
-
El refinamiento. El paso final en la recuperación de un metal es refinarlo. Los metales con puntos bajos de ebullición, como el zinc y el mercurio, se pueden refinar usando la destilación. Cuando se fusionan en una mesa inclinada, los metales con un punto de fusión bajo, como el estaño, se alejan de las impurezas que tienen puntos de fusión altos. La electrólisis es otro método común usado para refinar los metales.
El aislamiento del hierro
El uso del hierro en la fabricación de las herramientas y armas fue posible debido a la extensa distribución de minerales de hierro y la facilidad con la que los compuestos de hierro en los minerales se podían reducir por el carbono. Durante mucho tiempo, el carboncillo fue la forma de carbono usada en el proceso de la reducción. La producción y el uso de hierro se generalizaron más durante 1620, cuando se introdujo el coque como un agente reductor. El coque es una forma de carbono que se forma al calentar el carbón en la ausencia del aire para eliminar las impurezas.
Normalmente, el primer paso en la metalurgia del hierro es tostar el mineral (calentar el mineral en el aire) para eliminar el agua, descomponiendo los carbonatos en óxidos y convirtiendo los sulfuros en óxidos. Luego, los óxidos se reducen en un alto horno que tiene entre 80 y 100 pies de altura y unos 25 pies de diámetro (Figura \(\PageIndex{6}\)) en el que se introducen el mineral tostado, el coque y la piedra caliza (CaCO3 impuro) continuamente en la parte superior del horno. El hierro fundido y la escoria se extraen por la parte inferior. Todo el stock en un horno puede pesar varios cientos de toneladas.
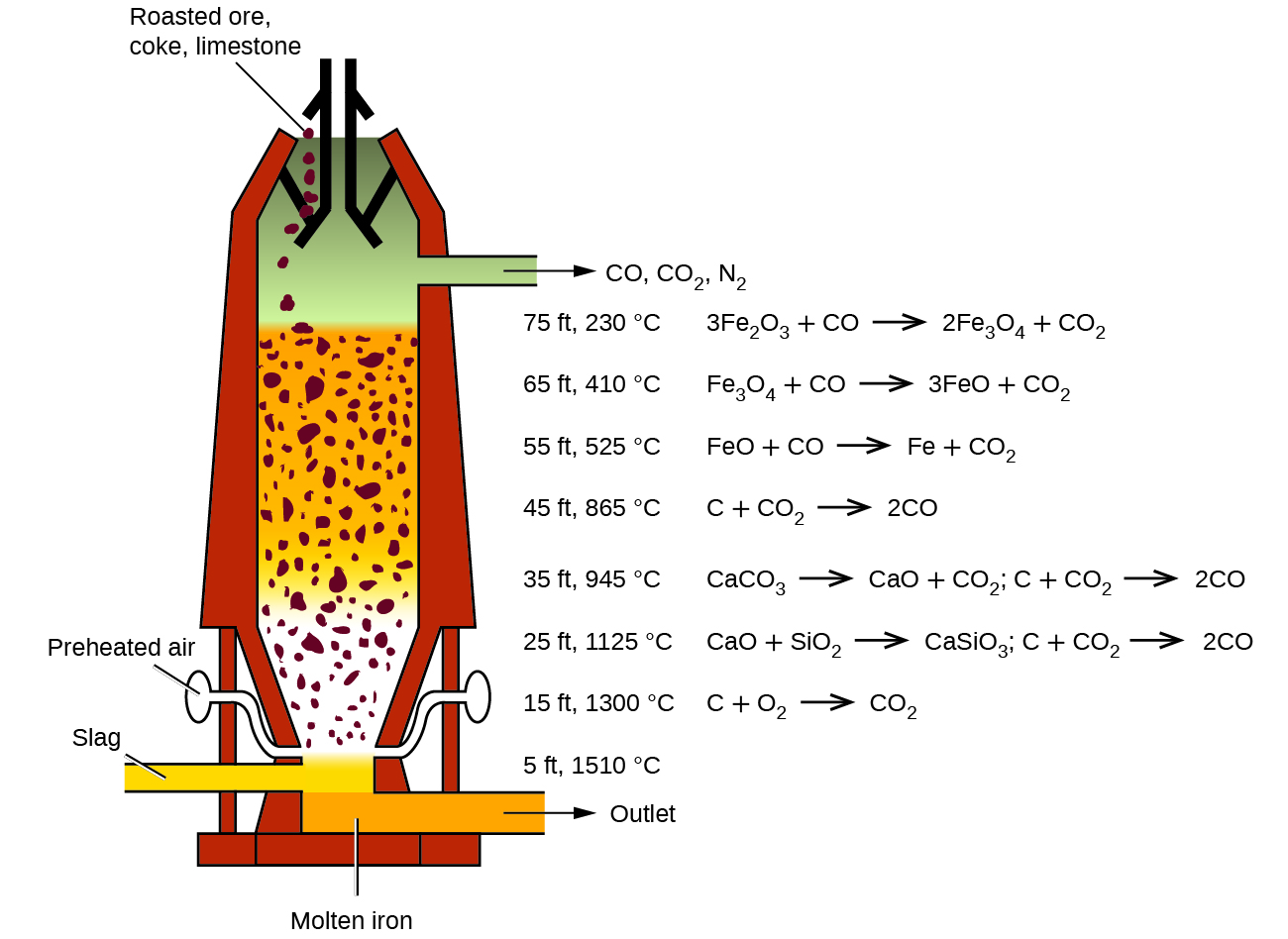
Figura \(\PageIndex{6}\): Dentro de un alto horno, ocurren diferentes reacciones a varias temperaturas diferentes. El monóxido de carbono se genera en las regiones inferiores más calientes y se eleva hacia arriba para reducir los óxidos de hierro a hierro puro a través de una serie de reacciones que ocurren en las regiones superiores del horno.
Cerca de la parte inferior del horno hay toberas a través de las cuales se sopla aire precalentado al horno. En cuanto entra el aire, el coque en la zona de las toberas se oxida a dióxido de carbono y libera una gran cantidad de calor. El dióxido de carbono caliente pasa hacia arriba a través de la capa superpuesta de coque, donde se reduce a monóxido de carbono:
\[\ce{CO2}(g)+\ce{C}(s)⟶\ce{2CO}(g)\]
El monóxido de carbono sirve como un agente reductor en las regiones superiores del horno. Las reacciones individuales se muestran en la Figura \(\PageIndex{6}\).
Los óxidos de hierro se reducen en la zona superior del horno. En la región media del horno, la piedra caliza (carbonato de calcio) se descompone y el óxido de calcio resultante se combina con la sílice y los silicatos en el mineral para formar la escoria. La escoria esta principalmente hecha de silicato de calcio y contiene la mayoría de los componentes comercialmente sin importancia del mineral:
\[\ce{CaO}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l)\]
Justo debajo de la mitad del horno, la temperatura es lo suficientemente alta como para derretir tanto el hierro como la escoria. Se acumulan en capas en el fondo del horno; la escoria menos densa flota sobre el hierro y lo protege de la oxidación. Varias veces al día, la escoria y el hierro fundido se extraen del horno. El hierro se transfiere a máquinas de fundición o a una planta de fabricación de acero (Figura \(\PageIndex{7}\)).

Figura \(\PageIndex{7}\): El hierro fundido se muestra fundido como el acero. (crédito: Clint Budd)
Una gran parte del hierro producido se refina y se convierte en acero. El acero se hace de hierro usando la eliminación de impurezas y la adición de sustancias como manganeso, cromo, níquel, tungsteno, molibdeno y vanadio para producir aleaciones con propiedades que hacen que el material sea adecuado para usos específicos. La mayoría de los aceros también contienen porcentajes pequeños pero definidos de carbono (0.04% –2.5%). Sin embargo, una gran parte del carbono contenido en el hierro se debe eliminar en la fabricación del acero. Pero, al contrario, el exceso de carbono hace que el hierro se vuelva frágil.
El aislamiento del cobre
Los minerales de cobre más importantes contienen los sulfuros de cobre (como covellita, CuS), aunque a veces se encuentran óxidos de cobre (como tenorita, CuO) e hidroxicarbonatos de cobre [como malaquita, Cu2(OH)2CO3]. En la producción del cobre metálico, el mineral de sulfuro concentrado se tuesta para eliminar parte del azufre como el dióxido de azufre. La mezcla restante, que consiste en Cu2S, FeS, FeO y SiO2, se mezcla con la piedra caliza, que sirve como un fundente (un material que ayuda a eliminar las impurezas) y se calienta. La escoria fundida se forma cuando el hierro y la sílice se eliminan usando reacciones ácido-base de Lewis:
\[\ce{CaCO3}(s)+\ce{SiO2}(s)⟶\ce{CaSiO3}(l)+\ce{CO2}(g)\]
\[\ce{FeO}(s)+\ce{SiO2}(s)⟶\ce{FeSiO3}(l)\]
En estas reacciones, el dióxido de silicio actúa como un ácido de Lewis, que acepta un par de electrones de la base de Lewis (el ion óxido).
La reducción del Cu2S que queda después de la fundición se logra soplando aire a través del material fundido. El aire convierte parte del Cu2S en Cu2O. En cuanto que se forma el óxido de cobre (I), el sulfuro de cobre (I) restante lo reduce a cobre metálico:
\[\ce{2Cu2S}(l)+\ce{3O2}(g)⟶\ce{2Cu2O}(l)+\ce{2SO2}(g)\]
\[\ce{2Cu2O}(l)+\ce{Cu2S}(l)⟶\ce{6Cu}(l)+\ce{SO2}(g)\]
El cobre obtenido de esta forma se llama el cobre blister por su apariencia característica, que se debe a las ampollas de aire que contiene (Figura \(\PageIndex{8}\)). Este cobre impuro se hace a grandes placas, que se usan como ánodos en el refinado electrolítico del metal (que se describe en el capítulo sobre la electroquímica).

Figura \(\PageIndex{8}\): El cobre blíster se obtiene durante la conversión de mineral que contiene cobre en cobre puro. (crédito: "Tortie tude" / Wikimedia Commons)
El aislamiento de la plata
La plata a veces se encuentra en pepitas grandes (Figura \(\PageIndex{9}\)) pero con mayor frecuencia en las venas y depósitos relacionados. En el pasado, el lavado fue un método eficaz para aislar las pepitas de oro y plata. Debido a su baja reactividad, estos metales, y algunos otros, se encuentran en depósitos como pepitas. El descubrimiento del platino ocurrió cuando los exploradores españoles en América Central confundieron las pepitas de platino con la plata. A veces, cuando el metal no está en la forma de pepitas, es útil emplear un proceso llamado la hidrometalurgia para separar la plata de sus minerales.

Figura\(\PageIndex{9}\): La plata libre de origen natural se puede encontrar en la forma de pepitas (a) o en venas (b). (crédito a: modificación del trabajo de “Teravolt” / Wikimedia Commons; crédito b: modificación del trabajo de James St. John)
La hidrología involucra la separación de un metal de una mezcla convirtiéndolo primero en iones solubles y luego extrayéndolos y reduciéndolos para precipitar el metal puro. En la presencia del aire, los cianuros de metales alcalinos forman el ión dicianoargentado (I) soluble fácilmente, \(\ce{[Ag(CN)2]-}\), a partir de los metales de plata o compuestos que contienen plata como Ag2S y AgCl. Las ecuaciones representativas son:
\[\ce{4Ag}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{4OH-}(aq)\]
\[\ce{2Ag2S}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{2S}(s)+\ce{4OH-}(aq)\]
\[\ce{AgCl}(s)+\ce{2CN-}(aq)⟶\ce{[Ag(CN)2]-}(aq)+\ce{Cl-}(aq)\]
La plata se precipita de la solución de cianuro mediante la adición de iones de zinc o hierro(II), que actúa como un agente reductor:
\[\ce{2[Ag(CN)2]-}(aq)+\ce{Zn}(s)⟶\ce{2Ag}(s)+\ce{[Zn(CN)4]^2-}(aq)\]
Ejemplo \(\PageIndex{3}\): Refinando el redox
Uno de los pasos para refinar la plata es convertir la plata en iones dicianoargenados (I):
\[\ce{4Ag}(s)+\ce{8CN-}(aq)+\ce{O2}(g)+\ce{2H2O}(l)⟶\ce{4[Ag(CN)2]-}(aq)+\ce{4OH-}(aq)\]
Explique por qué el oxígeno debe estar presente para que la reacción ocurra. ¿Por qué la reacción no ocurre como:
\[\ce{4Ag}(s)+\ce{8CN-}(aq)⟶\ce{4[Ag(CN)2]-}(aq)?\]
Solución
Las cargas, así como los átomos, se deben equilibrar en las reacciones. El átomo de plata se oxida del estado de oxidación 0 al estado 1+. Siempre que algo pierde electrones, algo también debe ganar electrones (reducirse) para equilibrar la ecuación. El oxígeno es un buen agente oxidante para estas reacciones porque puede ganar electrones para pasar del estado de oxidación 0 al estado 2−.
Ejercicio \(\PageIndex{3}\)
Durante el refinamiento del hierro, el carbono debe estar presente en el alto horno. ¿Por qué el carbono es necesario para convertir el óxido de hierro en hierro?
- Respuesta
-
El carbono se convierte en CO, que es el agente reductor que acepta electrones para que el hierro (III) se pueda reducir a hierro (0).
Los compuestos de metales de transición
La unión en los compuestos simples de los elementos de transición varía de iónica a covalente. En sus estados de oxidación más bajos, los elementos de transición forman compuestos iónicos; en sus estados de oxidación superiores, forman compuestos covalentes o iones poliatómicos. La variación en los estados de oxidación exhibida por los elementos de transición les da a estos compuestos una química de oxidación-reducción basada en metales. Después se mostrará la química de varias clases de compuestos que contienen elementos de la serie de transición.
Los haluros
Los haluros anhidros de cada uno de los elementos de transición se pueden preparar usando la reacción directa del metal con los halógenos. Por ejemplo:
\[\ce{2Fe}(s)+\ce{3Cl2}(g)⟶\ce{2FeCl3}(s)\]
Se puede usar el calentamiento del haluro metálico con metal adicional para formar un haluro del metal con un estado de oxidación más bajo:
\[\ce{Fe}(s)+\ce{2FeCl3}(s)⟶\ce{3FeCl2}(s)\]
La estequiometría del haluro metálico que resulta de la reacción del metal con un halógeno está determinada por las cantidades relativas de metal y halógeno y por la fuerza del halógeno como un agente oxidante. Generalmente, el flúor forma metales que contienen fluoruro en sus estados de oxidación más altos. Los otros halógenos no pueden formar compuestos análogos.
En general, la preparación de las soluciones acuosas estables de los haluros de los metales de la primera serie de transición se realiza mediante la adición de un ácido halohídrico a carbonatos, hidróxidos, óxidos u otros compuestos que contienen aniones básicos. Las reacciones de ejemplo son:
\[\ce{NiCO3}(s)+\ce{2HF}(aq)⟶\ce{NiF2}(aq)+\ce{H2O}(l)+\ce{CO2}(g)\]
\[\ce{Co(OH)2}(s)+\ce{2HBr}(aq)⟶\ce{CoBr2}(aq)+\ce{2H2O}(l)\]
La mayoría de los metales de la primera serie de transición también se disuelven en los ácidos y forman una solución de sal e hidrógeno gaseoso. Por ejemplo:
\[\ce{Cr}(s)+\ce{2HCl}(aq)⟶\ce{CrCl2}(aq)+\ce{H2}(g)\]
La polaridad de los enlaces con los metales de transición varía basándose no solo en las electronegatividades de los átomos involucrados, sino también en el estado de oxidación del metal de transición. Recuerde que la polaridad del enlace es un espectro continuo en el que los electrones se comparten uniformemente (enlaces covalentes) en un extremo y los electrones se transfieren completamente (enlaces iónicos) en el otro extremo. Ningún enlace es 100% iónico, y el grado en que los electrones se distribuyen uniformemente determina muchas propiedades del compuesto. Los haluros de metales de transición con números de oxidación bajos forman más enlaces iónicos. Por ejemplo, el cloruro de titanio (II) y el cloruro de titanio (III) (TiCl2 y TiCl3) tienen puntos de fusión altos que son característicos de los compuestos iónicos, pero el cloruro de titanio (IV) (TiCl4) es un líquido volátil, donde hay enlaces covalentes de titanio-cloro. Todos los haluros de los elementos del bloque d más pesados tienen características covalentes significativas.
El comportamiento covalente de los metales de transición con estados de oxidación más altos se ejemplifica por la reacción de los tetrahaluros metálicos con el agua. Igual al tetracloruro de silicio covalente, los tetrahaluros de titanio y vanadio reaccionan con el agua para producir soluciones que contienen los correspondientes ácidos hidrohálicos y los óxidos metálicos:
\[\ce{SiCl4}(l)+\ce{2H2O}(l)⟶\ce{SiO2}(s)+\ce{4HCl}(aq)\]
\[\ce{TiCl4}(l)+\ce{2H2O}(l)⟶\ce{TiO2}(s)+\ce{4HCl}(aq)\]
Los óxidos
Al igual que con los haluros, la naturaleza de los enlaces en los óxidos de los elementos de transición está determinada por el estado de oxidación del metal. Los óxidos con estados de oxidación bajos tienden a ser más iónicos, mientras que aquellos con estados de oxidación más altos son más covalentes. Estas variaciones en los enlaces se deben a que las electronegatividades de los elementos no son valores fijos. La electronegatividad de un elemento aumenta al aumentar el estado de oxidación. Los metales de transición en estados de oxidación bajos tienen valores de electronegatividad más bajos que el oxígeno; por eso, estos óxidos metálicos son iónicos. Los metales de transición en estados de oxidación muy altos tienen valores de electronegatividad cercanos a los del oxígeno, causa que estos óxidos sean covalentes.
Los óxidos de la primera serie de transición se pueden preparar calentando los metales en el aire. Estos óxidos son Sc2O3, TiO2, V2O5, Cr2O3, Mn3O4, Fe3O4, Co3O4, NiO, y CuO.
Alternativamente, estos óxidos y otros óxidos (con los metales en diferentes estados de oxidación) se pueden producir calentando los correspondientes hidróxidos, carbonatos u oxalatos en una atmósfera inerte. El óxido de hierro (II) se puede preparar calentando el oxalato de hierro (II), y el óxido de cobalto (II) se produce calentando el hidróxido de cobalto (II):
\[\ce{FeC2O4}(s)⟶\ce{FeO}(s)+\ce{CO}(g)+\ce{CO2}(g)\]
\[\ce{Co(OH)2}(s)⟶\ce{CoO}(s)+\ce{H2O}(g)\]
Con la excepción de CrO3 y Mn2O7, los óxidos de metales de transición no son solubles en el agua. Pueden reaccionar con los ácidos y, en algunos casos, con las bases. Generalmente, los óxidos de metales de transición con los estados de oxidación más bajos son básicos (y reaccionan con los ácidos), los intermedios son anfóteros y los estados de oxidación más altos son principalmente los ácidos. Los óxidos de metales básicos en un estado de oxidación bajo reaccionan con los ácidos acuosos para formar soluciones de sales y agua. Los ejemplos incluyen la reacción del óxido de cobalto (II) que acepta protones del ácido nítrico, y el óxido de escandio (III) que acepta protones del ácido clorhídrico:
\[\ce{CoO}(s)+\ce{2HNO3}(aq)⟶\ce{Co(NO3)2}(aq)+\ce{H2O}(l)\]
\[\ce{Sc2O3}(s)+\ce{6HCl}(aq)⟶\ce{2ScCl3}(aq)+\ce{3H2O}(l)\]
Los óxidos de los metales con estados de oxidación de 4+ son anfóteros y la mayoría no son solubles ni en ácidos o bases. El óxido de vanadio (V), el óxido de cromo (VI) y el óxido de manganeso (VII) son ácidos. Reaccionan con soluciones de hidróxidos para formar las sales de los oxianiones \(\ce{VO4^3-}\), \(\ce{CrO4^2-}\) y \(\ce{MnO4-}\). Por ejemplo, la ecuación iónica completa para la reacción del óxido de cromo (VI) con una base fuerte es:
\[\ce{CrO3}(s)+\ce{2Na+}(aq)+\ce{2OH-}(aq)⟶\ce{2Na+}(aq)+\ce{CrO4^2-}(aq)+\ce{H2O}(l)\]
El óxido de cromo (VI) y el óxido de manganeso (VII) reaccionan con el agua para formar los ácidos H2CrO4 y HMnO4, respectivamente.
Los hidróxidos
Cuando se añade un hidróxido soluble a una solución acuosa de una sal de un metal de transición de la primera serie de transición, se forma un precipitado gelatinoso. Por ejemplo, agregando una solución de hidróxido de sodio a una solución de sulfato de cobalto produce un precipitado gelatinoso de color rosa o azul de hidróxido de cobalto (II). La ecuación iónica neta es:
\[\ce{Co^2+}(aq)+\ce{2OH-}(aq)⟶\ce{Co(OH)2}(s)\]
En este y muchos otros casos, estos precipitados son hidróxidos que contienen el ión de metal de transición, iones de hidróxido y agua coordinados con el metal de transición. En otros casos, los precipitados son óxidos hidratados hechos por iones metálicos, iones óxido y agua de hidratación:
\[\ce{4Fe^3+}(aq)+\ce{6OH-}(aq)+\ce{nH2O}(l)⟶\ce{2Fe2O3⋅(n + 3)H2O}(s)\]
Estas sustancias no contienen iones de hidróxido. Sin embargo, tanto los hidróxidos como los óxidos hidratados reaccionan con los ácidos para formar las sales y el agua. Al precipitar un metal de una solución, es necesario evitar un exceso de iones hidróxido porque esto puede causar la formación de iones complejos, como se explica más adelante en este capítulo. Los hidróxidos metálicos precipitados se pueden separar para su procesamiento posterior o para su eliminación.
Los carbonatos
Muchos de los elementos de la primera serie de transición forman carbonatos insolubles. Se pueden producir estos carbonatos mediante la adición de una sal de carbonato soluble a una solución de una sal de metal de transición. Por ejemplo, el carbonato de níquel se puede preparar a partir de las soluciones de nitrato de níquel y carbonato de sodio de acuerdo con la siguiente ecuación iónica neta:
\[\ce{Ni^2+}(aq)+\ce{CO3^2-}⟶\ce{NiCO3}(s)\]
Las reacciones de los carbonatos de metales de transición son similares a las de los carbonatos de los metales activos. Reaccionan con los ácidos para formar las sales de metales, el dióxido de carbono y el agua. Al calentarse, se descomponen y forman los óxidos de los metales de transición.
Otras sales
En muchos aspectos, el comportamiento químico de los elementos de la primera serie de transición es muy similar al de los metales del grupo principal. En particular, los mismos tipos de reacciones que se usan para preparar las sales de los metales del grupo principal se pueden usar para preparar las sales iónicas simples de estos elementos.
Se puede preparar una variedad de sales usando los metales que son más activos que el hidrógeno por usando la reacción con los ácidos correspondientes: El escandio metálico reacciona con el ácido bromhídrico para producir una solución de bromuro de escandio:
\[\ce{2Sc}(s)+\ce{6HBr}(aq)⟶\ce{2ScBr3}(aq)+\ce{3H2}(g)\]
Los compuestos comunes que apenas discutimos también se pueden usar para preparar las sales. Las reacciones involucradas incluyen las reacciones de los óxidos, hidróxidos o carbonatos con ácidos. Por ejemplo:
\[\ce{Ni(OH)2}(s)+\ce{2H3O+}(aq)+\ce{2ClO4-}(aq)⟶\ce{Ni^2+}(aq)+\ce{2ClO4-}(aq)+\ce{4H2O}(l)\]
Se pueden usar las reacciones de sustitución que involucran las sales solubles para preparar las sales insolubles. Por ejemplo:
\[\ce{Ba^2+}(aq)+\ce{2Cl-}(aq)+\ce{2K+}(aq)+\ce{CrO4^2-}(aq)⟶\ce{BaCrO4}(s)+\ce{2K+}(aq)+\ce{2Cl-}(aq)\]
En nuestra discusión de los óxidos en esta sección, hemos visto que las reacciones de los óxidos covalentes de los elementos de transición con los hidróxidos forman sales que contienen oxianiones de los elementos de transición.
Los superconductores de altas temperaturas
Un superconductor es una sustancia que puede conducir electricidad sin resistencia. Esta falta de resistencia significa que no hay pérdida de energía durante la transmisión de electricidad. Esto resultará en una reducción significativa del coste de la electricidad.
Actualmente, los materiales superconductores comerciales más usados, como NbTi y Nb3Sn, no se convierten en superconductores hasta que se enfrían por debajo de 23 K (-250 °C). Esto requiere el uso de helio líquido, que tiene una temperatura de ebullición de 4 K y es caro y difícil de manejar. El costo del helio líquido ha disuadido la aplicación extensa de los superconductores.
Uno de los descubrimientos científicos más interesantes de la década de 1980 fue la caracterización de los compuestos que exhiben superconductividad a temperaturas más altas que 90 K. (En comparación con el helio líquido, 90 K es una temperatura alta). Algunos de los materiales superconductores de alta temperatura típicos son los óxidos que contienen itrio (o uno de los varios elementos de tierras raras), bario y cobre en una proporción de 1: 2: 3. La fórmula del compuesto de itrio iónico es YBa2Cu3O7.
Los nuevos materiales se vuelven superconductores a temperaturas cerca de 90 K (Figura \(\PageIndex{10}\)), estas temperaturas se pueden alcanzar enfriando con el nitrógeno líquido (temperatura de ebullición de 77 K). Los materiales enfriados con el nitrógeno líquido son más fáciles de manejar y los costos de enfriamiento6 son aproximadamente 1000 veces más bajos que los del helio líquido.
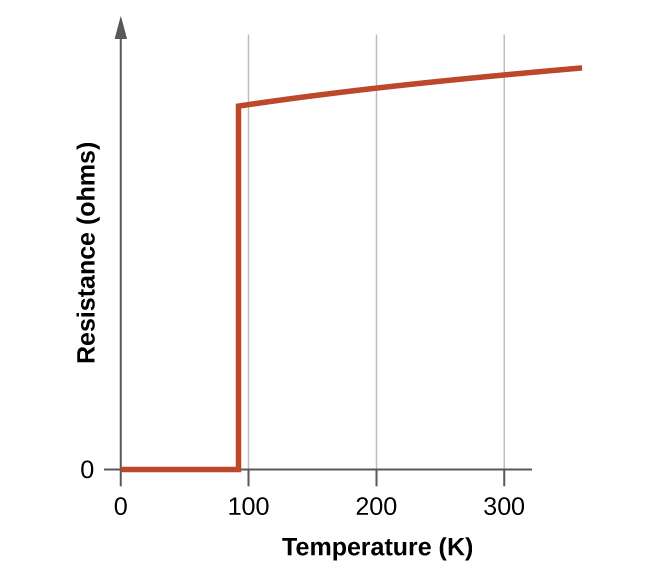
Figura \(\PageIndex{10}\): La resistencia del superconductor de alta temperatura YBa2Cu3O7 varía con la temperatura. Observe cómo la resistencia cae a cero por debajo de 92 K, cuando la sustancia se vuelve superconductora.
Aunque el carácter frágil y quebradizo de estos materiales restringe sus aplicaciones comerciales, tienen un enorme potencial y por eso los investigadores están trabajando arduamente para mejorar sus procesos. Las líneas de transmisión superconductoras transportarían corriente para cientos de millas sin pérdida de potencia debido a la resistencia en los cables. Esto podría permitir que las estaciones de generación se ubiquen en áreas alejadas de los centros de población y cerca de los recursos naturales necesarios para la producción de la energía. El primer proyecto que demuestra la viabilidad de la transmisión de potencia superconductora a alta temperatura se estableció en Nueva York en 2008.

Figura \(\PageIndex{11}\): (a) Este tren de levitación magnética (o maglev) usa tecnología de superconductores para moverse a lo largo de sus vías. (b) Un imán se puede hacer levitar usando un plato como este como un superconductor. (crédito a: modificación del trabajo de Alex Needham; crédito b: modificación del trabajo de Kevin Jarrett)
Los investigadores también están trabajando en el uso de esta tecnología para desarrollar otras aplicaciones, como las microchips más pequeños y potentes. Además, los superconductores de alta temperatura se pueden usar para generar campos magnéticos para aplicaciones como dispositivos médicos, trenes de levitación magnética y campos de contención para reactores de fusión nuclear (Figura \(\PageIndex{11}\)).
Vídeo \(\PageIndex{1}\): Observe cómo un superconductor de alta temperatura levita alrededor de una pista de carreras magnética en este video.
Resumen
Los metales de transición son elementos con orbitales d parcialmente llenos, ubicados en el bloque d de la tabla periódica. La reactividad de los elementos de transición varía extensivamente desde los metales muy activos como el escandio y el hierro hasta los elementos casi inertes, como el platino. El tipo de química usada en el aislamiento de los elementos de sus minerales depende de la concentración del elemento en su mineral y de la dificultad de reducir los iones de los elementos a los metales. Los metales más activos son más difíciles de reducir.
Los metales de transición exhiben un comportamiento químico típico de los metales. Por ejemplo, se oxidan en el aire al calentarse y reaccionan con los halógenos elementales para formar los haluros. Los elementos que se encuentran por encima del hidrógeno en la serie de actividades reaccionan con los ácidos y producen sales y gas hidrógeno. Los óxidos, hidróxidos y carbonatos de los compuestos de los metales de transición en estados de baja oxidación son básicos. Los haluros y otras sales son generalmente estables en el agua, aunque en algunos casos se debe excluir el oxígeno. La mayoría de los metales de transición forman una variedad de estados de oxidación estables, esto les permite demostrar varias reactividades químicas.
Glosario
- la serie de los actínidos
- (también, serie de actinoides) el actinio y los elementos de la segunda fila o del bloque f, números atómicos 89-103
- compuesto de coordinación
- un compuesto estable en el que el átomo o ión metálico central actúa como un ácido de Lewis y acepta uno o más pares de electrones
- elemento d-block
- uno de los elementos de los grupos 3-11 con electrones de valencia en orbitales d
- elemento de bloque f
- (también, elemento de transición interno) uno de los elementos con números atómicos 58–71 o 90–103 que tienen electrones de valencia en orbitales f; con frecuencia se muestran desplazados debajo de la tabla periódica
- primera serie de transición
- elementos de transición en el cuarto período de la tabla periódica (primera fila del bloque d), números atómicos 21-29
- cuarta serie de transición
- elementos de transición en el séptimo período de la tabla periódica (cuarta fila del bloque d), números atómicos 89 y 104-111
- la hidrometalurgia
- proceso en el que un metal se separa de una mezcla por convirtiéndolo primero en iones solubles, extrayendo los iones y luego reduciendo los iones para precipitar el metal puro
- la serie de los lantánidos
- (también, serie de lantanoides) lantano y los elementos de la primera fila o del bloque f, números atómicos 57–71
- los metales del platino
- grupo de seis metales de transición que consisten en el rutenio, osmio, rodio, iridio, paladio y platino que tienden a ocurrir en los mismos minerales y demuestran propiedades químicas similares
- elemento de tierras raras
- una colección de 17 elementos, incluidos los lantánidos, el escandio y el itrio, que a veces se encuentran juntos y tienen propiedades químicas similares, lo que hace su separación difícil
- la segunda serie de transición
- los elementos de transición en el quinto período de la tabla periódica (segunda fila del bloque d), números atómicos 39–47
- la fundición
- el proceso de extracción de un metal puro de un mineral fundido
- el acero
- un material hecho de hierro por eliminando las impurezas del hierro y añadiendo sustancias que producen aleaciones con propiedades adecuadas para sus usos específicos
- superconductor
- un material que conduce la electricidad sin resistencia
- la tercera serie de transición
- los elementos de transición en el sexto período de la tabla periódica (tercera fila del bloque d), números atómicos 57 y 72-79
Contribuyentes y atribuciones
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


