3.3: Conformaciones de moléculas orgánicas cíclicas
- Page ID
- 2325
3.2A: Introducción al azúcares y otras moléculas cíclicas
Navega a través de un libro de texto de bioquímica y podrás ver cualquier número de moléculas con estructuras cíclicas. Muchas de estas estructuras cíclicas son aromáticos, y por lo tanto planar. Muchos otros, sin embargo, son no aromático, y son estas estructuras cíclicas que sean el tema de discusión en esta sección.
Cuando se habla de moléculas orgánicas cíclicas, a menudo utilizaremos azúcares como ejemplos, ya que tales moléculas son importantes en la química biológica. Es importante entender que existen muchas azúcares en solución acuosa tanto de cadena lineal (también llamado "de cadena abierta') y formas cíclicas. La forma de cadena abierta de glucosa y dos posibles formas cíclicas se muestran abajo.
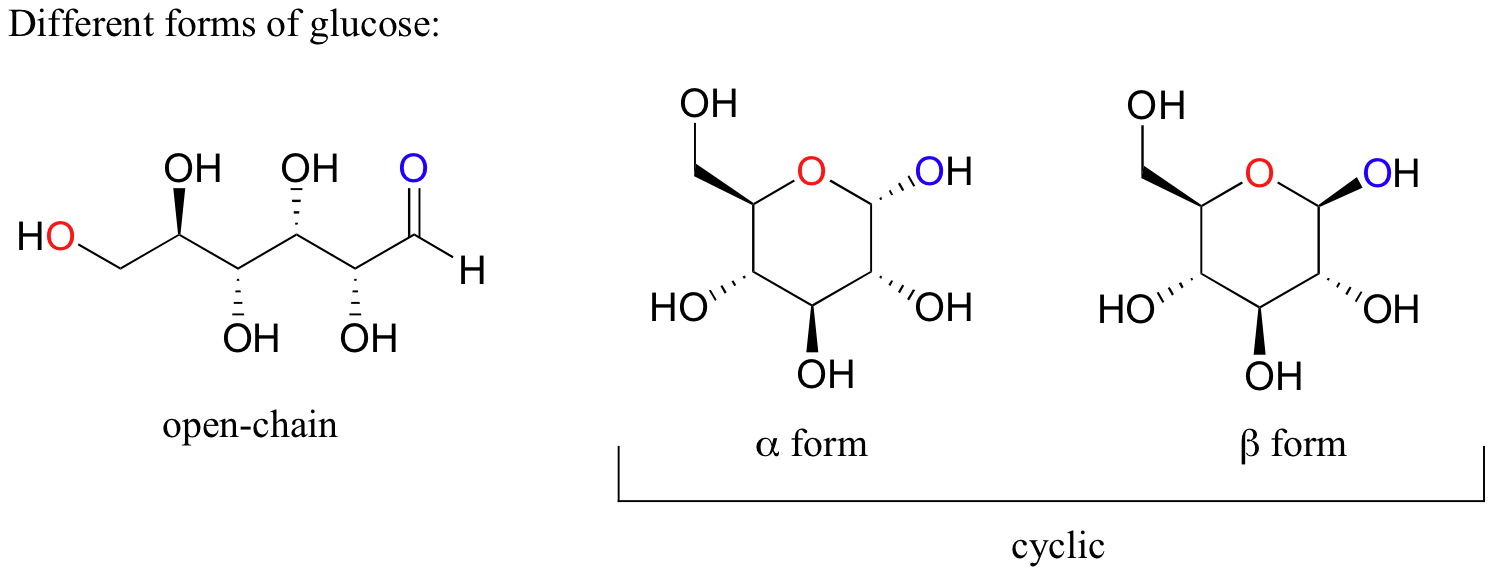
(No te preocupes por ahora acerca de cómo se convierten los azúcares entre sus formas de cadena abierta y cíclicos, o acerca de la diferencia entre las formas alfa y beta de la glucosa cíclico - esos y muchos otros temas relacionados con el azúcar serán cubiertos más adelante, sobre todo en el capítulo 11.)
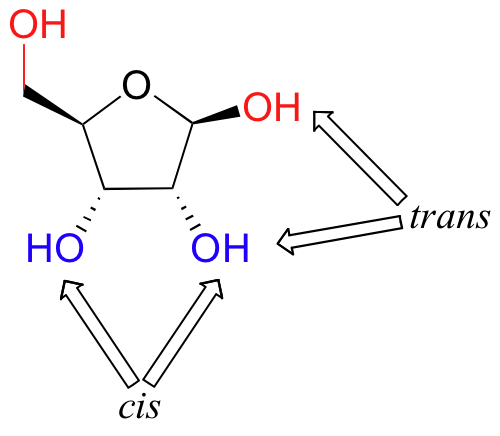
Una cosa que usted debe notar en las estructuras cíclicas mostradas arriba es que los átomos o grupos unidos a átomos de carbono de anillo tetraédricos están apuntando hacia arriba (hacia fuera del plano de la página) o hacia abajo (en el plano de la página), como lo indica el uso de cuñas discontinuas o sólidas. Cuando dos sustituyentes en el mismo anillo están ambos apuntando en la misma dirección, se dice que son cis entre sí. Cuando se señalan en direcciones opuestas, se dice que son trans entre sí.
3.2B: Tamaño del anillo
En la mayoría de los casos, estructuras de anillos en las moléculas orgánicas son de cinco miembros o de seis miembros. Anillos de tres y de cuatro miembros ocasionalmente se encuentran en la naturaleza, pero son significativamente más altos en energía. La inestabilidad relativa de estas estructuras de anillos más pequeñas puede ser explicada por un concepto llamado tensión del anillo. Usted puede obtener una buena idea de la fuente de tensión del anillo si se intenta construir un modelo de ciclopropano o ciclobutano: con el fin de cerrar el anillo, los enlaces entre los átomos de carbono deben ser forzados, o distorsionadas, en ángulos un poco más pequeño que el ángulo tetraédrico de 109.5 °.
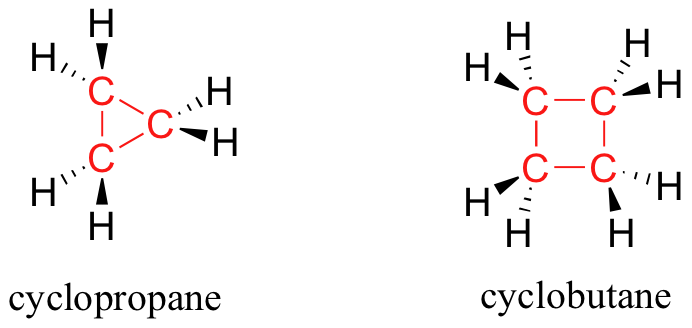
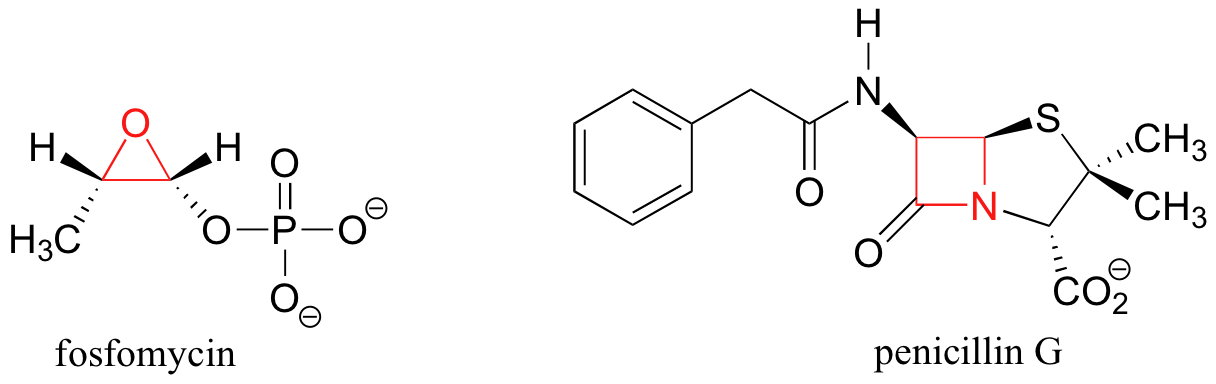
Si uno de los enlaces carbono-carbono se rompe, el anillo se, 'primavera' abierto liberando la energía mientras los bonos reasumen su geometría tetraédrica preferida. La eficacia de los dos medicamentos antibióticos, fosfomicina y la penicilina, se debe en gran parte a la alta reactividad del anillo de tres y de cuatro miembros en sus estructuras.
3.2C: Conformaciones de la glucosa y otras estructuras de anillos de seis miembros
En la geometría más abierta de las estructuras de cicloalcano de cinco y seis miembros, ángulos de unión están cerca de tetraédrica, y por lo tanto la tensión del anillo no es un factor - estos anillos son de hecho muy estable. Sin embargo, los dibujos "plana" que hemos estado viendo hasta ahora no muestran con exactitud la forma tridimensional real de un anillo de cinco o seis miembros. Si ciclohexano fuera realmente plano, los ángulos de enlace tendrían que ser distorsionados de 109.5 ° a 120 °. Si se construye un modelo, sin embargo, usted encontrará que si gira los enlaces carbono-carbono con el fin de poner el anillo en una forma similar a una silla de playa reclinable, todos los enlaces carbono-carbono son capaces de asumir los ángulos de unión tetraédricos .
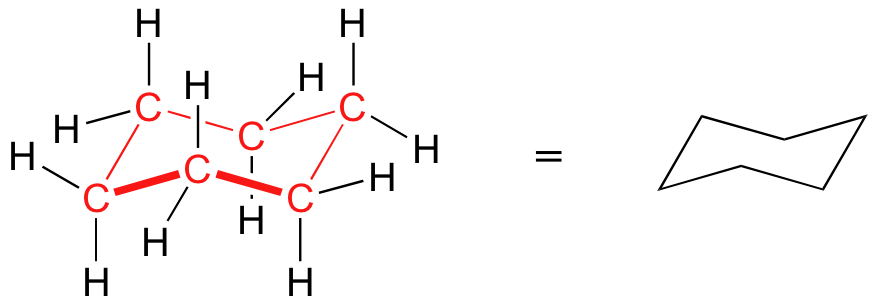
Esta conformación 'silla' es la conformación de energía más baja para ciclohexano y otros anillos de seis miembros.
Una conformación alternativa para un anillo de seis miembros se llama el 'barco':
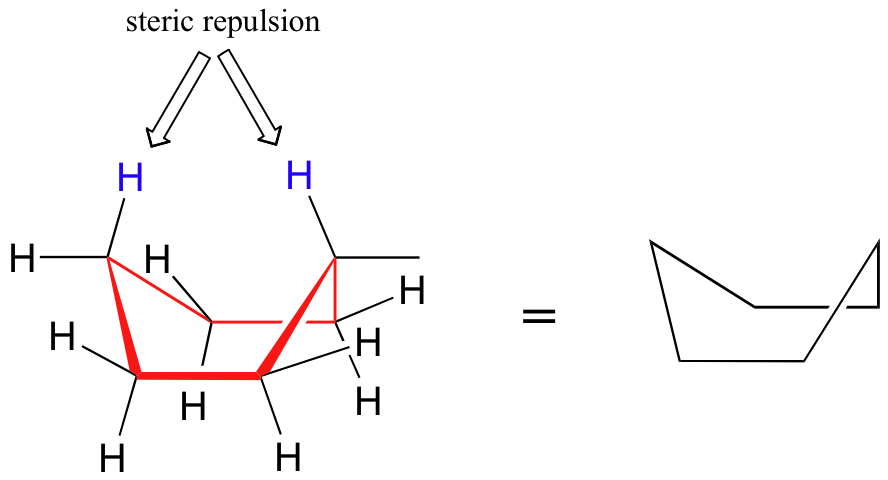
En la conformación del barco, dos de los sustituyentes - los de la 'proa' y la 'severa' si se quiere - son llevados lo suficientemente cerca entre sí para causar la repulsión de van der Waals. Por esta razón, la conformación barco es algo mayor en energía que la conformación de silla.
Si se fijan bien en el modelo de ciclohexano en la conformación de silla, se verá que todos los doce hidrógenos no son equivalentes en cuanto a su disposición tridimensional en el espacio. Seis son hidrógenos axiales - es decir, que están apuntando hacia arriba o hacia abajo con respecto al anillo. Los otros seis hidrógenos son ecuatorial, lo que significa que están apuntando lejos del perímetro del anillo, ya sea ligeramente hacia arriba o ligeramente hacia abajo.
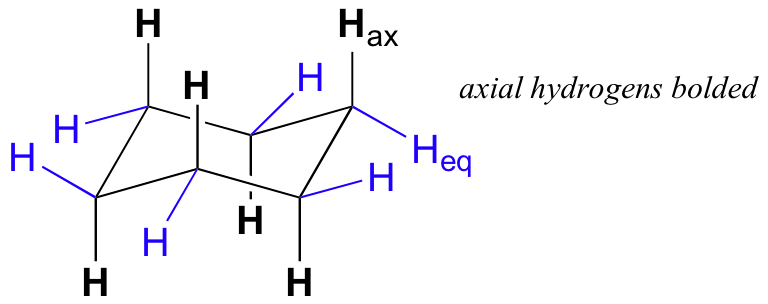
Esta no es la única conformación de silla de ciclohexano posible. En su modelo, girar uno de los 'arriba' carbonos ligeramente hacia abajo, y uno de los carbonos 'abajo' ligeramente hacia arriba. Ahora tiene una nueva conformación de silla alternativa - este proceso se llama inversión de anillo.
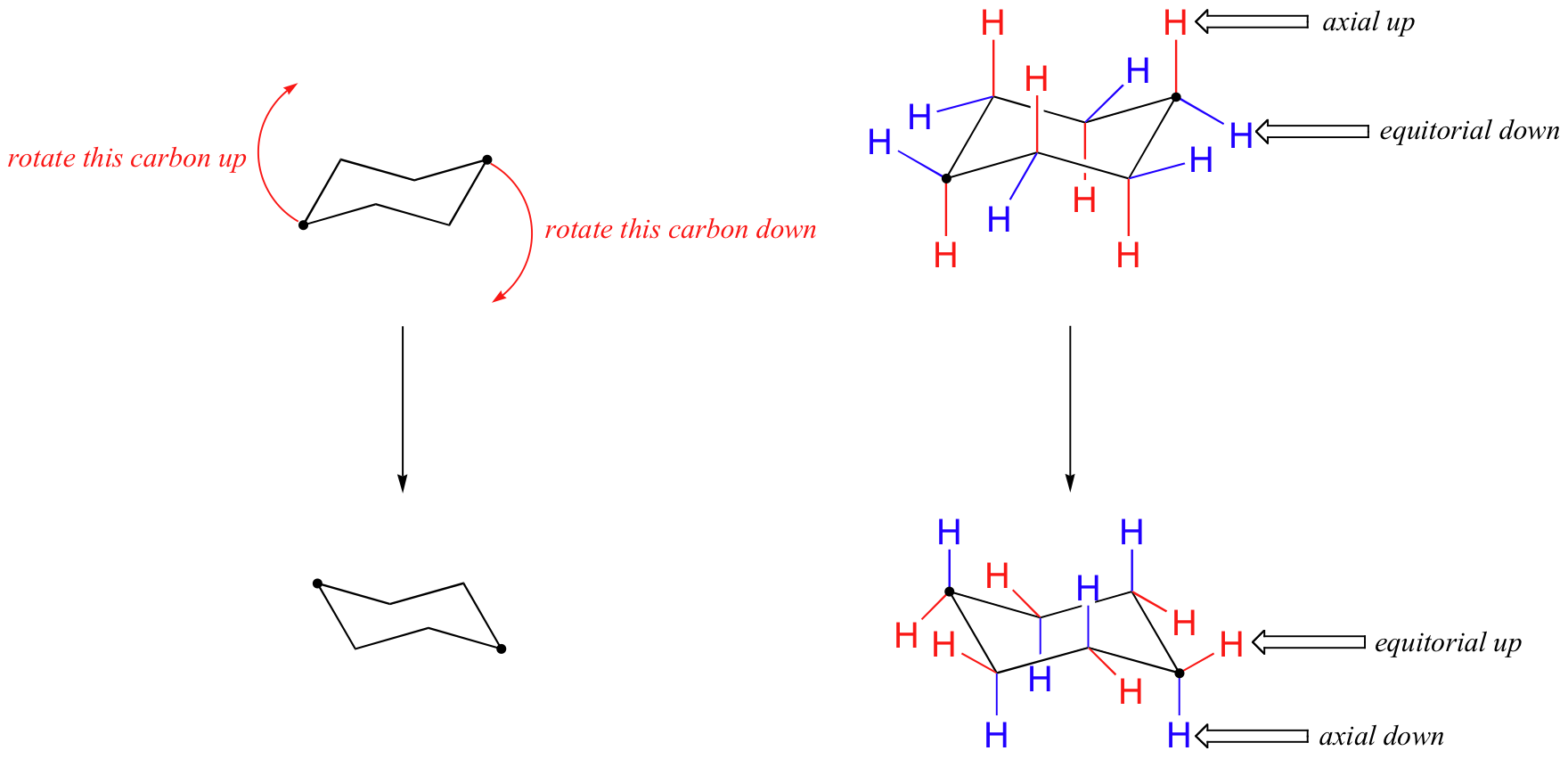
Lo que usted debe ver es que, como resultado del proceso de inversión de anillo, todos los hidrógenos axiales y ecuatoriales han negociado posiciones - hidrógenos axiales se han convertido ecuatorial, y viceversa. Nótese, sin embargo, que los hidrógenos 'abajo' siguen apuntando hacia abajo, y los 'arriba' hidrógenos siguen apuntando hacia arriba, independientemente de si son axial o ecuatorial. A temperatura ambiente, ciclohexano está en constante inversora entre dos formas de silla de igual energía - se trata de una situación de equilibrio rápido. Así, excepto a temperaturas muy bajas, no somos capaces de distinguir entre hidrógenos axiales y ecuatoriales, ya que están constantemente cambiando de uno y a otro.
La imagen es un poco diferente cuando reemplazamos uno de los sustituyentes de hidrógeno con algo más grande, tal como un grupo metilo. Ahora, las dos conformaciones de silla son bastante diferentes: en una, el grupo metilo es ecuatorial y en la otra es axial.
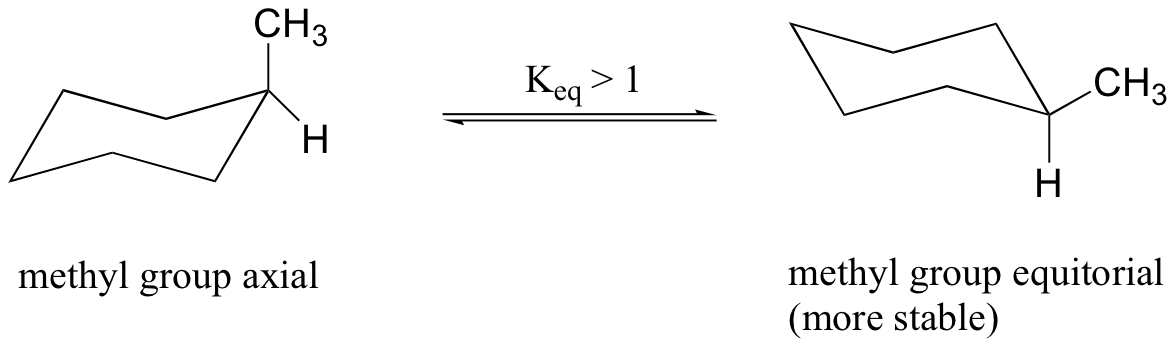
Cuando el grupo metilo está en la posición axial, sí se lleva lo suficientemente cerca de los hidrógenos de los carbonos de barrera # 3 y # 5 causa la repulsión estérica.

Cuando en la posición ecuatorial, el grupo metilo está señalando lejos del resto del anillo, eliminando esta interacción desfavorable. Como consecuencia, la conformación en la que el grupo metilo está en la posición ecuatorial es más estable, en aproximadamente 1,7 kcal / mol. A temperatura ambiente, existe metilciclohexano como un equilibrio rápido entre las dos formas de silla, pero el constante de equilibrio (Keq) favorece la conformación donde el grupo metilo es ecuatorial.
La importancia del factor de repulsión estérica aumenta con el tamaño creciente de un sustituyente. Ciclohexano terc-butilo, por ejemplo, es mucho más estable (aproximadamente 5,6 kcal / mol) en la conformación de silla en la que el grupo terc-butilo voluminoso está en la posición ecuatorial.
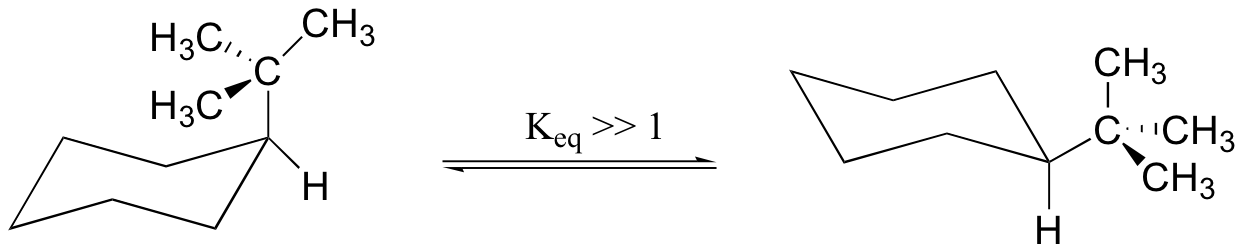
Como regla general, la conformación de silla más estable de un anillo de seis miembros será aquel en el que los grupos más voluminosos están en la posición ecuatorial.
Anteriormente, hemos visto los seis átomos en el anillo de la glucosa cíclico dibujados en dos dimensiones. Una representación más precisa muestra que la molécula adopta, como se esperaba, una conformación de silla.
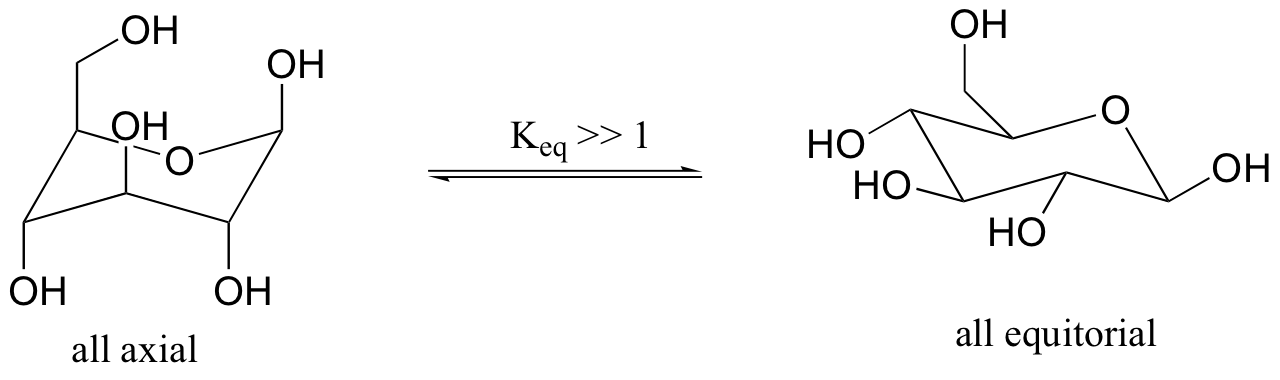
La conformación en la que todos los sustituyentes son ecuatorial es menor en energía.
Vamos a aprender más adelante en el capítulo 11 que la glucosa también puede existir en una forma cíclica alternativa. Las dos formas isoméricas son referidas por las letras griegas alfa (α) y beta (β).

No hemos aprendido sobre estereoisomerismo todavía, pero todavía se puede reconocer que la configuración de unión de un átomo de carbono es diferente. En el isómero alfa, uno de los grupos hidroxilo es axial - este isómero no es capaz de adoptar una conformación de silla en la que todos los sustituyentes que no son hidrógeno son ecuatorial. La conformación de energía más baja es aquel en el que cuatro de los cinco sustituyentes son ecuatorial, pero la presencia de un grupo hidroxilo axial significa que el isómero alfa es, en general, menos estable que el isómero beta.
La forma más abundante de la fructosa en solución acuosa es también un anillo de seis miembros.
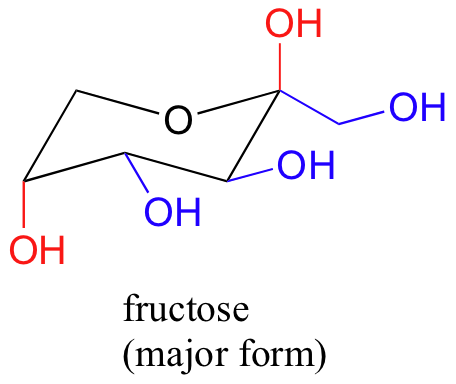
La conformación de silla de energía más baja es la que tiene tres de los cinco sustituyentes (incluyendo el grupo -CH2OH voluminosos) en la posición ecuatorial.
Ejercicio 3.2.1
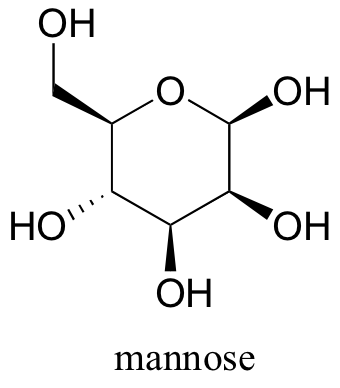
Dibuja las dos conformaciones de silla del azúcar llamado manosa, asegurándose de mostrar claramente cada sustituyente no hidrógeno como axial o ecuatorial. Predice que conformación es mas probable de ser más estable, y explicar por qué.
3.2D: Conformaciones de pentosa y otras estructuras de anillo de cinco miembros
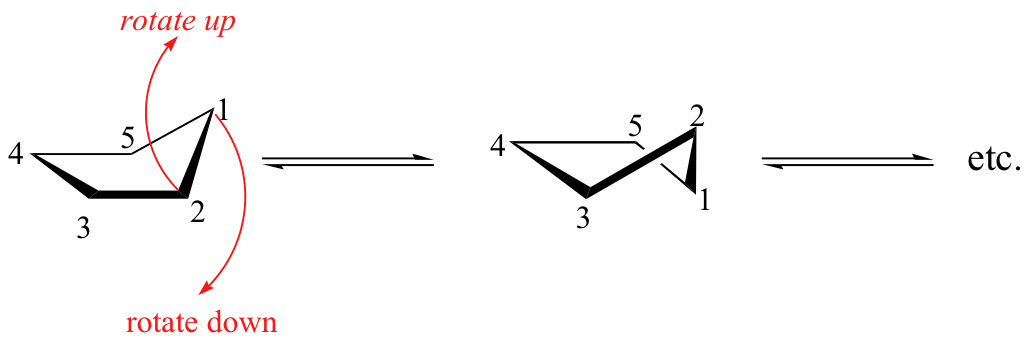
La conformación de energía más baja de ciclopentano y otros anillos de cinco miembros es conocida como la "sobre", con cuatro de los átomos del anillo en el mismo plano y uno fuera del plano (observe que esta forma se asemeja a un sobre con la solapa abierta). El carbono fuera del plano se dice que está en la posición endo ('endo" significa "adentro").

A temperatura ambiente, ciclopentano se somete a un proceso rápido 'Pseudorrotación' en el que cada uno de los cinco carbonos se turnan para ser en la posición endo.
Uno de los anillos de cinco miembros más importantes en la naturaleza es un azúcar llamado ribosa - ADN y ARN son construidos sobre espinas dorsales que se derivan de la ribosa. La imagen de abajo es una timina (T) desoxi-nucleótidos de un tramo de ADN:
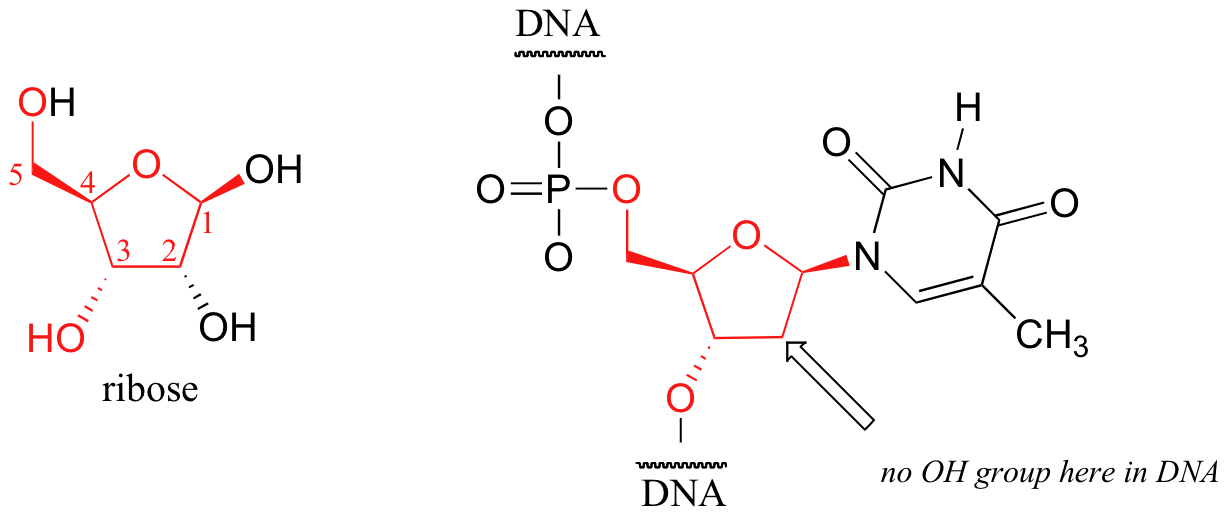
Las conformaciones de energía más bajas para la ribosa son formas sobre en el que cualquiera de C3 o C2 son endo, en el mismo lado que el sustituyente C5.
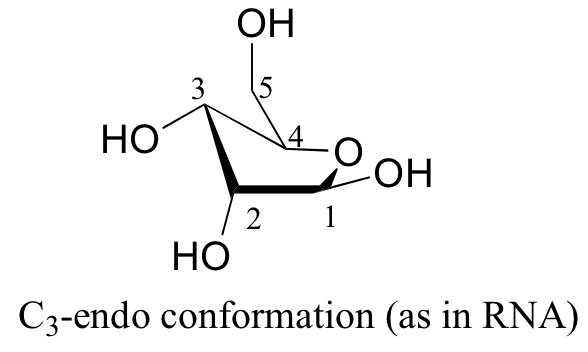
Esto tiene implicaciones muy importantes para la estructura de oligonucleótido - en el ADN, es C2 que está en la posición endo, mientras que en el ARN es C3.
3.2E: La importancia de la conformación de la reactividad orgánica
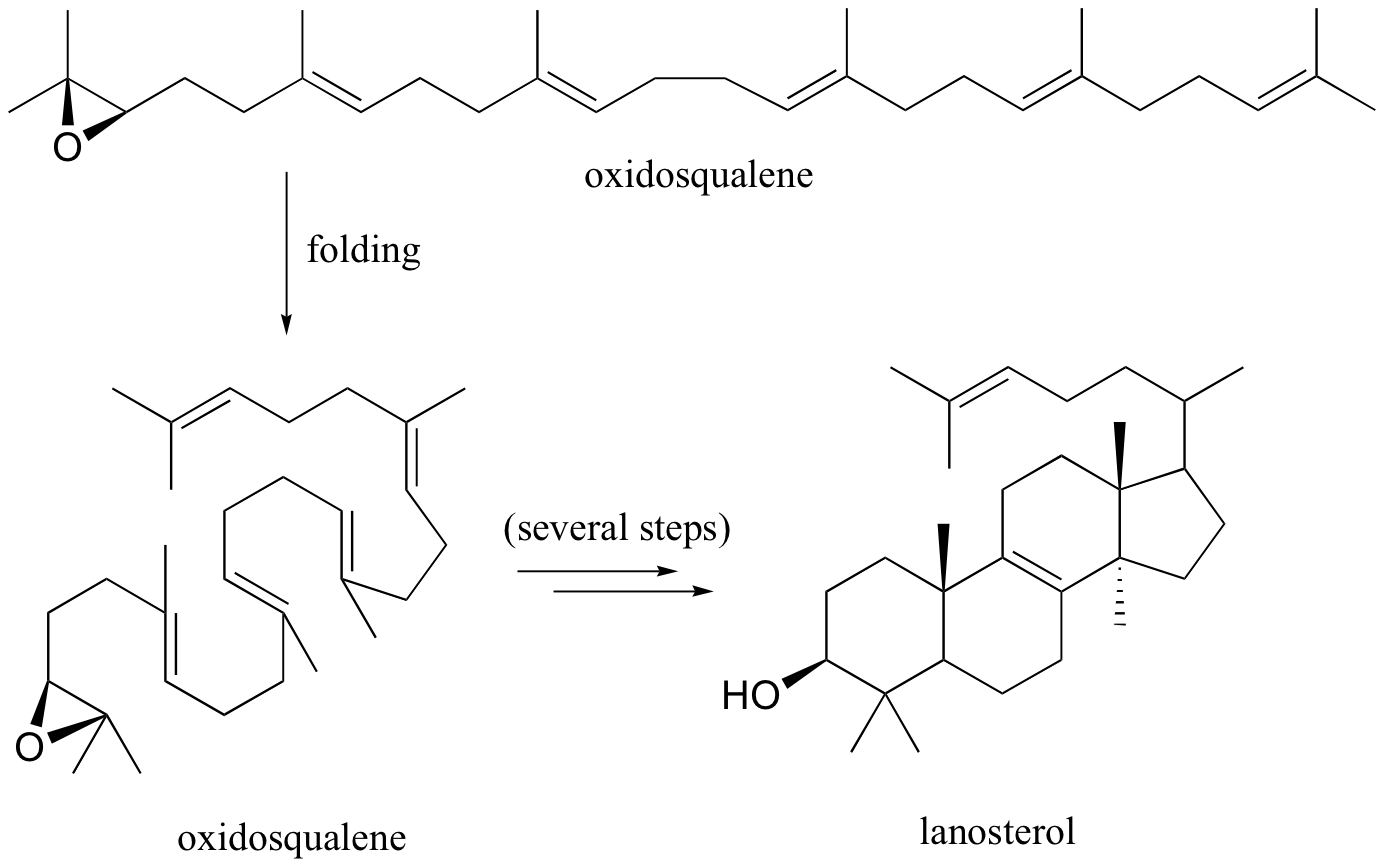
A medida que continuamos de estudiar de la estructura y reactividad de las moléculas orgánicas y biomoléculas, en particular, vamos a ver muchos más ejemplos en los que las cuestiones de las rotaciones de los bonos y conformación molecular son críticos. Muchas reacciones no proceden a menos que el compuesto de partida está en una conformación de partida muy específica. Oxidoescualeno, con el fin de someterse a una reacción de ciclación para formar el complejo de lanosterol, primero debe adoptar -con la ayuda de una enzima - una conformación muy específica (esta reacción, que es parte de la ruta de biosíntesis de colesterol, se discute en la section 15.7B).
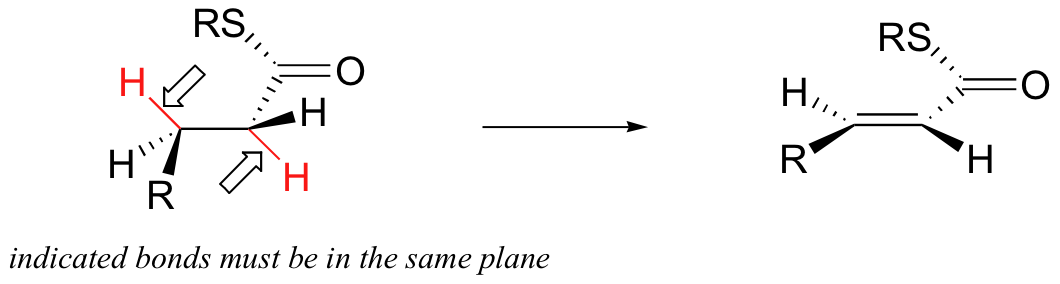
La reacción que se muestra a continuación es parte del proceso por el cual nuestro cuerpo quema las grasas para obtener energía (hablaremos de esta reacción en detalle en la section 16.5).
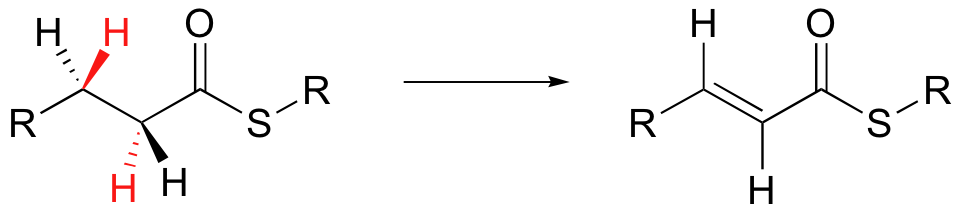
La molécula de grasa se lleva a cabo por una enzima en una conformación muy específica. Los dos enlaces CH que se rompen deben encontrarse en el mismo plano para que se produzca la reacción.