3.8: Diastereómeros
- Page ID
- 2330
3.7A: Los compuestos con múltiples estereocentros
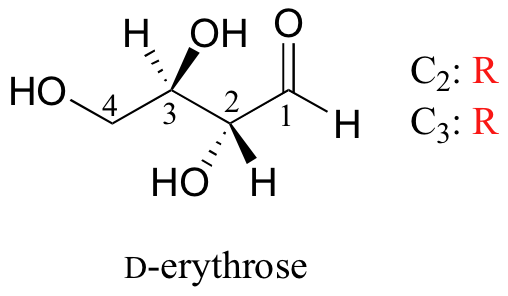
Nos dirigimos nuestra atención a moléculas que tienen más de un estereocentro. Vamos a empezar con una azúcar común de cuatro carbonos llamada D-eritrosa.
Una nota sobre la nomenclatura del azúcar: los bioquímicos utilizan un sistema especial para referirse a la estereoquímica de las moléculas de azúcar, empleando nombres de origen histórico, además de los designadores de 'D' y 'L'. Usted aprenderá acerca de este sistema si usted toma una clase de bioquímica. Vamos a utilizar las denominaciones L/D aquí para hacer referencia a diferentes azúcares, pero no vamos a preocuparnos por el aprendizaje del sistema.
Como se puede ver, D-eritrosa es una molécula quiral: C2 y C3 son estereocentros, los cuales tienen la configuración R. Además, se debe hacer un modelo para convencerse de que es imposible encontrar un plano de simetría a través de la molécula, independientemente de la conformación. ¿Tiene D-eritrosa un enantiómero? Por supuesto que sí - si es una molécula quiral, si deberia. El enantiómero de eritrosa es su imagen reflejada, y lleva el nombre de L-eritrosa (una vez más, usted debe utilizar los modelos para convencerse de que estas imágenes especulares eritrosa no son superponibles).
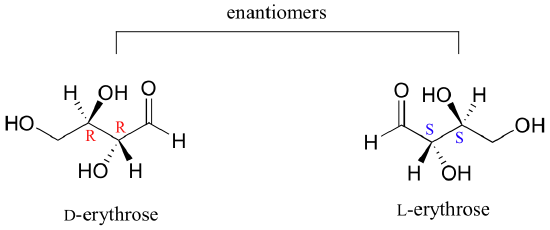
Observe que los dos centros quirales en L-eritrosa ambos tienen la configuración S. En un par de enantiómeros, todos los centros quirales son de la configuración opuesta.
¿Qué sucede si dibujamos un estereoisómero de eritrosa en el que la configuración es S en C2 y R en C3? Este estereoisómero, que es un azúcar llamado D-treosa, no es una imagen reflejada de eritrosa. D-treosa es un diastereómero de ambos D-eritrosa y L-eritrosa.
La definición de diastereómeros es simple: si dos moléculas son estereoisómeros (misma fórmula molecular, misma conectividad, diferente disposición de los átomos en el espacio), pero no son enantiómeros, entonces son diastereómeros por defecto. En términos prácticos, esto significa que al menos uno - pero no todos - de los centros quirales son opuestas en un par de diastereómeros. Por definición, dos moléculas que son diastereómeros no son imágenes especulares el uno del otro.
L-treosa, el enantiómero de D-treosa, tiene la configuración R en C2 y la configuración S en C3. L-treosa es un diastereómero de ambos enantiómeros eritrosa.
En general, una estructura con n estereocentros tendrá 2n estereoisómeros diferentes. (No estamos considerando, por el momento, la estereoquímica de dobles enlaces - eso vendrá más adelante). Por ejemplo, consideremos la molécula de glucosa en su forma de cadena abierta (Recordamos que pueden existir muchas moléculas de azúcar, ya sea en una cadena abierta o una forma cíclica). Hay dos enantiómeros de la glucosa, llamados D-glucosa y L-glucosa. El D-enantiómero es el azúcar común que nuestro cuerpo utiliza para obtener energía. Tiene n = 4 estereocentros, por lo que por lo tanto hay 2n = 24 = 16 estereoisómeros posibles (incluyendo D-glucosa).
En L-glucosa, todos los estereocentros están invertidos en relación con D-glucosa. Eso deja 14 diastereómeros de D-glucosa: estos son moléculas en las que al menos uno, pero no todos, de los estereocentros se invierten en relación con D-glucosa. Uno de estos 14 diastereómeros, un azúcar llamado D-galactosa, se muestra arriba: en D-galactosa, uno de los cuatro estereocentros se invierte en relación con D-glucosa. Los diastereoisómeros que difieren en sólo un estereocentro (de dos o más) se conocen como epímeros. Por lo tanto, D-glucosa y D-galactosa pueden ser referidos como epímeros, así como diastereómeros.
Ejemplo 3.11
Dibujar la estructura de dos diastereómeros más de D-glucosa. Uno debe ser un epímero.
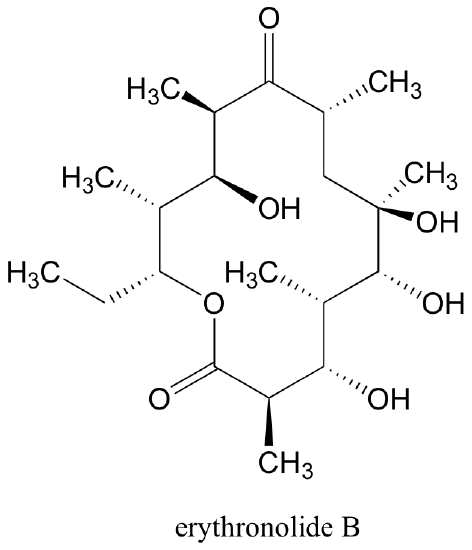
En total, hay 210 = 1024 estereoisómeros en la familia eritronolida B: 1022 de éstas son diastereómeros de la estructura anterior, uno es el enantiómero de la estructura anterior, y la última es la estructura anterior.
Sabemos que los enantiómeros tienen propiedades físicas idénticas y grados iguales pero opuestos de rotación específica. Diastereómeros, al menos en teoría, tienen diferentes propiedades físicas - estipulamos "en teoría" porque a veces las propiedades físicas de dos o más diastereoisómeros son tan similares que es muy difícil separarlos. Además, las rotaciones específicas de los diastereómeros no están relacionadas - que podrían ser el mismo signo o signos opuestos, y similar en magnitud o muy disímiles.
3.7B: Compuestos Meso
Es una regla general que cualquier molécula con al menos un estereocentro es quiral - pero como con la mayoría de las reglas, hay una excepción. Algunas moléculas tienen más de un estereocentro pero en realidad son aquiral - estos son llamados compuestos meso. Ácido tartárico, un subproducto del proceso de elaboración del vino, es un buen ejemplo.
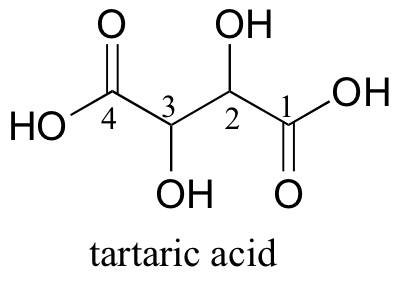
Con dos estereocentros, debería aver, en teoría, cuatro estereoisómeros de ácido tartárico. De hecho, hay sólo tres . En primer lugar, hay un par de enantiómeros con (2R, 3R) y (2S, 3S) estereoquímica.
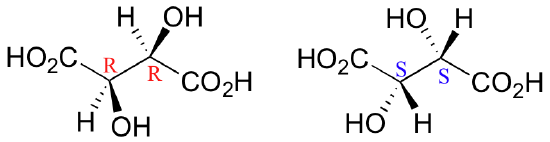
Ahora, considere cuidadosamente un (2S, 3R) estereoisómero. Usted puede notar que, cuando se hace girar en apenas la conformación correcta, este isómero tiene un plano de simetría que pasa por el enlace C2-C3.
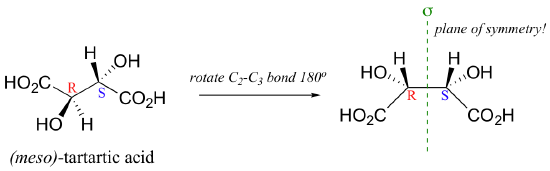
Eso significa que esta molécula no es quiral, a pesar de que tiene dos estereocentros! También significa que (2R, 3S) ácido tartárico y (2S, 3R) ácido tartárico no son enantiómeros, como podríamos haber esperado - en realidad son la misma molécula, el ácido meso-tartárico. Esta molécula aquiral es, sin embargo, todavía un diastereómero de ambos R, R y S, S ácido tartárico. Tenga en cuenta que los dos '' estereocentros (meso) - ácido tartárico tienen los mismos cuatro sustituyentes - este es un requisito previo para compuestos meso; de lo contrario no habría ningún plano de simetría.
Los compuestos cíclicos también pueden ser meso. Uno de los muchos ejemplos de este tipo es cis-1,2-dihidroxiciclohexano. Tenga en cuenta, sin embargo, que si los grupos hidroxilo son trans entre sí, la molécula es quiral.
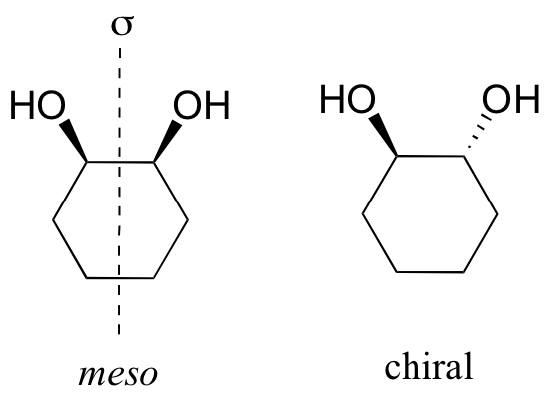
Afortunadamente para los estudiantes de química orgánica con exceso de trabajo, el compuesto meso es un caso muy especial, y es difícil encontrar muchos ejemplos de origen natural. Pero, sin embargo, parece que les gusta aparecer en las preguntas del examen de química orgánica.
Ejemplo 3.12
¿Cuál de las moléculas que se muestran abajo son meso? ¿Cuáles son quirales? ¿Cuáles son aquiral, pero no meso?
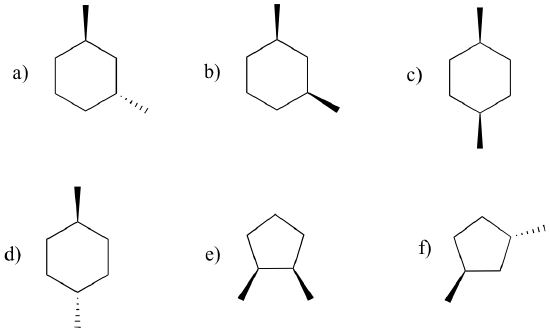
Ejemplo 3.12
Dibuja la estructura de otro dimetilciclopentano isómero que es meso (no utilice las estructuras del problema anterior).
3.7C: Estereoisomerismo de alquenos
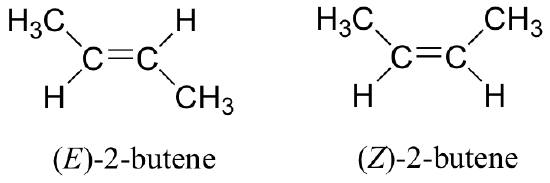
Como vimos con compuestos meso, una molécula o grupo no necesita ser quiral para tener estereoisómeros. Grupos alquenos asimétricos tienen una estereoquímica definida asociada con su estructura, pero a causa de su geometría plana tienen un plano de simetría inherente y por lo tanto no son quirales. Consideremos, por ejemplo, dos formas estereoisómeras de 2-buteno.
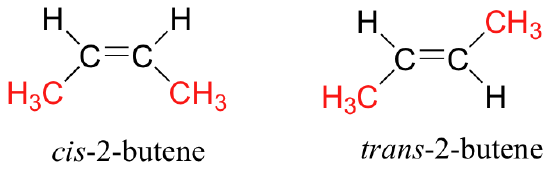
El isómero de la izquierda es cis-2-buteno, mientras que el isómero de la derecha es trans-2-buteno. Como ya hemos aprendido, el prefijo trans significa 'lado opuesto', y el prefijo cis significa 'mismo lado'. Debido a que existe una barrera para rotar alrededor del doble enlace C2-C3, el isómeros cis y trans son en realidad diferentes estereoisómeros, no sólo diferentes conformaciones de la misma molécula. Específicamente, se ajustan a la definición de diastereómeros: tienen la misma conectividad pero un arreglo diferente de átomos en el espacio, y no son imágenes especulares.
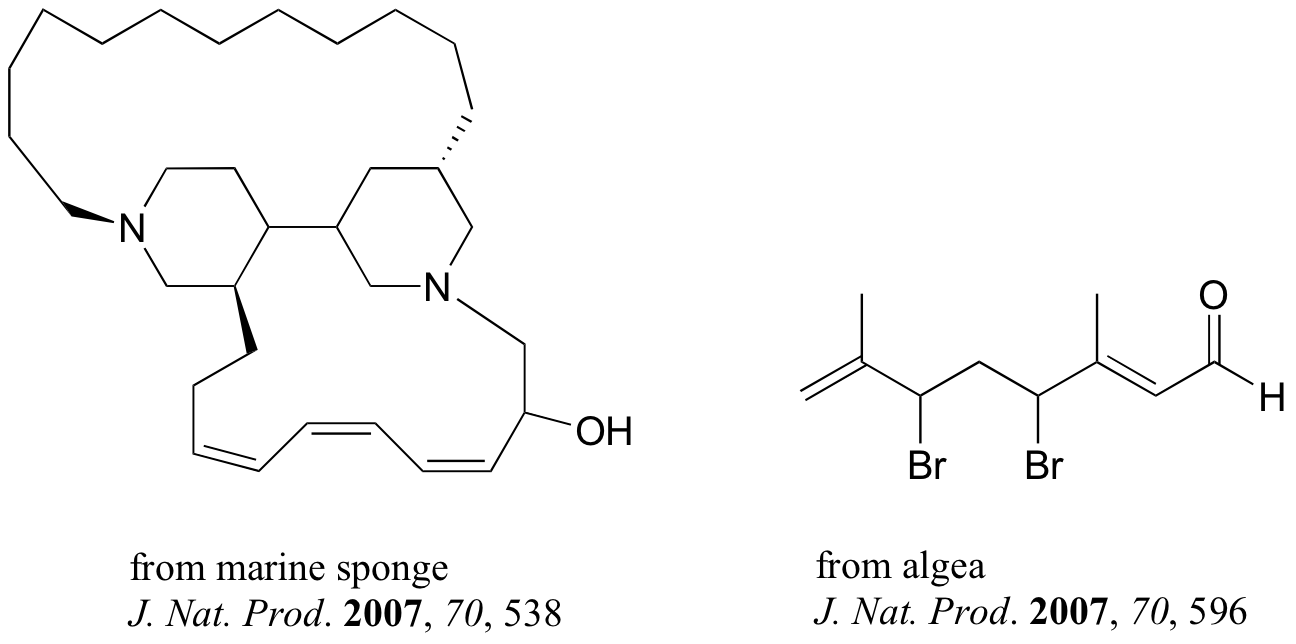
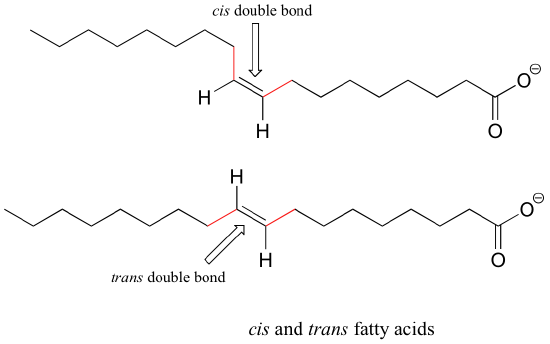
Abajo hay algunos ejemplos de las biomoléculas que tienen Grupos alquenos diastereoméricas. La mayoría de ácidos grasos insaturados de origen natural tienen enlaces cis-dobles, pero los ácidos grasos trans, que se cree que son dañosos, se encuentran en la margarina y algunos tipos de carne (ver sección 16.5D para más información sobre la química de las grasas trans).
Retinal es una molécula sensible a la luz, derivado de la vitamina A, que se encuentra en Cuando la luz entra en el ojo a través de la retina, el diastereómero 11-cis de la retina se convierte en el diastereómero todo-trans, cambiando la forma de la molécula y la forma en que se une a la proteína rodopsina visión.las células de barra del ojo. Esto inicia una cadena de acontecimientos que conduce a que una señal se envíe al centro de la visión del cerebro.
Retinal is a light-sensitive molecule, derived from vitamin A, that is found in the rod cells of the eye. When light enters the eye through the retina, the 11-cis diastereomer of retinal is converted to the all-trans diastereomer, changing the shape of the molecule and the way that it binds to the vision protein rhodopsin. This initiates a chain of events that leads to a signal being sent to the vision center of the brain.

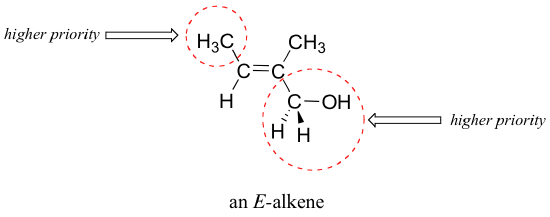
Aunque los términos cis y trans son bastante claros en los ejemplos anteriores, en algunos casos puede ser ambiguo, y se requiere una designación estereoquímica más rigurosa. Para designar sin ambigüedades la estereoquímica general de alqueno, lo mejor es utilizar los designadores 'E' y 'Z'. Para utilizar este sistema de nombramiento, primero decidimos cual es el grupo de mayor prioridad en cada carbono del doble enlace, utilizando las mismas reglas de prioridad que aprendimos para el sistema R/S. Si los grupos de mayor prioridad están en el mismo lado del doble enlace, es un Z-alqueno, y si están en el lado opuesto es un E-alqueno. Abajo se muestra un ejemplo de un E-alqueno: observe que, aunque los dos grupos metilo están en el mismo lado (cis) en respecto de uno al otro, el alqueno tiene la estereoquímica general E de acuerdo con las reglas del sistema E/Z porque uno de los grupos metilo tiene una prioridad más baja.
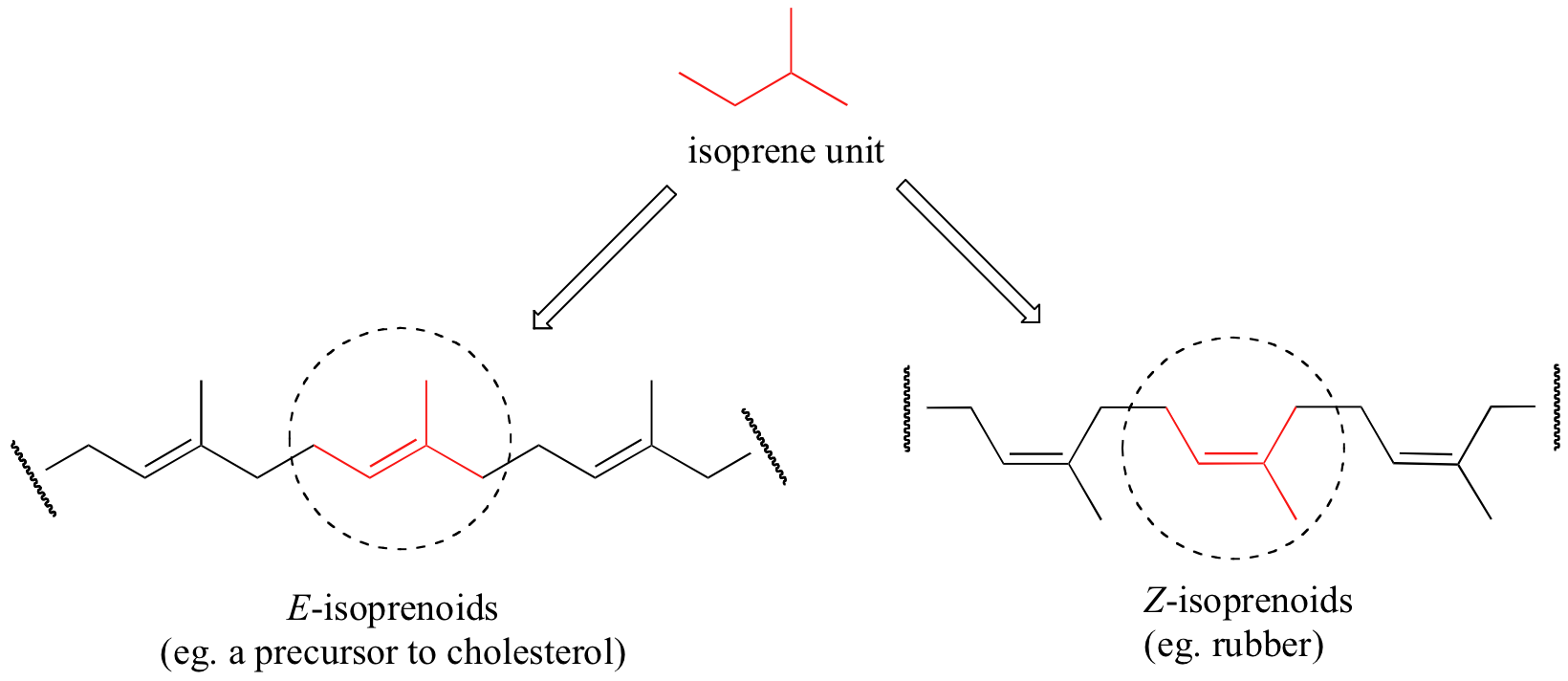
El caucho natural es un polímero compuesto de cinco bloques de construcción de carbono, llamados 'isopreno', que están vinculados con Z estereoquímica. Los mismos bloques de construcción de isopreno también se pueden conectar con estereoquímica E, para dar un polímero que es un precursor del colesterol (y muchos otros compuestos naturales encontrados en todas las formas de vida).
Como regla general, alquenos con los grupos más voluminosos en lados opuestos del doble enlace son más estables, debido a la reducción de la tensión estérica. El E (o trans) diastereómero de 2-buteno, por ejemplo, es más estable que el Z (o cis) diastereómero.
En una reacción donde cualquier 2-buteno isómero puede formar, es el isómero E que predominará (vamos a ver un ejemplo de este fenómeno cuando estudiamos una reacción llamada una "eliminación" en la sección 14.3, y también será importante cuando nos fijamos en el problema de las grasas trans en sección 16.5D).
Ejemplo 3.14
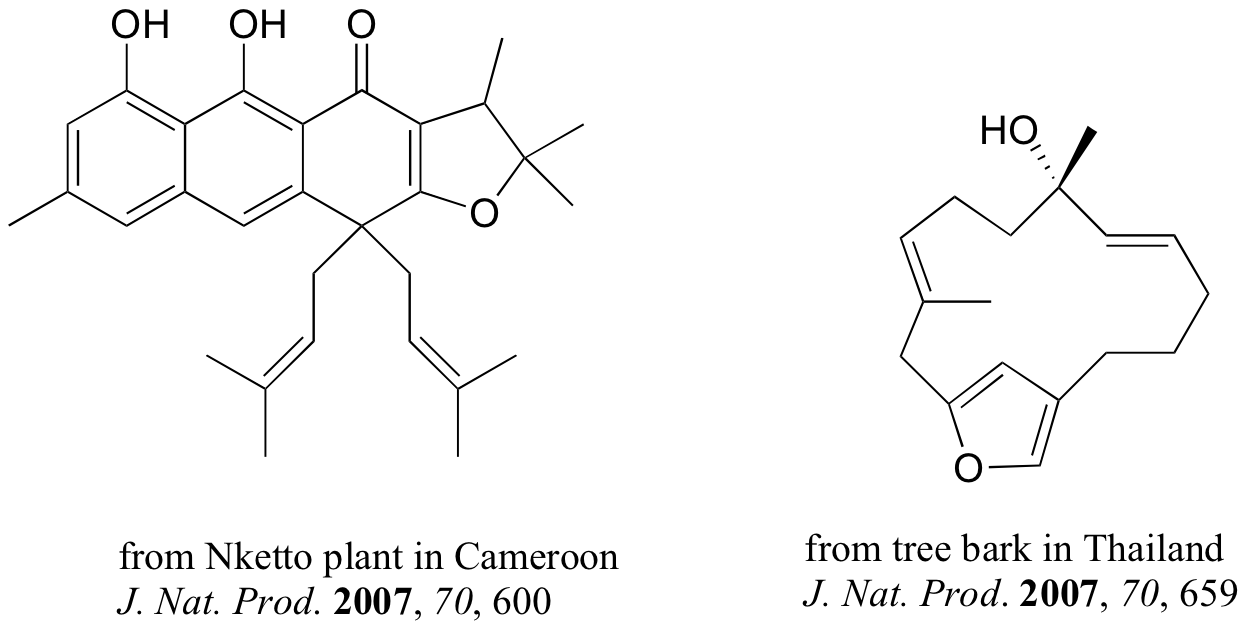
Los compuestos que se muestran abajo fueron aislados de fuentes naturales y sus estructuras reportadas en una edición reciente de la revista llamada Journal of Natural Products edición reciente de la revista llamada Journal of Natural Products, una publicación de la American Chemical Society. Etiquetar todos los grupos alqueno que no se encuentran dentro de anillos de 5 ó 6 miembros como E, Z, o N (ni E ni Z).