3.11: Proquiralidad
- Page ID
- 2333
3.10A: Proquiral sustituyentes en carbonos tetraédricos
Cuando un carbono tetraédrica puede ser convertido a un centro quiral con solo cambiar uno de los grupos unidos, se conoce como un centro ‘proquiral’. El ejemplo mostrado abajo es la forma reducida de una molécula llamada nicotinamida adenina dinucleótido (NADH), un partícipe importante en muchas reacciones de oxidación/reducción bioquímico (seccion 16.4A).
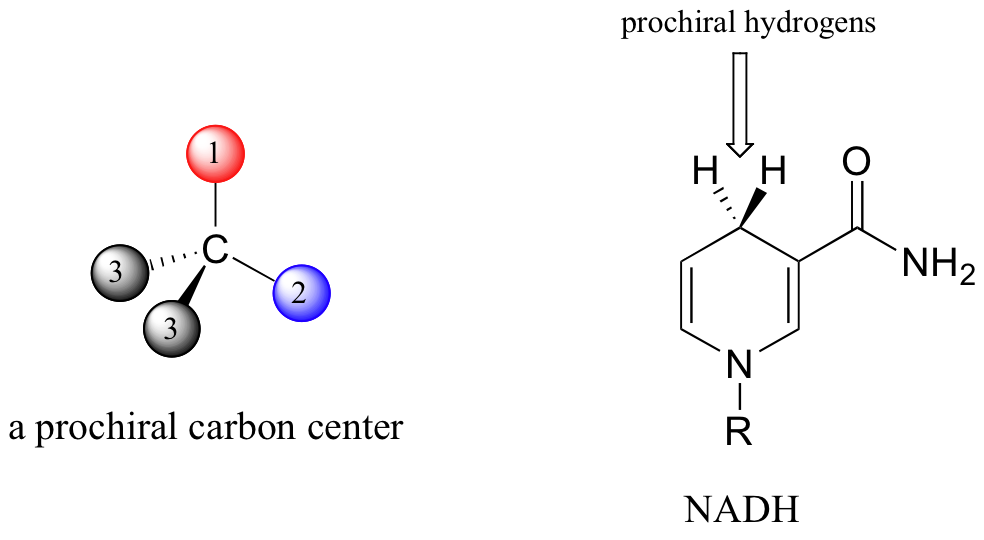
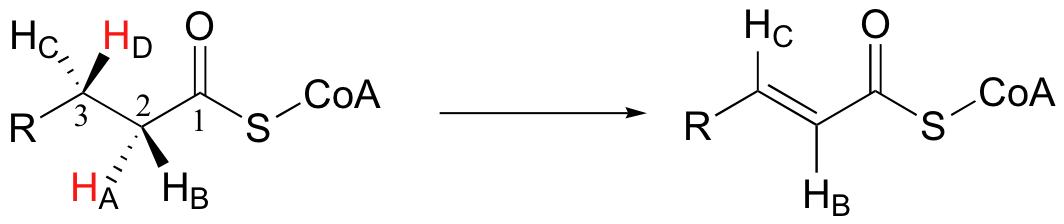
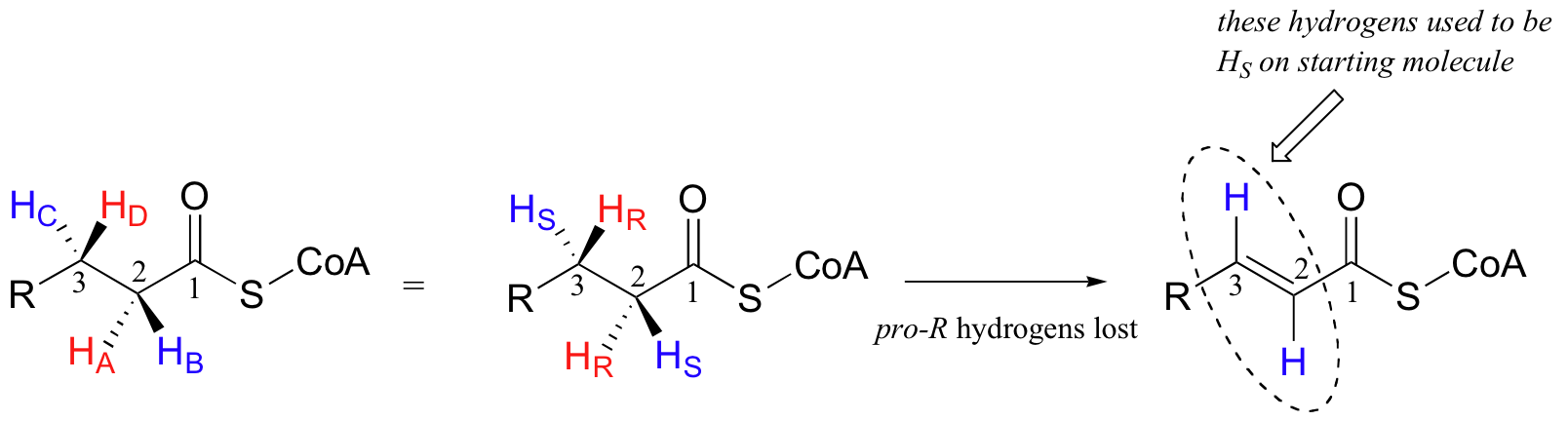
Nota si, en un experimento de mente, cambiamos cualquiera de los hidrógenos indicados en NADH por un deuterio (el 2H isótopo de hidrógeno), el carbono se convertirá en un centro quiral. Proquiralidad es un concepto importante en la química biológica, porque las enzimas pueden distinguir entre los dos grupos ‘idénticos’ ligados a un centro carbono proquiral debido a que ocupan diferentes regiones en el espacio tridimensional. Por ejemplo en la siguiente reacción, que es un paso clave en la oxidación de ácidos grasos, son específicamente HA y HD que se pierden, mientras HB y HC permanecen en el alqueno conjugado resultante.
Los hidrógenos proquiral en C2 y C3 del ácido grasoso pueden ser designados de acuerdo a una variación en el sistema R/S. Por el bien de la claridad, veremos una molécula (etanol) mucho más simple para explicar este sistema.
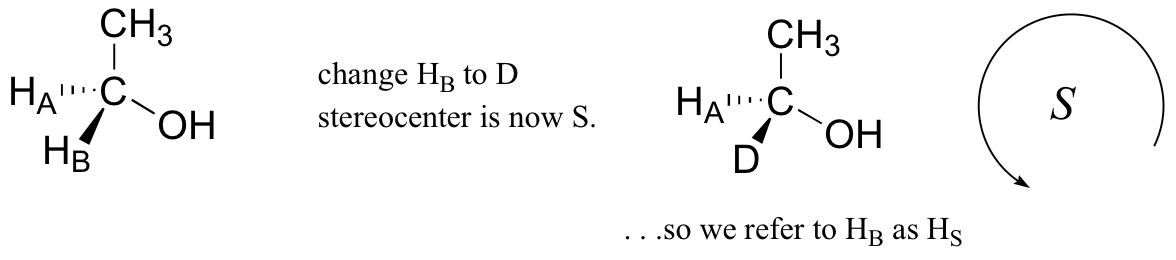
Para nombrar los dos hidrógenos proquiral en etanol, de nuevo tenemos que participar en un experimento de mente. Si nosotros, en nuestra imaginación, cambiamos arbitrariamente HB a un deuterio, la molécula ahora será quiral y el estereocentro tendría la configuración S (D tiene una prioridad más alta que H). Por esta razón, podemos referirnos a HB como el hidrogeno pro-S de etanol, y etiquetarlo HS. Al contrario, si cambiamos HA a D y dejamos HB como un hidrogeno, la configuración de la molécula se convierte en R, entonces podemos referirnos a HA como el hidrogeno pro-R de etanol, y etiquetarlo HR.
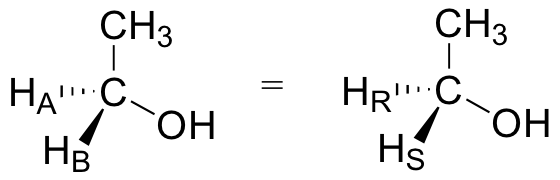
Si recordamos nuestro ejemplo de ácido grasoso, vemos que es específicamente el hidrogeno pro-R en los carbonos 2 y 3 que son perdidos en la reacción.
Hidrógenos proquiral pueden ser designados como cualquiera enantiotópicos o diastereotópicos. Si cualquiera HR o HS en etanol fueran remplazados por deuterio, las dos moléculas resultantes serian enantiómeros (porque no hay otros estereocentros).
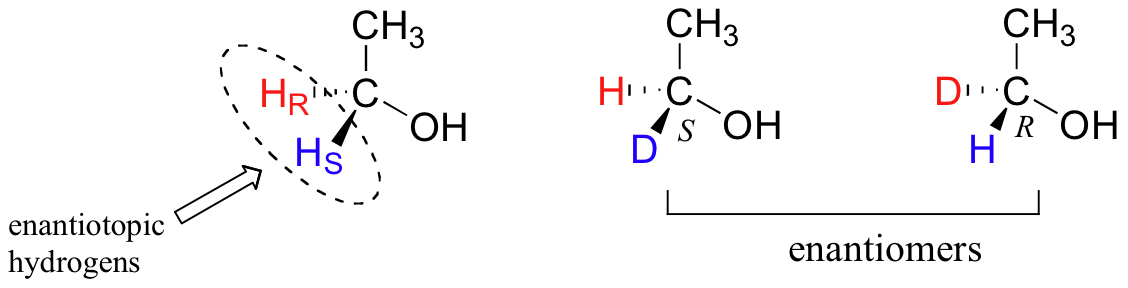
Por lo tanto, estos dos hidrógenos se conocen como enantiotópicos. En gliceraldehído-3-fosfato (GAP), sin embargo, vemos algo diferente:
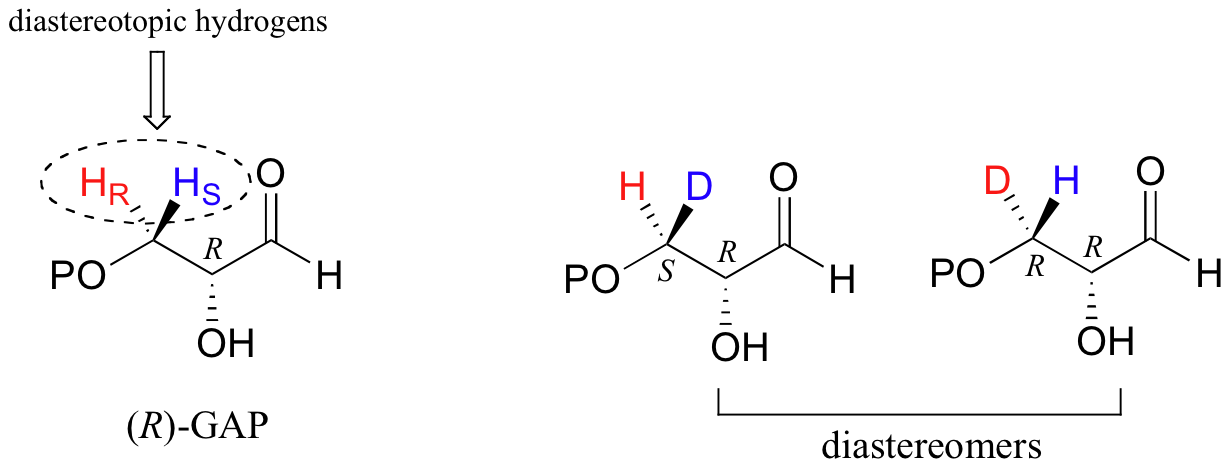
Si cualquiera de HR o HS es remplazado por un deuterio, las dos moléculas resultantes serán diastereómeros – entonces, en esta molécula, HR y HS son conocidos como hidrógenos diastereotópicos. La importancia de la distinción entre los grupos enantiotópicos y diastereotópicos será aparente cuando aprendamos sobre la técnica analítica llamada resonancia magnética nuclear.
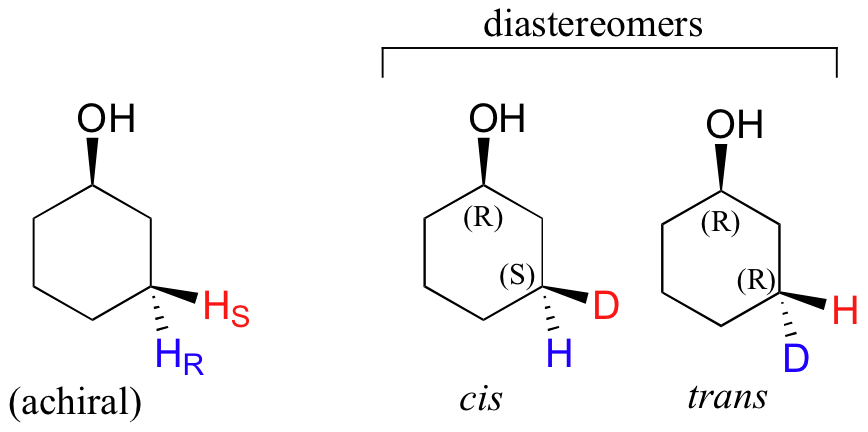
Dos hidrógenos en el mismo carbono de una estructura de anillo sustituido pueden ser diastereotópicos – podemos determinar esto con llevar acabo el mismo experimento de mente como se discutió anteriormente. En el siguiente ejemplo, los hidrógenos diastereotópicos indicados están ya sea en el mismo lado o en el lado opuesto del anillo respeto al grupo hidroxilo.
Finalmente, los hidrógenos que son completamente idénticos y no pueden ser designados enantiotópicos ni diastereotópicos se llaman homotópico. Si un hidrogeno homotópico es remplazado por deuterio, un centro quiral no es creado. Los tres átomos de hidrógeno en el grupo metilo (CH3) de etanol (y en cualquier grupo metilo) son homotópico.
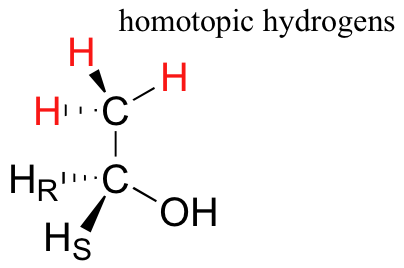
Incluso a una enzima, los tres de estos hidrógenos se verán iguales.
Ejercicio 3.10.1
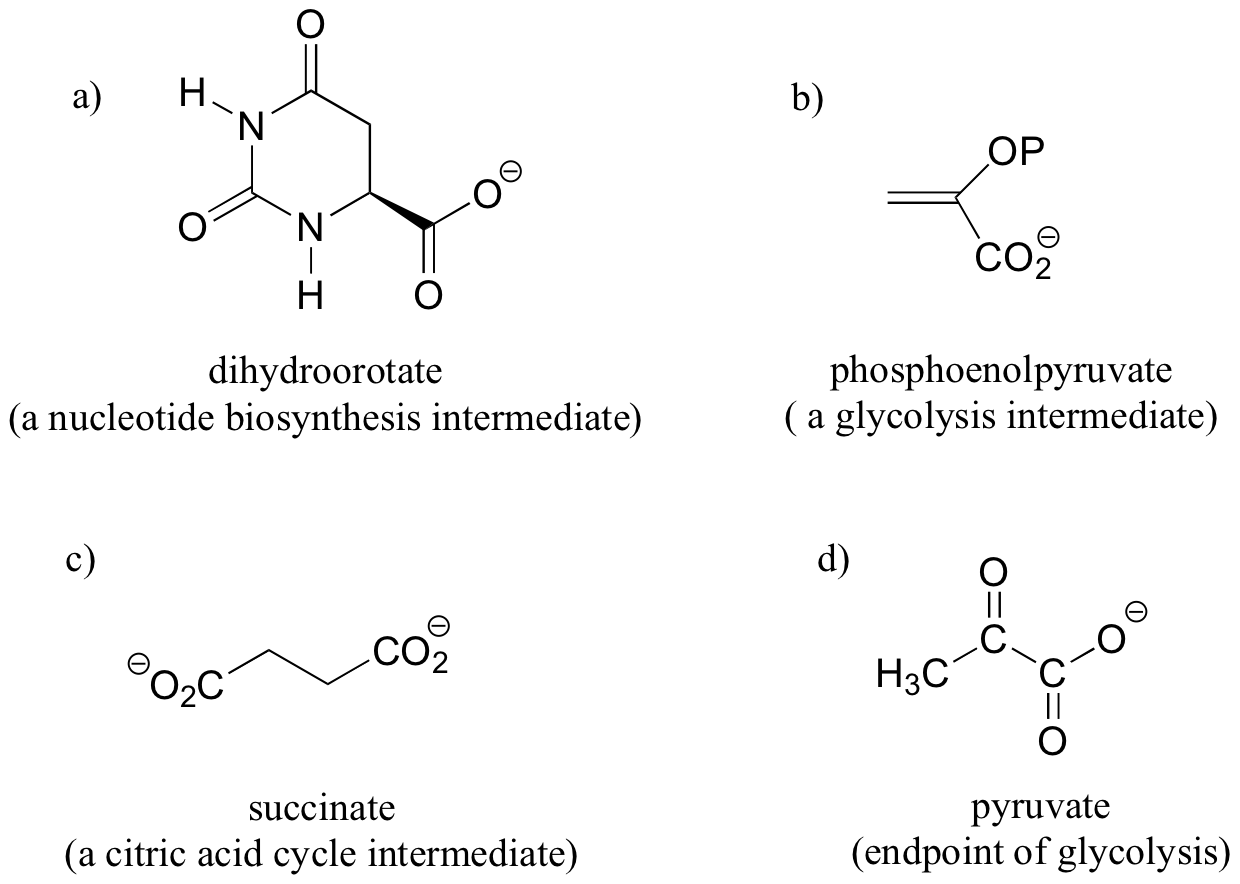
Ejercicio 3.16: En la molécula siguiente identifica todos los pares/grupos de hidrogeno que son homotópico, enantiotópicos, o diastereotópicos. Cuando sea apropiado, etiqueta los hidrógenos proquiral como HR o HS
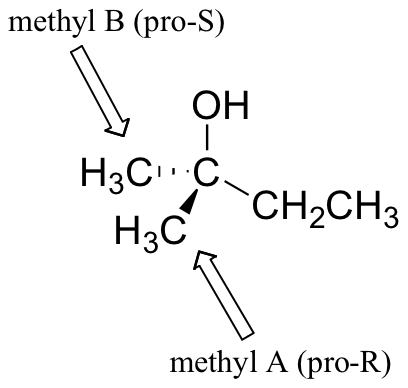
Grupos distintos a hidrógenos pueden considerarse proquiral. El alcohol de abajo tiene dos grupos metilo proquirales - metilo A es el pro-R metilo, y metilo B es pro-S. (¿Cómo hacemos estas designaciones? Simple – solo arbitrariamente has metilo A una prioridad más alta que metilo B, y el compuesto ahora tiene la configuración R).
Citrato provee un ejemplo más complejo. El carbono central es un centro proquiral con dos ‘brazos’ que son idénticos excepto que uno puede ser designado pro-R y el otro pro-S.
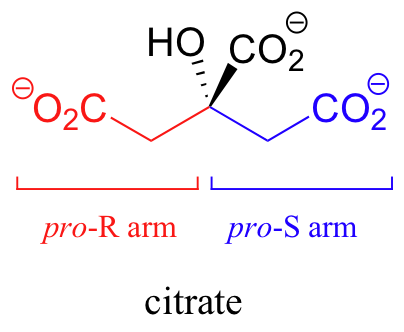
En una reacción del ciclo del ácido cítrico (ciclo de Krebs), una molécula de agua es perdida específicamente en el brazo pro- R (estudiaremos esta reacción en la sección 14.1B).
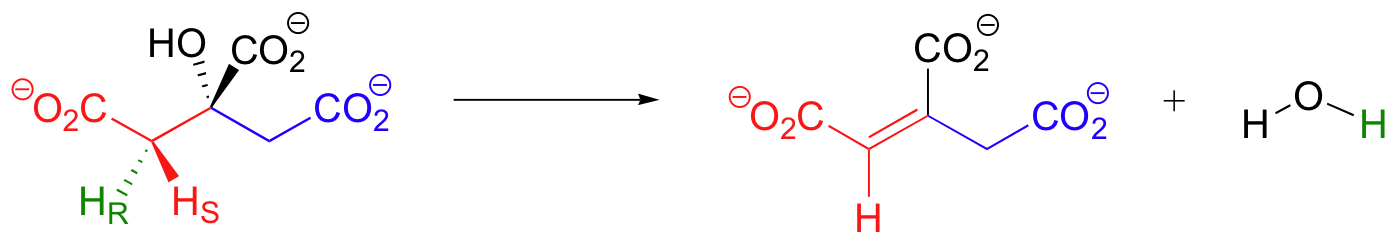
Nota también que es específicamente el hidrogeno pro-R en el brazo pro-R de cítrico que se pierde - una capa más de estereoselectividad!
Ejercicio 3.10.2
A pesar de que un carbón de alqueno enlazado a dos grupos idénticos no es considerado un centro proquiral, estos dos grupos pueden ser diastereotópicos. Ha y Hb en el alqueno de abajo, por ejemplo, son diastereotópicos: Si cambiamos uno, y después el otro, de estos hidrógenos por deuterio, los compuestos que resultan son diastereómeros E y Z.
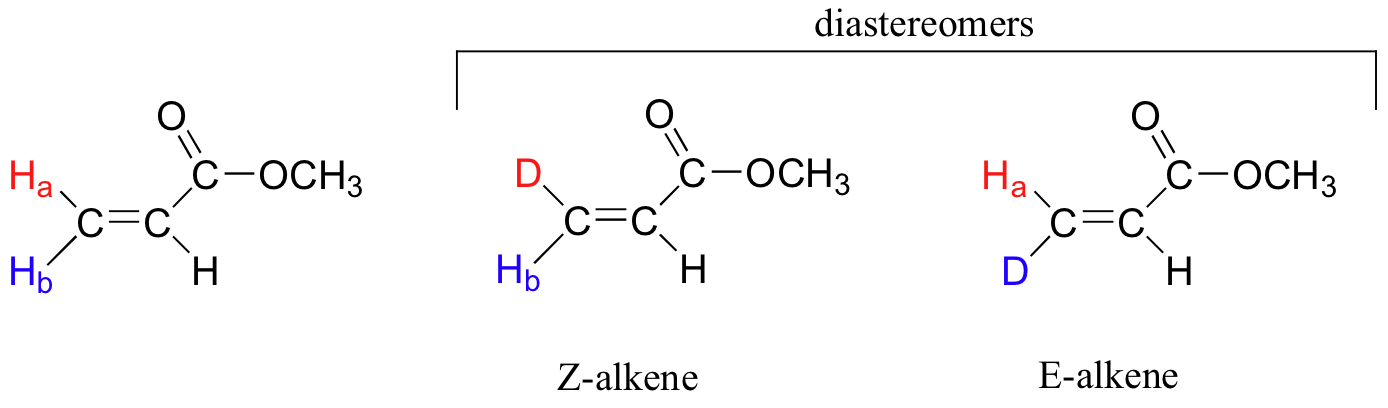
3.10B: Carbonos de carbonilo e imina como centros proquirales
Trigonal plana, carbonos sp2-hibridado no son, como bien sabemos, centros quirales – pero se conocen como centros proquiral si están enlazados a tres sustituyentes diferentes. Como podrás esperar, nosotros (y las enzimas que catalizan sus reacciones) podemos distinguir entre las dos ‘caras’ planas de un sp2 proquiral - grupo hibridado. Estas caras son designadas por los términos re y si. Para determinar cual es la cara re y cual es si de un grupo orgánico plana, simplemente usamos el mismo ranking de prioridad que conocemos del sistema R/S, y trazar un circulo: re es a sentido horario y si es sentido anihorario.

Abajo, por ejemplo, estamos viendo hacia abajo en la cara re del grupo cetona en piruvato:
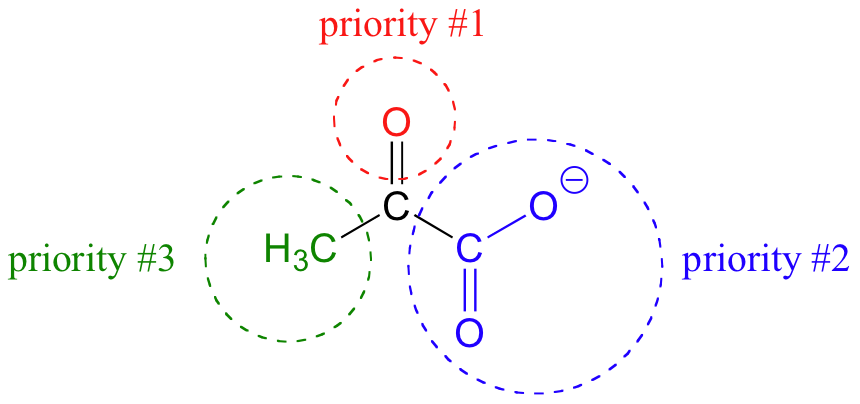
Si volteamos la molécula, estaremos mirando la cara si del grupo cetona. Nota que el grupo carboxilato no tiene caras re y si, porque dos de los tres sustituyentes en el carbono son idénticos (cuando las dos formas de resonancia de carboxilato son tomades en cuenta).
Como veremos empezando en el capítulo 11, enzimas que catalizan reacciones en el carbono carbonilo actúan específicamente de un lado o el otro.
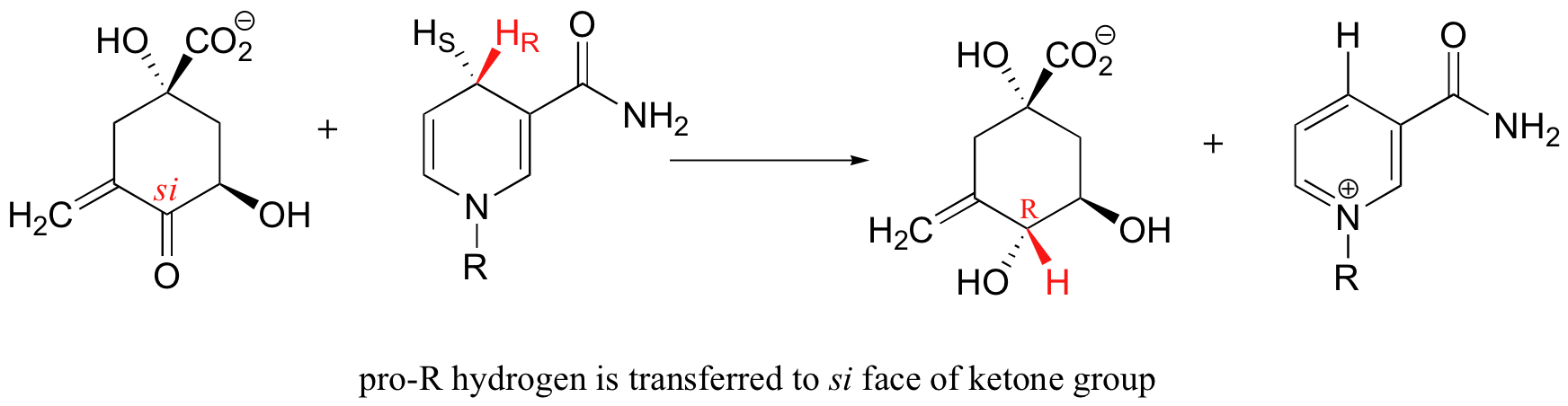
Nota que la reacción de ‘hidrogenación’ de arriba es específica no solamente en términos de cual cara del grupo carbonilo es afectada, pero también en términos de cuál de los dos hidrógenos diastereotópicos en NADH es transferido (estudiaremos este tipo de reacción con más detalle en la sección 16.4).
Ejercicio 3.10.3
Ejercicio 3.18: Para cada uno de los grupos carbonilo en uracilo, indique si estamos viendo la cara re o la si en el dibujo estructural siguiente. .