4.2: Clasificación de las reacciones químicas
- Page ID
- 1820
habilidades para desarrollar
- Defina tres tipos comunes de reacciones químicas (precipitación, ácido-base y oxidación-reducción)
- Clasifique las reacciones químicas como uno de estos tres tipos con descripciones apropiadas o ecuaciones químicas
- Identifique los ácidos y los bases comunes.
- Prediga la solubilidad de los compuestos inorgánicos comunes usando las reglas de solubilidad
- Calcule los estados de oxidación de elementos en compuestos.
Los seres humanos interactúan el uno con el otro de varias formas complejas, y clasificamos estas interacciones de acuerdo con patrones de comportamiento comunes. Cuando dos humanos intercambian información, decimos que están comunicando. Cuando intercambian golpes con sus puños o pies, decimos que están luchando. Confrontados con varias interacciones variadas entre sustancias químicas, los científicos también han encontrado conveniente (o incluso necesario) clasificar las interacciones químicas mediante la identificación de patrones comunes de reactividad. Este módulo dará una introducción a tres de los tipos más frecuentes de reacciones químicas: precipitación, ácido-base y oxidación-reducción.
Las reacciones de la precipitación y las reglas de la solubilidad
En una reacción de precipitación las sustancias disueltas reaccionan para formar uno (o más) productos sólidos. Muchas reacciones de este tipo involucran el intercambio de iones entre compuestos iónicos en solución acuosa y algunas veces se conocen como reacciones de doble desplazamiento, reemplazo doble o metátesis. Estas reacciones son comunes en la naturaleza y son responsables por la formación de arrecifes de coral en aguas oceánicas y cálculos renales en animales. Se usan ampliamente en la industria para la producción de una serie de productos básicos y productos químicos especializados. Las reacciones de precipitación también son centrales en muchas técnicas de análisis químico, incluidas las pruebas puntuales usadas para identificar los iones metálicos y métodos gravimétricos para determinar la composición de la materia (consulte el último módulo de este capítulo).
El extenso al que una sustancia se puede disolver en agua, o cualquier disolvente, se expresa cuantitativamente como su solubilidad, definida como la concentración máxima de una sustancia que se puede lograr en condiciones específicas. Se dice que las sustancias con solubilidades relativamente grandes son solubles. Una sustancia precipitará cuando las condiciones de la solución sean tales que su concentración supere su solubilidad. Se dice que las sustancias con solubilidades relativamente bajas son insolubles, y estas son las sustancias que precipitan fácilmente de la solución. Se dará más información sobre estos conceptos importantes en el capítulo de texto sobre soluciones. Con el propósito de predecir las identidades de los sólidos formados por las reacciones de precipitación, uno puede simplemente referirse a los patrones de solubilidad que se han observado para muchos compuestos iónicos (Tabla \(\PageIndex{1}\)).
|
Compuestos solubles contienen |
Excepciones a estas reglas de solubilidad incluyen |
|
|
| Compuestos insolubles contienen | Excepciones a estas reglas de insolubilidad incluyen |
|
|
Se observa un ejemplo vívido de la precipitación cuando se mezclan soluciones de el yoduro de potasio y el nitrato de plomo, esto resulta en la formación de yoduro de plomo sólido:
\[\ce{2KI}(aq)+\ce{Pb(NO3)2}(aq)\rightarrow \ce{PbI2}(s)+\ce{2KNO3}(aq)\]
Esta observación concuerda con las reglas de solubilidad: el único compuesto insoluble entre todos los involucrados es el yoduro de plomo, una de las excepciones a la solubilidad general son las sales de yoduro.
La ecuación iónica neta que representa esta reacción es:
\[\ce{Pb^2+}(aq)+\ce{2I-}(aq)\rightarrow \ce{PbI2}(s)\]
El yoduro de plomo es un sólido amarillo brillante que antes se usaba como pigmento de un artista conocido como amarillo de yodo (Figura \(\PageIndex{1}\)). Las propiedades de los cristales puros de PbI2 los hacen útiles para la fabricación de detectores de los rayos X y los rayos gamma.

Las reglas de solubilidad de la Tabla \(\PageIndex{1}\) se pueden usar para predecir si se producirá una reacción de precipitación cuando se mezclen soluciones de compuestos iónicos solubles. Uno simplemente necesita identificar todos los iones presentes en la solución y luego considerar si es posible que el emparejamiento de catión / anión pueda dar un compuesto insoluble. Por ejemplo, mezclar soluciones de nitrato de plata y fluoruro de sodio producirá una solución que contiene iones Ag+, \(\ce{NO3-}\), Na+ y F−. Aparte de los dos compuestos iónicos originalmente presentes en las soluciones, AgNO3 y NaF, dos compuestos iónicos adicionales se pueden derivar de esta colección de iones: NaNO3 y AgF. Las reglas de solubilidad indican que todas las sales de nitrato son solubles, pero que AgF es una de las excepciones a la solubilidad general de las sales de fluoruro. Por lo tanto, se predice que ocurrirá una reacción de precipitación, como se describe en las siguientes ecuaciones:
\[\ce{NaF}(aq)+\ce{AgNO3}(aq)\rightarrow \ce{AgF}(s)+\ce{NaNO3}(aq)\hspace{20px}\ce{(molecular)}\]
Ejemplo \(\PageIndex{1}\): PREDICCIÓN DE REACCIONES DE PRECIPITACIÓN
Prediga el resultado de mezclar soluciones razonablemente concentradas de los siguientes compuestos iónicos. Si espera precipitación, escriba una ecuación iónica neta balanceada para la reacción.
- el sulfato de potasio y el nitrato de bario
- el cloruro de litio y el acetato de plata
- el nitrato de plomo y el carbonato de amonio
Solución
(a) Los dos productos posibles para esta combinación son el KNO3 y el BaSO4. Las reglas de solubilidad indican que BaSO4 es insoluble, por eso se espera una reacción de precipitación. La ecuación iónica neta para esta reacción, derivada de la manera detallada en el módulo anterior, es
(b) Los dos productos posibles para esta combinación son LiC2H3O2 y AgCl. Las reglas de solubilidad indican que el AgCl es insoluble, por eso se espera una reacción de precipitación. La ecuación iónica neta para esta reacción, derivada de la manera detallada en el módulo anterior, es
(c) Los dos productos posibles para esta combinación son PbCO3 y NH4NO3. Las reglas de solubilidad indican que el PbCO3 es insoluble, por eso se espera una reacción de precipitación. La ecuación iónica neta para esta reacción, derivada de la manera detallada en el módulo anterior, es
\[\ce{Pb^2+}(aq)+\ce{CO3^2-}(aq)\rightarrow \ce{PbCO3}(s) \nonumber\]
Ejercicio \(\PageIndex{1}\)
¿Qué solución se podría usar para precipitar el ion bario, Ba 2+, en una muestra de agua: el cloruro de sodio, el hidróxido de sodio o el sulfato de sodio? ¿Cuál es la fórmula para el precipitado que se espera?
- Respuesta
-
sulfato de sodio, BaSO4
Las reacciones del ácido-base
Una reacción de ácido-base tiene un ion hidrógeno, H+, que se transfiere de una especie química a otra. Estas reacciones son de importancia central para numerosos procesos naturales y tecnológicos, que van desde las transformaciones químicas que pasan dentro de las células, los lagos, y los océanos, hasta la producción a escala industrial de fertilizantes, productos farmacéuticos, y otras sustancias esenciales para la sociedad. El tema de la química ácido-base, es digno de una discusión exhaustiva, y un capítulo completo está dedicado a este tema más adelante en el texto.
Para los propósitos de esta breve introducción, consideraremos sólo los tipos más comunes de reacciones ácido-base que pasan en soluciones acuosas. En este contexto, un ácido es una sustancia que se disuelve en el agua para producir iones de hidronio, H3O+. Como ejemplo, considere la ecuación mostrada aquí:
El proceso representado por esta ecuación confirma que el cloruro de hidrógeno es un ácido. Cuando se disuelven en agua, los iones H3O+ se producen por una reacción química en cual los iones H+ se transfieren de las moléculas de HCl a las moléculas de H2O. (Figura \(\PageIndex{2}\)).
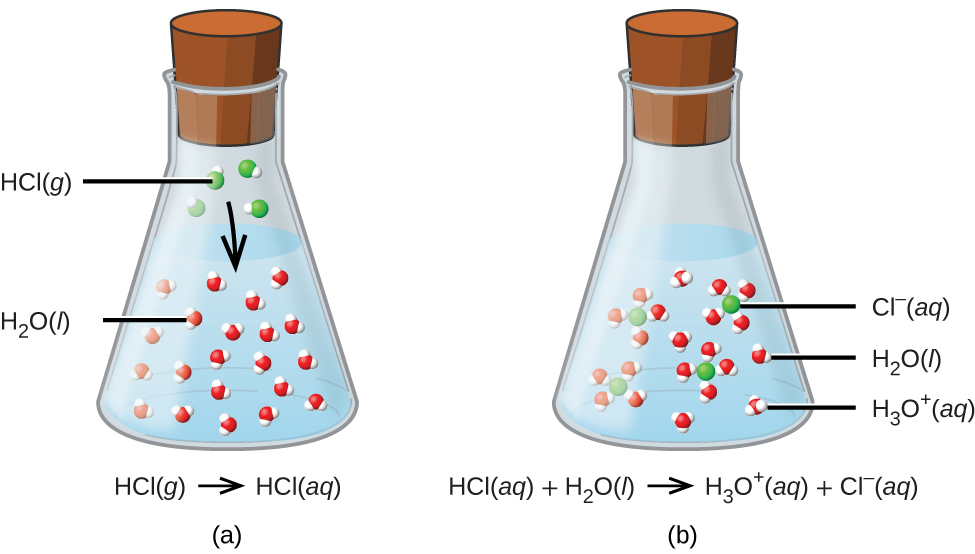
El HCl reacciona con el agua como se acaba de describir, es esencialmente eficiente al 100%: virtualmente cada molécula de HCl que se disuelve en el agua pasa por esta reacción. Los ácidos que reaccionan completamente de esta manera se conocen como los ácidos fuertes, y el HCl es uno de solo algunos de los compuestos ácidos comunes que se clasifican como fuertes (Tabla \(\PageIndex{1}\)). Un número mucho más grande de compuestos se comportan como los ácidos débiles y solo reaccionan parcialmente con el agua, dejando a una gran mayoría de moléculas disueltas en su forma original y generando una cantidad pequeña de iones hidronio. Los ácidos débiles se encuentran comúnmente en la naturaleza, siendo las sustancias en parte responsables del sabor ácido de las frutas cítricas, la sensación punzante de las picaduras de insectos y los olores desagradables asociados con el olor corporal. Un ejemplo familiar de un ácido débil es el ácido acético, el ingrediente principal de los vinagres para alimentos:
Cuando se disuelven en el agua en condiciones típicas, solo alrededor del 1% de las moléculas de ácido acético están presentes en forma ionizada, \(\ce{CH3CO2-}\) (Figura \(\PageIndex{3}\)). (El uso de una flecha doble en la ecuación anterior denota el aspecto de reacción parcial de este proceso, un concepto que se aborda completamente en los capítulos sobre el equilibrio químico).
| Fórmula de Compuesto | Nombre en Solución Acuosa |
|---|---|
| HBr | ácido bromhídrico |
| HCl | ácido clorhídrico |
| HI | ácido yodhídrico |
| HNO3 | ácido nítrico |
| HClO4 | ácido perclórico |
| H2SO4 | ácido sulfúrico |
Un base es una sustancia que se disuelve en el agua y produce iones de hidróxido, OH−. Las bases más comunes son compuestos iónicos hechos de cationes de metales alcalinos o alcalinotérreos (grupos 1 y 2) combinados con el ion hidróxido, por ejemplo, NaOH y Ca(OH)2. Cuando estos compuestos se disuelven en el agua, los iones de hidróxido se sueltan directamente en la solución. Por ejemplo, KOH y Ba(OH)2 se disuelven en el agua y se disocian completamente para producir cationes de (K+ y Ba2+, respectivamente) y tambien iones de hidróxido, OH−. Estas bases, junto con otros hidróxidos que se disocian completamente en el agua, se consideran bases fuertes.
Como ejemplo considere la disolución de la lejía (hidróxido de sodio) en agua:
Esta ecuación confirma que el hidróxido de sodio es una base. Cuando se disuelve en el agua, el NaOH se disocia y produce iones de Na+ y OH−. Esto también pasa con cualquier otro compuesto iónico que contiene iones de hidróxido. Dado que el proceso de disociación esta esencialmente completo cuando los compuestos iónicos se disuelven en el agua en condiciones típicas, el NaOH y otros hidróxidos iónicos se clasifican como bases fuertes.
Diferente que los hidróxidos iónicos, algunos compuestos producen iones de hidróxido cuando se disuelven al reaccionar químicamente con las moléculas del agua. En todos los casos, estos compuestos reaccionan sólo parcialmente, por eso se clasifican como bases débiles. Estos tipos de compuestos también son abundantes en la naturaleza y son productos importantes en diversas tecnologías. Por ejemplo, la producción global del base débil de amoníaco es generalmente más de 100 toneladas métricas por año, y se usa mucho como fertilizante agrícola, una materia prima para la síntesis química de otros compuestos, y un ingrediente activo en productos de limpieza para el hogar (Figura \(\PageIndex{4}\)). Cuando se disuelve en el agua, el amoníaco reacciona parcialmente para producir iones hidróxido, como se muestra aquí:
Esto es, por definición, una reacción de ácido-base, en este caso involucra la transferencia de iones H+ de moléculas de agua a moléculas de amoníaco. En condiciones típicas, solo alrededor del 1% del amoníaco disuelto está presente como iones de \(\ce{NH4+}\).

Las reacciones químicas descritas en las cuales los ácidos y los bases disueltos en el agua producen iones de hidronio y de hidróxido, son reacciones de ácido-base. En estas reacciones, el agua sirve como solvente y como reactivo. Una reacción de neutralización es un tipo específico de reacción ácido-base en la que los reactivos son un ácido y una base, a veces los productos son una sal y agua, y ninguno de los reactivos es el agua:
Para ilustrar una reacción de neutralización, considere qué sucede cuando se ingiere un antiácido típico como la leche de magnesia (una suspensión acuosa de Mg(OH)2 sólido) para aliviar los síntomas asociados con el exceso de ácido estomacal (HCl):
Tenga en cuenta que además del agua, esta reacción produce una sal, cloruro de magnesio.
Ejemplo \(\PageIndex{2}\): Escribiendo Ecuaciones para reacciones ácido-base
Escriba ecuaciones químicas balanceadas para las reacciones ácido-base descritas aquí:
- El ácido débil hipoclorito de hidrógeno reacciona con el agua.
- Una solución de hidróxido de bario se neutraliza con una solución de ácido nítrico.
Solución
(a) Se dan los dos reactivos, HOCl y H2O. Sabiendo que la sustancia es un ácido, su reacción con el agua involucrara la transferencia de H+ de HOCl a H2O para generar iones hidronio, H3O+ y también iones de hipoclorito, OCl−.
\[\ce{HOCl}(aq)+\ce{H2O}(l)\rightleftharpoons \ce{OCl-}(aq)+\ce{H3O+}(aq) \nonumber \]
Una doble flecha es apropiada para esta ecuación porque indica que el HOCl es un ácido débil que no ha reaccionado completamente.
(b) Se dan los dos reactivos, Ba(OH)2 y HNO3. Dado que esta es una reacción de neutralización, los dos productos serán agua y una sal compuesta por el catión del hidróxido iónico (Ba2+) y el anión generado cuando el ácido transfiere su ion hidrógeno \(\ce{(NO3-)}\).
\[\ce{Ba(OH)2}(aq)+\ce{2HNO3}(aq)\rightarrow \ce{Ba(NO3)2}(aq)+\ce{2H2O}(l) \nonumber \]
Ejercicio \(\PageIndex{21}\)
Escriba la ecuación iónica neta que representa la neutralización de cualquier ácido fuerte con un hidróxido iónico. (Sugerencia: considere los iones producidos cuando un ácido fuerte se disuelve en el agua).
- Respuesta
-
\[\ce{H3O+}(aq)+\ce{OH-}(aq)\rightarrow \ce{2H2O}(l) \nonumber\]
Explore la vista microscópica de los ácidos y los bases fuertes y débiles.
Las reacciones de oxidación-reducción
La atmósfera de la Tierra contiene 20% oxígeno molecular, O2, un gas químicamente reactivo que es importante en el metabolismo de los organismos aeróbicos y en muchos procesos ambientales que forman al mundo. El término oxidación se usó originalmente para describir reacciones químicas que involucraban O2, pero su significado ha evolucionado para referirse a una clase de reacción amplia y también importante conocida como reacciones de oxidación-reducción (redox). Se utilizarán algunos ejemplos de estas reacciones para desarrollar una imagen clara de esta clasificación.
Algunas reacciones de redox involucran la transferencia de electrones entre especies reactivas para producir productos iónicos, como la reacción entre el sodio y el cloro para producir el cloruro de sodio:
Es útil ver el proceso con respecto a cada reactante individual, es decir, representar el destino de cada reactivo en la forma de una ecuación llamada una media reacción:
\[ \begin{align*} \ce{2Na}(s) &\rightarrow \ce{2Na+}(s)+\ce{2e-} \\[5pt] \ce{Cl2}(g)+\ce{2e-} &\rightarrow \ce{2Cl-}(s) \end{align*}\]
Estas ecuaciones muestran que los átomos de Na pierden electrones mientras que los átomos de Cl (en la molécula de Cl2) ganan electrones, los subíndices "s" para los iones que resultan significan que están presentes en un compuesto iónico sólido. Para reacciones redox de este tipo, la pérdida y ganancia de electrones definen los procesos complementarios que ocurren:
\(\begin{align}\textbf{oxidation}&=\textrm{loss of electrons}\\
\textbf{reduction}&=\textrm{gain of electrons}
\end{align}\)
Entonces, en esta reacción, el sodio se oxida y el cloro pasan por una reducción. Visto desde una perspectiva más activa, el sodio funciona como un agente reductor (reductor), porque da electrones (o reduce) el cloro. Del mismo modo, el cloro funciona como un agente oxidante (oxidante), ya que eficazmente elimina los electrones del sodio (oxida).
\(\begin{align}\textbf{reducing agent}&=\textrm{species that is oxidized}\\
\textbf{oxidizing agent}&=\textrm{species that is reduced}
\end{align}\)
Sin embargo, algunos procesos redox no implican la transferencia de electrones. Considere, por ejemplo, una reacción similar a la que produce \(\ce{NaCl}\):
El producto de esta reacción es un compuesto covalente, así que la transferencia de electrones en el sentido explícito no está involucrada. Para aclarar la similitud de esta reacción con la de antes y permitir una definición inequívoca de las reacciones redox, se ha definido una propiedad llamada número de oxidación. El número de oxidación (o estado de oxidación) de un elemento en un compuesto, es la carga que sus átomos tendrían si el compuesto fuera iónico. Las siguientes reglas se usan para asignar números de oxidación a cada elemento en una molécula o ion.
- El número de oxidación de un átomo en una sustancia elemental es cero.
- El número de oxidación de un ion monatómico es igual a la carga del ion.
- Los números de oxidación para los no metales comunes generalmente se asignan de la siguiente manera:
- Hidrógeno: +1 cuando se combina con no metales, −1 cuando se combina con metales
- Oxígeno: −2 en la mayoría de los compuestos, y a veces −1 (los peróxidos, \(\ce{O2^2-}\)), muy raramente \(-\dfrac{1}{2}\) (llamados superoxides, \(\ce{O2-}\)), valores positivos cuando se combinan con F (los valores varían)
- Halógenos: −1 para F siempre, −1 para otros halógenos, excepto cuando se combinan con oxígeno u otros halógenos (números de oxidación positivos en estos casos, valores variables)
- La suma de los números de oxidación para todos los átomos en una molécula o ion poliatómico es igual a la carga en la molécula o ion.
Note: la convención adecuada para informar la carga es escribiendo el número primero, seguido por el signo (por ejemplo, 2+), mientras que el número de oxidación se escribe con la secuencia inversa, el signo siguiendo el número (por ejemplo, +2). Esta convención enfatiza la distinción entre estas dos propiedades relacionadas.
Ejemplo \(\PageIndex{3}\): ASIGNANDO NÚMEROS DE OXIDACIÓN
Siga las reglas en esta sección del texto para asignar números de oxidación a todos los elementos en las siguientes especies:
- H2S
- \(\ce{SO3^2-}\)
- Na2SO4
Solución
(a) De acuerdo con la guía 1, el número de oxidación para H es +1.
Usando este número de oxidación y la fórmula del compuesto, la regla número 4 se puede usar para calcular el número de oxidación del azufre
\(\ce{charge\: on\: H2S}=0=(2\times +1)+(1\times x)\)
\(x=0-(2\times +1)=-2\)
(b) Regla número 3 sugiere que el número de oxidación para el oxígeno es −2.
Usando este número de oxidación y la fórmula del compuesto, la regla número 4 se puede usar para calcular el número de oxidación del azufre
\(\ce{charge\: on\: SO3^2-}=-2=(3\times -2)+(1\times x)\)
\(x=-2-(3\times -2)=+4\)
(c) Para los compuestos iónicos, es conveniente asignar números de oxidación para el catión y el anión separadamente.
De acuerdo con regla número dos, el número de oxidación para el sodio es +1.
Suponiendo que el número de oxidación normal para el oxígeno (−2 según regla número 3), el número de oxidación para el azufre se calcula como lo indica regla número 4:
\(x=-2-(4\times -2)=+6\)
Ejercicio \(\PageIndex{3}\)
Asigne estados de oxidación a los elementos cuyos átomos están subrayados en cada uno de los siguientes compuestos o iones:
- KNO3
- AlH3
- \(\mathrm{\underline{N}H_4^+}\)
- \(\mathrm{\sideset{ }{_{\large{4}}^{-}}{H_2\underline{P}O}}\)
- Respuesta a
-
N, +5
- Respuesta b
-
Al, +3
- Respuesta c
-
N, −3
- Respuesta d
-
P, +5
Usando el concepto de número de oxidación, se ha establecido una definición integral de la reacción redox. Las reacciones de oxidación-reducción (redox) son aquellas en las que uno o más elementos involucrados experimentan un cambio en el número de oxidación. Mientras la mayoría de las reacciones redox involucran cambios en el número de oxidación de dos o más elementos, existen algunas excepciones interesantes a esta regla, como se muestra aquí abajo\). Las definiciones de los procesos complementarios de esta clase de reacción se revisan correspondientemente como se muestra aquí:
\[\begin{align}\textbf{oxidation}&=\textrm{increase in oxidation number}\\
\textbf{reduction}&=\textrm{decrease in oxidation number}
\end{align}\]
Volviendo a las reacciones usadas para introducir este tema, ahora ambos se pueden identificar como procesos redox. En la reacción entre sodio y cloro para producir cloruro de sodio, el sodio se oxida (su número de oxidación aumenta de 0 en Na a +1 en NaCl) y el cloro se reduce (su número de oxidación baja de 0 en Cl2 a -1 en NaCl). En la reacción entre el hidrógeno molecular y el cloro, el hidrógeno se oxida (su número de oxidación aumenta de 0 en H2 a +1 en HCl) y el cloro se reduce (su número de oxidación baja de 0 en Cl2 a -1 en HCl).
Se reconocen varias subclases de reacciones redox, incluyendo las reacciones de combustión en las que el reductor (también llamado combustible) y el oxidante (a veces, pero no necesariamente, el oxígeno molecular) reaccionan vigorosamente y producen cantidades significativas de calor, y con frecuencia luz, en forma de una llama. Las reacciones sólidas de combustible de cohetes, como la que se muestra al rato, son procesos de combustión. Una reacción propulsora típica en la que el aluminio sólido se oxida con perclorato de amonio se representa por esta ecuación:
\[\ce{10Al}(s)+\ce{6NH4ClO4}(s)\rightarrow \ce{4Al2O3}(s)+\ce{2AlCl3}(s)+\ce{12H2O}(g)+\ce{3N2}(g)\]
Mire este breve video que muestra el disparo de prueba de un motor de cohete híbrido prototipo a pequeña escala planeado para su uso en el nuevo sistema de lanzamiento espacial que está desarrollando NASA. Los primeros motores que disparan a los 3 s (llama verde) usan una mezcla de combustible líquido/oxidante, y los segundos motores más potentes que encienden a los 4 s (llama amarilla) usan una mezcla sólida.
Las reacciones de un solo desplazamiento (reemplazo) son reacciones redox en las que un ion en solución se desplaza (o reemplaza) a través de la oxidación de un elemento metálico. Un ejemplo común de este tipo de reacción es la oxidación ácida de ciertos metales:
Los elementos metálicos también se pueden oxidar por soluciones de otras sales metálicas; por ejemplo:
Esta reacción se puede observar si colocas un alambre de cobre en una solución que contiene una sal de plata disuelta. Los iones de plata en solución se reducen a plata elemental en la superficie del alambre de cobre, y los iones Cu2+ que resultan se disuelven en la solución para producir un color azul característico (Figura \(\PageIndex{4}\)).

Ejemplo \(\PageIndex{4}\): Describiendo reacciones redox
Identifique qué ecuaciones representan reacciones redox, dando un nombre para la reacción, si corresponde. Para las reacciones identificadas como redox, nombre el oxidante y el reductor.
- \(\ce{ZnCO3}(s)\rightarrow \ce{ZnO}(s)+\ce{CO2}(g)\)
- \(\ce{2Ga}(l)+\ce{3Br2}(l)\rightarrow \ce{2GaBr3}(s)\)
- \(\ce{2H2O2}(aq)\rightarrow \ce{2H2O}(l)+\ce{O2}(g)\)
- \(\ce{BaCl2}(aq)+\ce{K2SO4}(aq)\rightarrow \ce{BaSO4}(s)+\ce{2KCl}(aq)\)
- \(\ce{C2H4}(g)+\ce{3O2}(g)\rightarrow \ce{2CO2}(g)+\ce{2H2O}(l)\)
Solución
Las reacciones redox se identifican por definición si uno o más elementos experimentan un cambio en el número de oxidación.
- Esta no es una reacción redox, porque los números de oxidación permanecen sin cambios para todos los elementos.
- Esta es una reacción redox. El galio se oxida, su número de oxidación aumenta de 0 en Ga(l) a +3 en GaBr3(s). El agente reductor es Ga(l). El bromo se reduce, su número de oxidación baja de 0 en Br2(l) a -1 en GaBr3(s). El agente oxidante es Br2(l) .
- Esta es una reacción redox. Es un proceso particularmente interesante, porque involucra el mismo elemento, el oxígeno, que experimenta tanto la oxidación como la reducción (la llamada reacción de desproporción). El oxígeno se oxida, su número de oxidación aumenta de -1 en H2O2(aq) a 0 en O2(g). El oxígeno también se reduce, su número de oxidación disminuye de −1 en H2O2 (aq) a −2 en H2O(l) . Para las reacciones de desproporción, la misma sustancia funciona como un oxidante y un reductor.
- Esta no es una reacción redox, porque los números de oxidación permanecen sin cambios para todos los elementos.
- Esta es una reacción redox (combustión). El carbono se oxida, su número de oxidación aumenta de −2 en C2H4(g) a +4 en CO2(g). El agente reductor (combustible) es C2H4(g). El oxígeno se reduce, su número de oxidación baja de 0 en O2(g) a -2 en H2O(l) . El agente oxidante es O2(g).
Ejercicio \(\PageIndex{4}\)
Esta ecuación describe la producción del cloruro de estaño (II):
¿Es esta una reacción de redox? Si es, de le un nombre más específico para la reacción, si es apropiado, y también identifique el oxidante y el reductor.
- Respuesta
-
Sí, es una reacción de un solo reemplazo. Sn(s) es el reductor, HCl (g) es el oxidante.
Balanceando las reacciones redox usando el método de media reacción
Las reacciones de redox que tienen lugar en medios acuosos a veces involucran el agua, iones hidronio, e iones hidróxido como reactivos o productos. Aunque estas especies no se oxidan ni se reducen, participan en el cambio químico de otras maneras (por ejemplo, al dar los elementos necesarios para formar oxianiones). A veces, las ecuaciones que representan estas reacciones son muy difíciles de equilibrar usando la inspección, por eso se han desarrollado enfoques sistemáticos para ayudar en el proceso. Un enfoque muy útil es usar el método de reacciones medias, que usa los siguientes pasos:
- Escriba las dos medias reacciones que representan el proceso redox.
- Balancee todos los elementos excepto el oxígeno y el hidrógeno.
- Balancee los átomos de oxígeno usando la adición de moléculas de H2O.
- Balancee los átomos de hidrógeno agregando iones H+.
- Balancee la carga1 usando la adición de electrones.
- Si es necesario, multiplique los coeficientes de cada media reacción por los números enteros más pequeños posibles para obtener números iguales de electrones en cada uno.
- Agregue las semirreacciones balanceadas y simplifique por eliminando las especies que aparecen en ambos lados de la ecuación.
- Para las reacciones que ocurren en medios básicos (exceso de iones de hidróxido), haga estos pasos adicionales:
- Sume los OH- iones a ambos lados de la ecuación en números iguales al número de iones H+.
- En el lado de la ecuación que contiene los iones H+ y OH-, combine estos iones para producir moléculas de agua.
- Simplifique la ecuación eliminando cualquier molécula de agua redundante.
- Finalmente, verifique que tanto el número de átomos como las cargas totales2 estén balanceadas.
Ejemplo \(\PageIndex{5}\): Balanceado REACCIONES DE REDOX EN una SOLUCIÓN ACÍDICA
Escriba una ecuación balanceada para la reacción entre el ion dicromato y el hierro (II) para producir el hierro (III) y el cromo (III) en una solución ácida.
Solución
Escriba dos reacciones medias
Cada media reacción contendrá un reactivo y un producto con un elemento en común.
\(\ce{Cr2O7^2- \rightarrow Cr^3+}\)
Balancee todos los elementos excepto el oxígeno y el hidrógeno. La media reacción del hierro ya está balanceada, pero la media reacción del cromo muestra dos átomos de Cr a la izquierda y un átomo de Cr a la derecha. Cambie el coeficiente del lado derecho de la ecuación a 2 para lograr el balance de los átomos de Cr.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+}\)
Balancee los átomos de oxígeno por adición de moléculas de H2O. La media reacción del hierro no contiene átomos de O. La media reacción del cromo muestra siete átomos de O a la izquierda y ninguno a la derecha, por eso se agregan siete moléculas de agua al lado derecho.
\(\ce{Cr2O7^2- \rightarrow 2Cr^3+ + 7H2O}\)
Balancee los átomos de hidrógeno por la adición de iones H+. La media reacción del hierro no contiene átomos de H. La media reacción del cromo muestra 14 átomos de H a la derecha y ninguno a la izquierda, por eso se agregan 14 iones de hidrógeno al lado izquierdo.
\(\ce{Cr2O7^2- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Balancee la carga por la adición de electrones. La media reacción de hierro muestra una carga total de 2+ en el lado izquierdo (1 ion Fe2+) y 3+ en el lado derecho (1 ion Fe3+). Al agregar un electrón al lado derecho, la carga total de ese lado sube a (3+) + (1−) = 2+, y se logra el balanceo de la carga.
La media reacción del cromo muestra una carga total de (1 × 2−) + (14 × 1+) = 12+ en el lado izquierdo (\(\ce{1Cr2O7^2-}\) ion y 14 H+ iones) . La carga total en el lado derecho es (2 × 3+) = 6 + (2 iones Cr3+). Agregando seis electrones al lado izquierdo hace que la carga total de ese lado sea (12+ + 6−) = 6+, y la carga se balancea.
\(\ce{Fe^2+ \rightarrow Fe^3+ + e-}\)
\(\ce{Cr2O7^2- + 14H+ + 6e- \rightarrow 2Cr^3+ + 7H2O}\)
Multiplique las dos medias reacciones para que el número de electrones en una reacción sea igual al número de electrones en la otra reacción. Para ser consistente con la conservación de masa, y la idea que las reacciones redox involucran la transferencia (no creación o destrucción) de electrones, el coeficiente de la media reacción de hierro se debe multiplicar por 6.
\(\ce{6Fe^2+ \rightarrow 6Fe^3+ + 6e-}\)
\(\ce{Cr2O7^2- + 6e- + 14H+ \rightarrow 2Cr^3+ + 7H2O}\)
Agregue las medias reacciones balanceadas y cancele las especies que aparecen en ambos lados de la ecuación.
Solo los seis electrones son especies redundantes. Cuando se eliminan de cada lado de la ecuación, se obtiene la ecuación simplificada y balanceada aquí:
Una verificación final del átomo y el balance de la carga confirma que la ecuación está balanceada.
| Reactivos | Productos | |
|---|---|---|
| Fe | 6 | 6 |
| Cr | 2 | 2 |
| O | 7 | 7 |
| H | 14 | 14 |
| carga | 24+ | 24+ |
Ejercicio \(\PageIndex{5}\)
En una solución ácida, el peróxido de hidrógeno reacciona con Fe2+ para producir Fe3+ y H2O. Escriba una ecuación balanceada para esta reacción.
- Respuesta
-
\[\ce{H2O2}(aq)+\ce{2H+}(aq)+\ce{2Fe^2+} \rightarrow \ce{2H2O}(l)+\ce{2Fe^3+} \nonumber\]
Resumen
Las reacciones químicas se clasifican de acuerdo con reglas de comportamiento similares. Muchas reacciones importantes se incluyen en tres categorías: la precipitación, el ácido-base, y la oxidación-reducción (redox). Las reacciones de precipitación involucran la formación de uno o más productos insolubles. Las reacciones ácido-base involucran la transferencia de iones de hidrógeno entre los reactivos. Las reacciones redox involucran un cambio en el número de oxidación para uno o más elementos reactivos. La escritura de ecuaciones balanceadas para algunas reacciones redox que ocurren en soluciones acuosas se simplifican usando un enfoque sistemático llamado método de media reacción.
Notas al pie de la página
- 1 El requisito de "balanceo de carga" es solo un tipo específico de "balance de masa" en el que las especies en cuestión son electrones. Una ecuación debe representar un número igual de electrones en los reactivos y el lado del producto, por eso los átomos y las cargas deben estar balanceados.
- 2 El requisito de "balancee de carga" es solo un tipo específico de "balancee de masa" en el que las especies en cuestión son electrones. Una ecuación debe representar un número igual de electrones en los reactivos y el lado del producto, por eso los átomos y las cargas deben estar balanceados.
Glosario
- ácido
- Sustancia que produce H3O+ cuando se disuelve en agua.
- reacción ácido-base
- Reacción que involucra la transferencia de un ion hidrógeno entre especies reactivas.
- base
- Sustancia que produce OH- cuando se disuelve en agua.
- reacción de combustión
- Reacción redox vigorosa que produce cantidades significativas de energía en forma de calor y, a veces, luz.
- media reacción
- Una ecuación que muestra si cada reactivo pierde o gana electrones en una reacción.
- insoluble
- de solubilidad relativamente baja; disolviendo sólo un poco
- reacción de neutralización
- Reacción entre un ácido y una base que produce sal y agua.
- oxidación
- Proceso en el que el número de oxidación de un elemento sube por la pérdida de electrones.
- reacción de oxidación-reducción
- Reacción (también, reacción redox) que involucra un cambio en el número de oxidación para uno o más elementos reactivos.
- número de oxidación
- (también, estado de oxidación) la carga que cada átomo de un elemento tendría en un compuesto si el compuesto fuera iónico
- agente oxidante
- (también, oxidante) sustancia que provoca la oxidación de otra sustancia, y en el proceso se reduce
- precipitado
- Producto insoluble que se forma por la reacción de reactivos solubles.
- reacción de precipitación
- reacción que produce uno o más productos insolubles; cuando los reactivos son compuestos iónicos, a veces llamados doble desplazamiento o metátesis
- reducción
- Proceso en el que el número de oxidación de un elemento baja por la ganancia de electrones.
- agente reductor
- (También, reductor) sustancia que provoca la reducción de otra sustancia y en el proceso se oxida.
- sal
- Compuesto iónico que se puede formar por la reacción de un ácido con una base que contiene un catión y un anión que no sea hidróxido u óxido.
- reacción de un solo desplazamiento
- (también, reemplazo) Reacción redox que involucra la oxidación de una sustancia elemental por una especie iónica.
- soluble
- de solubilidad relativamente alta; disuelve en un grado relativamente grande
- solubilidad
- La medida en que una sustancia se puede disolver en agua o cualquier disolvente.
- ácido fuerte
- Ácido que reacciona completamente cuando se disuelve en agua para producir iones hidronio.acid that reacts completely when dissolved in water to yield hydronium ions
- base fuerte
- Base que reacciona completamente cuando se disuelve en agua para producir iones hidróxido.
- ácido débil
- Ácido que reacciona solo un poco cuando se disuelve en agua para producir iones hidronio.
- base débil
- Base que reacciona solo un poco cuando se disuelve en agua para producir iones hidróxido.
Contribuyentes
Paul Flowers (Universidad de Carolina del Norte - Pembroke), Klaus Theopold (Universidad de Delaware) y Richard Langley (Stephen F. Austin Universidad del Estado) con autores contribuyentes. Contenido del libro de texto producido por la Universidad de OpenStax tiene licencia de Atribución de Creative Commons Licencia 4.0 licencia. Descarge gratis en http://cnx.org/contents/85abf193-2bd...a7ac8df6@9.110)."
Ana Martinez (amartinez02@saintmarys.edu) contribuyó a la traducción de este texto.


