2.3: Factores electrónicos que rigen la unión y la estructura
- Page ID
- 71772
La unión y la estructura de un compuesto están determinadas por propiedades electrónicas como el poder de los átomos constituyentes para atraer o repeler electrones, los orbitales moleculares ocupados por electrones de valencia, etc. Las disposiciones geométricas de los átomos también están influenciadas por las interacciones electrónicas entre los no enlaces electrones. Aquí se describen algunos conceptos fundamentales.
a) Carga nuclear efectiva
Dado que la carga nuclear positiva generalmente está compensada por la carga negativa de los electrones internos en la capa de electrones dentro de los electrones de valencia, la carga nuclear que sienten los electrones de valencia es menor que la carga entera, Ze para un número atómico Z. Esta reducción se expresa por el constante de blindaje\(\sigma\), y la carga nuclear neta se denomina carga nuclear efectiva, Z eff e.
\[Z_{eff} = Z - \sigma\]
La carga nuclear efectiva varía con diferentes orbitales de electrones y distancias desde el núcleo.
b) Energía de ionización
La energía de ionización se define como la energía mínima requerida para eliminar un electrón del átomo en una fase gaseosa (g), como se muestra en la siguiente ecuación. La energía de ionización se expresa en unidades de electrón voltio (eV), donde 1 eV = 96.49 kJ mol -1.
\[A(g) \rightarrow A^{+} (g) + e^{-} (g)\]
La primera energía de ionización, que elimina el electrón más externo, es la más pequeña, y las energías de ionización segunda y tercera, que ionizan aún más los cationes, aumentan rápidamente. La entalpía de ionización, que es el cambio de entalpía estándar del proceso de ionización y se utiliza en los cálculos termodinámicos, es la energía de ionización multiplicada por RT (R es la constante gaseosa universal 8.31451 J K -1 mol -1 y T es la temperatura, 2.479 kJ (0.026 eV), en la habitación temperatura). La diferencia entre estos dos parámetros es pequeña. La primera energía de ionización varía periódicamente con el número atómico a través de la tabla periódica, siendo la inferior izquierda (cesio, Cs) la más pequeña y la superior derecha (helio, He) la más grande.
Es comprensible que los metales alcalinos generalmente tienen las energías de ionización más bajas porque se estabilizan mediante la eliminación de un electrón s para alcanzar la configuración de gas raro. Los elementos de gas raros tienen estructuras electrónicas estables, y sus energías de ionización son las más grandes. Si bien la energía de ionización aumenta casi monótonamente de metales alcalinos a gases raros en cada periodo, hay reversiones en varios lugares, como nitrógeno N y oxígeno O, y fósforo P y azufre S. Las primeras energías de ionización se dan en la Tabla\(\PageIndex{5}\).
| Atom | I | A | \(\chi_{M}\) |
|---|---|---|---|
| H | 13.60 | 0.75 | \ (\ chi_ {M}\) ">7.18 |
| Él | 24.59 | \ (\ chi_ {M}\) "> | |
| Li | 5.39 | 0.62 | \ (\ chi_ {M}\) ">3.01 |
| Be | 9.32 | \ (\ chi_ {M}\) "> | |
| B | 8.30 | 0.28 | \ (\ chi_ {M}\) ">4.29 |
| C | 11.26 | 1.27 | \ (\ chi_ {M}\) ">6.27 |
| N | 14.53 | \ (\ chi_ {M}\) "> | |
| O | 13.62 | 1.46 | \ (\ chi_ {M}\) ">7.54 |
| F | 17.42 | 3.40 | \ (\ chi_ {M}\) ">10.41 |
| Ne | 21.56 | \ (\ chi_ {M}\) "> | |
| Na | 5.14 | 0.55 | \ (\ chi_ {M}\) ">2.85 |
| Mg | 7.65 | \ (\ chi_ {M}\) "> | |
| Al | 55.99 | 0.44 | \ (\ chi_ {M}\) ">3.22 |
| Si | 8.15 | 1.39 | \ (\ chi_ {M}\) ">4.77 |
| P | 10.49 | 0.75 | \ (\ chi_ {M}\) ">5.62 |
| S | 10.36 | 2.08 | \ (\ chi_ {M}\) ">6.22 |
| Cl | 12.97 | 3.61 | \ (\ chi_ {M}\) ">8.29 |
| Ar | 15.76 | \ (\ chi_ {M}\) "> | |
| K | 4.34 | 0.50 | \ (\ chi_ {M}\) ">2.42 |
| Ca | 6.11 | 0.02 | \ (\ chi_ {M}\) ">3.07 |
| Sc | 6.56 | 0.19 | \ (\ chi_ {M}\) ">3.38 |
| Ti | 6.83 | 0.08 | \ (\ chi_ {M}\) ">3.45 |
| V | 6.75 | 0.53 | \ (\ chi_ {M}\) ">3.64 |
| Cr | 6.77 | 0.67 | \ (\ chi_ {M}\) ">3.72 |
| Mn | 7.44 | \ (\ chi_ {M}\) "> | |
| Fe | 7.90 | 0.15 | \ (\ chi_ {M}\) ">4.03 |
| Co | 7.88 | 0.66 | \ (\ chi_ {M}\) ">4.27 |
| Ni | 7.64 | 1.16 | \ (\ chi_ {M}\) ">4.40 |
| Cu | 7.73 | 1.24 | \ (\ chi_ {M}\) ">4.48 |
| Zn | 9.99 | \ (\ chi_ {M}\) "> | |
| Ga | 6.00 | 0.30 | \ (\ chi_ {M}\) ">3.20 |
| Ge | 7.90 | 1.23 | \ (\ chi_ {M}\) ">4.61 |
| Como | 9.82 | 0.81 | \ (\ chi_ {M}\) ">5.31 |
| Se | 9.75 | 2.02 | \ (\ chi_ {M}\) ">5.89 |
| Br | 11.81 | 3.36 | \ (\ chi_ {M}\) ">7.59 |
| Kr | 14.00 | \ (\ chi_ {M}\) "> | |
| Rb | 4.18 | 0.49 | \ (\ chi_ {M}\) ">2.34 |
| Sr | 5.69 | 0.11 | \ (\ chi_ {M}\) ">2.90 |
| Y | 622 | 0.31 | \ (\ chi_ {M}\) ">3.27 |
| Zr | 6.63 | 0.43 | \ (\ chi_ {M}\) ">3.53 |
| Nb | 6.76 | 0.89 | \ (\ chi_ {M}\) ">3.83 |
| Mo | 7.09 | 0.75 | \ (\ chi_ {M}\) ">3.92 |
| Ru | 7.36 | 1.05 | \ (\ chi_ {M}\) ">4.26 |
| Rh | 7.46 | 1.14 | \ (\ chi_ {M}\) ">4.30 |
| Pd | 8.34 | 0.56 | \ (\ chi_ {M}\) ">4.45 |
| Ag | 7.58 | 1.30 | \ (\ chi_ {M}\) ">4.44 |
| Cd | 8.99 | \ (\ chi_ {M}\) "> | |
| En | 5.79 | 0.30 | \ (\ chi_ {M}\) ">3.10 |
| Sn | 7.34 | 1.11 | \ (\ chi_ {M}\) ">4.23 |
| Sb | 8.64 | 1.07 | \ (\ chi_ {M}\) ">4.86 |
| Te | 9.01 | 1.97 | \ (\ chi_ {M}\) ">5.49 |
| I | 10.45 | 3.06 | \ (\ chi_ {M}\) ">6.76 |
| Xe | 12.13 | \ (\ chi_ {M}\) "> | |
| Cs | 3.89 | 0.47 | \ (\ chi_ {M}\) ">2.18 |
| Ba | 5.21 | 0.15 | \ (\ chi_ {M}\) ">2.68 |
| La | 5.58 | 0.50 | \ (\ chi_ {M}\) ">3.09 |
| Hf | 6.83 | 0.00 | \ (\ chi_ {M}\) ">3.42 |
| Ta | 7.89 | 0.32 | \ (\ chi_ {M}\) ">4.11 |
| W | 7.98 | 0.82 | \ (\ chi_ {M}\) ">4.40 |
| Re | 7.88 | 0.15 | \ (\ chi_ {M}\) ">0.40 |
| Os | 8.70 | 1.10 | \ (\ chi_ {M}\) ">4.90 |
| Ir | 9.10 | 1.60 | \ (\ chi_ {M}\) ">5.40 |
| Pt | 9.00 | 2.13 | \ (\ chi_ {M}\) ">5.61 |
| Au | 9.23 | 2.31 | \ (\ chi_ {M}\) ">5.77 |
| Hg | 10.44 | \ (\ chi_ {M}\) "> | |
| Tl | 6.11 | 0.20 | \ (\ chi_ {M}\) ">3.16 |
| Pb | 7.42 | 0.36 | \ (\ chi_ {M}\) ">3.89 |
| Bi | 7.29 | 0.95 | \ (\ chi_ {M}\) ">4.12 |
(c) Afinidad electrónica
La afinidad electrónica es la negativa de la entalpía de ganancia de electrones\(\Delta\) H eg de un átomo en fase gaseosa, como se muestra en la siguiente ecuación y denotada por A e (= -\(\Delta\) H eg) (Tabla\(\PageIndex{5}\)).
\[A(g) + e^{-} (g) \rightarrow A^{-} (g)\]
Se puede considerar como la entalpía de ionización de un anión. Dado que los átomos de halógeno logran configuraciones raras de electrones de gas si se les agrega un electrón, sus afinidades electrónicas son grandes.
d) Electronegatividad
La electronegatividad es uno de los parámetros atómicos más fundamentales que expresa numéricamente la tendencia a atraer electrones a átomos en una molécula. Es muy útil para explicar las diferencias en la unión, estructura y reacción desde el punto de vista de las propiedades atómicas. Se han propuesto diversos esquemas para explicar las bases teóricas del poder de atracción de electrones, y los estudios aún buscan activamente nuevos valores numéricos de electronegatividad. La escala de Pauling, introducida por primera vez en 1932, sigue siendo la más utilizada, y los nuevos valores numéricos posteriores se han justificado si son cercanos a los de Pauling.
L. Pauling definió la electronegatividad como el carácter iónico cuantitativo de los enlaces. Originalmente, se propuso la siguiente ecuación como una fórmula para definir el carácter iónico del enlace entre los átomos A y B.
\[\Delta D(AB) - \frac{1}{2} [D(AA) + D(BB)]\]
donde D es la energía de enlace de un enlace covalente. Sin embargo, resultó que no es necesariamente positivo, y Pauling modificó la definición
\[\Delta = D(AB) - \sqrt{D(AA) \times D(BB)}\]
y lo redefinió como el carácter iónico del enlace A-B. Además, la electronegatividad se\(\chi\) definió de tal manera que la diferencia de las electronegatividades de los átomos A y B es proporcional a la raíz cuadrada del carácter iónico. Aquí, el coeficiente
\[| \chi_{A} - \chi_{B}| = 0.208 \sqrt{\Delta}\]
0.208 se determina de tal manera que la electronegatividad del hidrógeno H se convierte en 2.1 cuando las energías de enlace se expresan en kcal mol -1. Dado que las electronegatividades de Pauling aumentan cuanto mayores son los estados de oxidación de un átomo, estos valores corresponden al mayor número de oxidación de cada elemento. Las electronegatividades calculadas utilizando valores recientes de energías de enlace se muestran en la Tabla\(\PageIndex{6}\).
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
|---|---|---|---|---|---|---|---|---|---|
| 1 | H 2.2 |
||||||||
| 2 | Li 0.98 |
Ser 1.57 |
|||||||
| 3 | Na 0.93 |
Mg 1.31 |
|||||||
| 4 | K 0.82 |
Ca 1.00 |
Sc 1.36 |
Ti 1.54 |
V 1.63 |
Cr 1.66 |
Mn 1.55 |
Fe 1.83 |
Co 1.88 |
| 5 | Rb 0.82 |
Sr 0.95 |
Y 1.22 |
Zr 1.33 |
Nb 1.6 |
Mo 2.16 |
Tc 1.9 |
Ru 2.2 |
Rh 2.28 |
| 6 | Cs 0.79 |
Ba 0.89 |
Lantanoide | Hf 1.3 |
Ta 1.5 |
W 2.36 |
Re 1.9 |
Os 2.2 |
Ir 2.20 |
| 7 | Fr 0.7 |
Ra 0.9 |
Actinoide |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
|---|---|---|---|---|---|---|---|---|
| Él | ||||||||
| B 2.04 |
C 2.55 |
N 3.04 |
O 3.44 |
F 3.98 |
Ne | |||
| Al 1.61 |
Si 1.90 |
P 2.19 |
S 2.58 |
Cl 3.16 |
Ar | |||
| Ni 1.91 |
Cu 2.0 |
Zn 1.65 |
Ga 1.81 |
Ge 2.01 |
Como 2.18 |
Se 2.55 |
Br 2.96 |
Kr 3.0 |
| Pd 2.20 |
Ag 1.93 |
Cd 1.69 |
En 1.78 |
Sn 1.96 |
Sb 2.05 |
Te 2.10 |
I 2.66 |
Xe 2.6 |
| Pt 2.28 |
Au 2.54 |
Hg 2.00 |
Tl 2.04 |
Pb 2.33 | Bi 2.02 |
Po 2.0 |
A 2.2 |
Rn |
A. L. Allred y E. G.. Rochow definió la electronegatividad como el campo eléctrico Z eff/r 2 en la superficie atómica. Agregaron una constante para hacer la electronegatividad lo más cerca\(\chi_{AR}\) posible a los valores de Pauling usando r para el radio de enlace covalente de los átomos.
\[\chi_{AR} = 0.74 + 0.36 \frac{Z_{eff}}{r^{2}}\]
Resulta que los elementos con radios covalentes pequeños y grandes cargas nucleares efectivas tienen grandes electronegatividades (Tabla\(\PageIndex{6}\)).
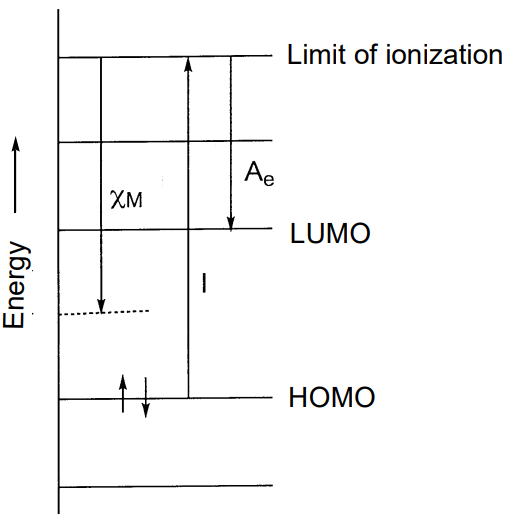
R. Mulliken definió la electronegatividad\(\chi_{M}\) como el promedio de la energía de ionización I y la afinidad electrónica A e de la siguiente manera (Figura\(\PageIndex{14}\)).
\[\chi_{M} = \frac{1}{2} (I + A_{e})\]
Como la energía de ionización es la energía de excitación electrónica del HOMO y la afinidad electrónica la energía de adición de electrones al LUMO (refiérase a la Sección 2.3 (e)), en esta definición la electronegatividad también puede denominarse el valor promedio de los niveles de energía del HOMO y LUMO. Aquellos elementos que son difíciles de ionizar y fáciles de atraer electrones tienen grandes valores. Aunque la electronegatividad se define para los átomos en estado de valencia en una molécula y tiene las dimensiones de energía, se trata como un número adimensional (Tabla\(\PageIndex{5}\)).
Si bien la definición de Mulliken es inteligible ya que está directamente relacionada con los orbitales atómicos, generalmente se utilizan los valores de Pauling o Allred-Rochow. Como estos valores no son muy diferentes, la electronegatividad de Pauling es apropiada a la hora de elegir solo uno. Los valores de electronegatividad cambian no solo por definición, sino que también se ven considerablemente afectados por el estado de unión de los átomos, y deben usarse con considerable precaución. Las electronegatividades de los átomos constituyentes son fundamentales para explicar las diferencias en la unión, estructura y reacciones de los compuestos. Por lo tanto, los químicos teóricos continúan en sus esfuerzos para extender firmemente los fundamentos de este parámetro.
Ejercicio\(\PageIndex{4}\)
Describir la tendencia numérica de las electronegatividades de los elementos en la tabla periódica.
- Contestar
-
Aumentan hacia la derecha y disminuyen por la mesa. A saber, la electronegatividad del Cs de metal alcalino es la más pequeña y la del flúor F es la más grande.
e) Orbitales moleculares
Las funciones de onda de los electrones en un átomo se denominan orbitales atómicos. Dado que la probabilidad de encontrar electrones en un orbital molecular es proporcional al cuadrado de una función de onda, el mapa de electrones parece una función de onda. Una función de onda tiene dominios de amplitud positiva y negativa llamados lóbulos. Los lóbulos positivos superpuestos o lóbulos negativos de las funciones de onda de los átomos en una molécula se amplifican entre sí para formar un enlace, pero los lóbulos positivo y negativo se cancelan entre sí formando ningún enlace. El alcance de este efecto de interferencia corresponde a la magnitud de la integral de superposición en la química cuántica.
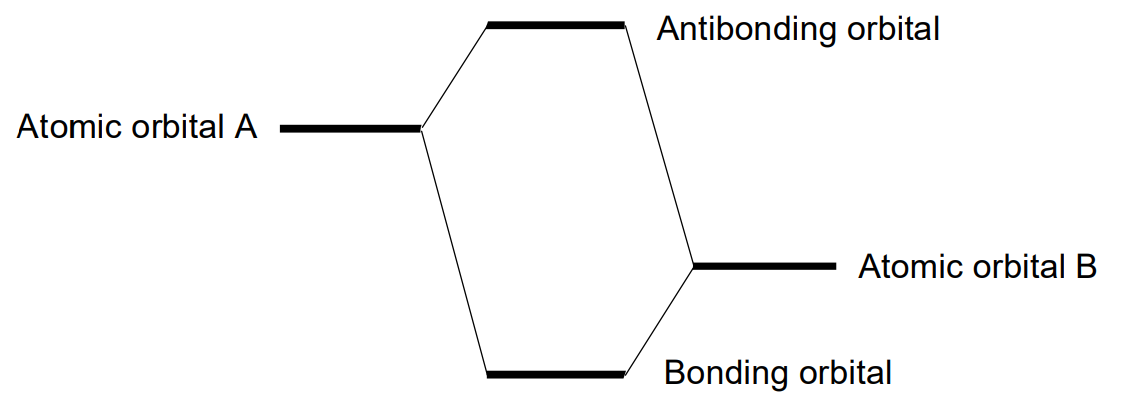
En la formación de una molécula, los orbitales atómicos se superponen para generar un orbital molecular que es la función de onda de los electrones en la molécula. El número de orbitales moleculares es la suma de los orbitales atómicos y estos orbitales moleculares se clasifican en orbitales moleculares enlazantes, no enlazantes o antiligantes por la extensión de su participación en el enlace entre átomos. Las condiciones de formación de un orbital molecular de enlace son las siguientes.
[Condiciones de la formación de orbitales moleculares de unión]
- Los lóbulos de los orbitales atómicos de los átomos constituyentes son adecuados para un solapamiento.
- El signo positivo o negativo de los lóbulos superpuestos es el mismo.
- Los niveles de energía de los orbitales atómicos están cerca.
Aquí se explica el caso más simple en el que se construye un orbital molecular a partir de los orbitales atómicos A y B. Se forma un orbital molecular de unión entre A y B si se cumplen las condiciones antes mencionadas (1), (2) y (3), pero si se invierte el signo de uno de los orbitales atómicos, no se satisface la condición (2) y un orbital molecular antiunión, en el que los signos de los lóbulos superpuestos son diferentes (Figura \(\PageIndex{15}\)) resultados. El nivel de energía de un orbital de unión es menor y el nivel de un orbital antienlace es mayor que los de los orbitales atómicos constituyentes. Cuanto mayor sea la diferencia de energía de un enlace y un orbital antiadhesión, más fuerte será el enlace. Cuando no hay interacción de unión o antiunión entre A y B, el orbital molecular resultante es un orbital no enlazante. Los electrones ocupan los orbitales moleculares en orden de menor a mayor nivel de energía. El orbital molecular ocupado más alto se llama HOMO y el más bajo desocupado el LUMO. Ken'ichi Fukui (premio Nobel de 1981) nombró a estos orbitales orbitales fronterizos.
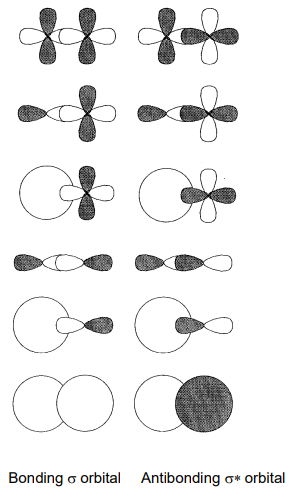
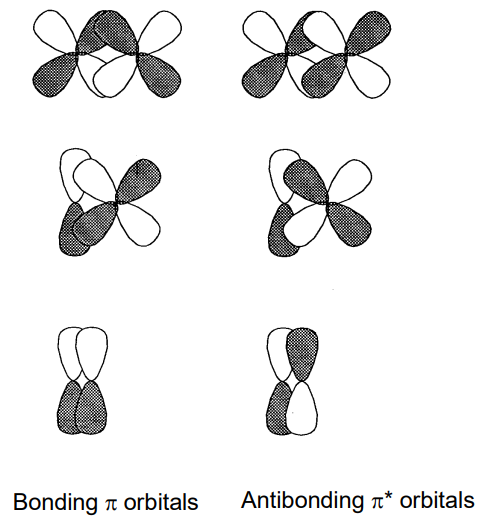
Dos o más orbitales moleculares de igual energía se denominan orbitales degenerados. El símbolo de un orbital no degenerado es a o b, un orbital doblemente degenerado e y un orbital triple degenerado t. El símbolo g (gerade) se adjunta como sufijo al orbital centrosimétrico y u (ungerado) al orbital que cambia de signo bajo inversión alrededor de un centro de inversión. El número antes del símbolo de simetría se utiliza en orden de energía para distinguir orbitales de la misma degeneración. Adicionalmente, se denominan orbitales sigma (\(sigma\)) o pi (\(\pi\)) según el carácter orbital. Un orbital sigma tiene simetría de rotación alrededor del eje de enlace, y un orbital pi tiene un plano nodal. Por lo tanto, los enlaces sigma están formados por la superposición de orbitales s-s, p-p, s-d, p-d y d-d (Figura\(\PageIndex{16}\)) y los enlaces pi la superposición de orbitales p-p, p-d y d-d (Figura\(\PageIndex{17}\)).
Cuando las funciones de onda de dos átomos se establecen en\(\phi_{A}\) y\(\phi_{B}\), un orbital molecular es una combinación lineal de los orbitales atómicos (LCAO) expresada como
\[\psi = C_{A} \phi_{A} + C_{B} \phi_{B}\]
Solo los orbitales atómicos de la capa de electrones de valencia se utilizan en el método orbital molecular más simple. La construcción de un orbital molecular se ilustra a continuación para el caso más simple de las moléculas de dos átomos. Todos los niveles por debajo del HOMO están ocupados por electrones y los niveles por encima del LUMO están vacíos.
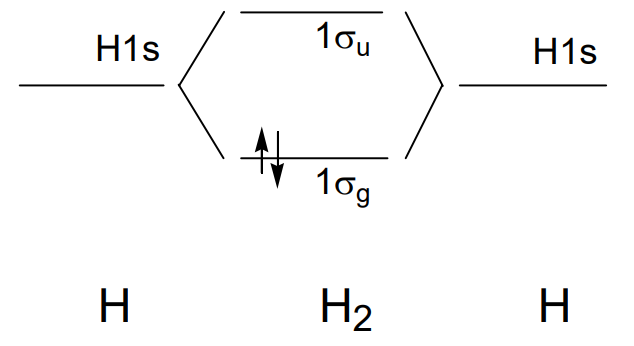
En una molécula de hidrógeno, H 2, el solapamiento del orbital 1s de cada átomo de hidrógeno forma un orbital de enlace\(\sigma_{g}\) si los lóbulos tienen signo igual y un orbital antienlace\(\sigma_{u}\) si tienen signos opuestos, y dos electrones ocupan el orbital de enlace\(\sigma_{g}\) (Figura\(\PageIndex{18}\)).
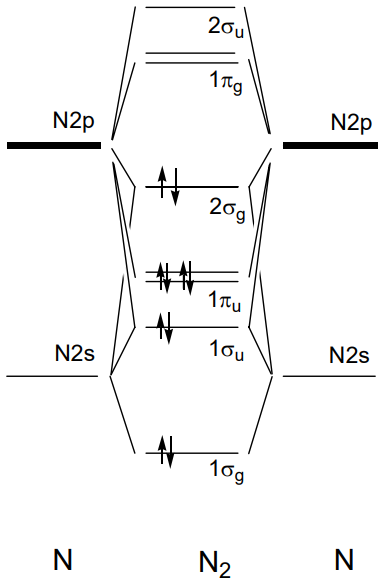
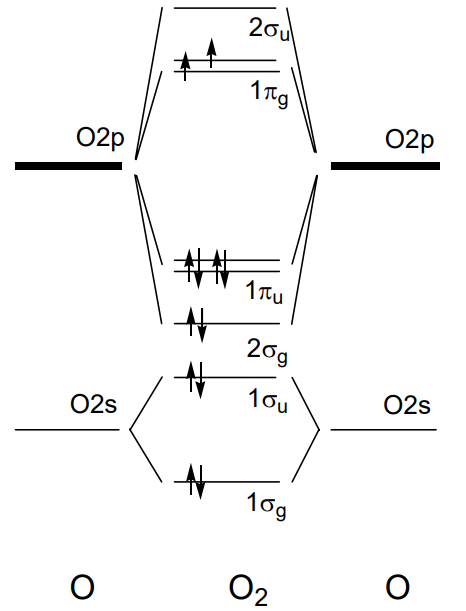
En las moléculas de dos átomos del 2do periodo, del litio Li 2 al flúor F 2, si el eje z se establece como eje de enlace, 1\(\sigma_{g}\) y 1\(\sigma_{u}\) están formados por el solapamiento de 2s orbitales de cada átomo y 2\(\sigma_{g}\) y 2\(\sigma_{u}\) de los orbitales 2p z y 1\(\pi_{u}\) y 1 \(\pi_{g}\)de 2p x, y 2p y. Los niveles de energía orbital para las moléculas de Li 2 a N 2 se ordenan como 1\(\sigma_{g}\) < 1\(\sigma_{u}\) < 1\(\pi_{u}\) < 2\(\sigma_{g}\) < 1\(\pi_{g}\) < 2\(\sigma_{u}\) y los electrones ocupan los niveles secuencialmente desde el fondo. El ejemplo de una molécula N 2 con diez electrones de valencia se muestra en la Figura\(\PageIndex{19}\). Dado que el orden de los orbitales es algo diferente en O 2 y F 2, en los que el\(\sigma_{g}\) orbital 2 se encuentra bajo el de 1\(\pi_{u}\), el orbital molecular de la molécula de oxígeno, O 2, se ilustra en la Figura\(\PageIndex{20}\). Los electrones 11 y 12 de entre los 12 electrones de valencia ocupan el\(\sigma_{g}\) orbital doblemente degenerado 1 en el estado fundamental y tienen espines paralelos bajo el gobierno de Hund y por lo tanto una molécula de oxígeno tiene dos electrones desapareados.
Los orbitales moleculares de dos átomos diferentes están formados por la superposición de orbitales atómicos con diferentes niveles de energía. El nivel de energía de la órbita del átomo con mayor electronegatividad generalmente es menor, y los orbitales moleculares son más característicos del orbital atómico con el nivel de energía más cercano. Por lo tanto, los orbitales de unión tienen el carácter del átomo con la electronegatividad más grande, y los orbitales antiadherentes el del átomo con la electronegatividad más pequeña.
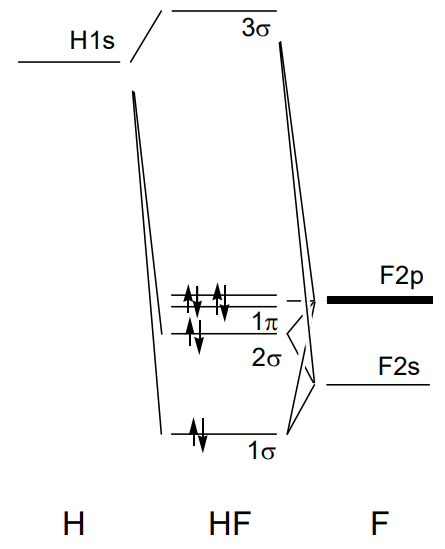
Por ejemplo, cinco orbitales moleculares en fluoruro de hidrógeno, HF, se forman a partir del orbital 1s del hidrógeno y los orbitales 2s y 2p de flúor, como se muestra en la Figura\(\PageIndex{21}\). El\(\sigma\) orbital de enlace 1 tiene el carácter 2s del flúor, y el\(\sigma\) orbital antienlace 3 el carácter 1s del hidrógeno. Dado que el hidrógeno tiene solo un orbital 1s, el solapamiento con el orbital 2p del flúor con\(\pi\) carácter no es efectivo, y el orbital de flúor 2p se convierte en un orbital no enlazante. Dado que HF tiene ocho electrones de valencia, este orbital no enlazante es el HOMO.
En monóxido de carbono, CO, carbono y oxígeno tienen orbitales 2s y 2p dando como resultado enlaces sigma y pi, y se forma un triple enlace entre los átomos. Si bien 8 orbitales moleculares en este caso son cualitativamente los mismos que los de la molécula de nitrógeno isolectrónico N 2 y 10 electrones ocupan el orbital hasta 3\(\sigma\), el nivel de energía de cada orbital difiere del de la molécula de nitrógeno. El\(\sigma\) orbital de unión 1 tiene el carácter 2s del oxígeno debido a su mayor electronegatividad, y el\(\pi\) orbital de unión 1 también tiene el carácter 2p del oxígeno. Los\(\sigma\) orbitales antiadherentes 2\(\pi\) y 4 tienen el carácter 2p del carbono (Figura\(\PageIndex{22}\)).
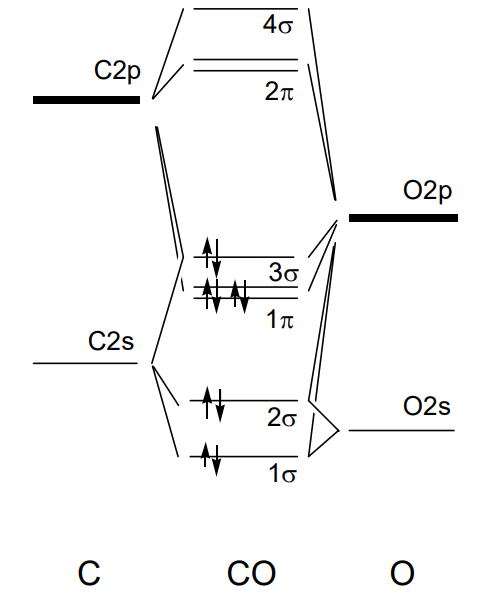
El orden de enlace entre los átomos es la mitad del número de electrones en los orbitales de enlace menos los de los orbitales antiadherentes. Por ejemplo, en N 2 o CO, es igual a\(\frac{1}{2}\) (8 - 2) = 3 y es consistente con la estructura de Lewis.
Ejercicio\(\PageIndex{5}\)
¿Por qué los orbitales atómicos del átomo de oxígeno en el diagrama orbital molecular del monóxido de carbono, CO, son más bajos que los del carbono?
- Contestar
-
Es porque la electronegatividad del oxígeno es mayor que la del carbono.
problemas
2.1
Usando la ecuación de Pauling, se calcula la electronegatividad del cloro a partir de las energías de enlace de la molécula de hidrógeno H 2 (432 kJ mol -1), la molécula de cloro Cl 2 (239 kJ mol -1) y la molécula de cloruro de hidrógeno HCl (428 kJ mol -1) y electronegatividad del hidrógeno (\(\chi\)= 2.1).
2.2
¿Por qué los niveles de energía\(\sigma_{g} < \sigma_{u}\) en los orbitales de carácter sigma y\(\pi_{u} < \pi_{g}\) en los de carácter pi están en el diagrama orbital molecular de N 2 o O 2?
Gran teoría y evaluación
La teoría del electrón de valencia de Lewis propone que se forme un enlace covalente con un par de electrones y que hay ocho electrones de valencia alrededor de cada átomo. Este es un concepto muy importante con el que entendemos los vínculos entre los elementos principales del grupo. Sin embargo, la teoría no se tuvo en la consideración suficientemente alta como para que se otorgara un premio Nobel a Lewis. Una de las razones de este desprecio parece ser que los químicos en Estados Unidos, patria de Lewis, ignoraron su teoría al principio, y que un ganador del premio Nobel, Langmuir, extendió la teoría de Lewis, que más tarde se conoció como la teoría de Lewis-Langmuir. N. Bohr, el eminente físico que tuvo gran influencia en la selección del premio Nobel, evaluó más altamente la teoría de adsorción de Langmuir, lo que sugiere que los físicos consideraban la teoría de Lewis demasiado simplista.
Hay una historia similar sobre la teoría del estado de transición de H. Eyring. Los físicos y químicos teóricos, a quienes les gustaba el tratamiento matemático de los fenómenos químicos, pensaron que la teoría de Eyring's era demasiado poco sofisticada. Por ello, el concepto más importante en cinética química no fue considerado para un premio Nobel. Se trata de un episodio de la historia de la química que nos recuerda el comentario de R. Hoffmann, quien señaló que los conceptos simples son más importantes que las teorías matemáticas engañosamente complicadas.

