4.2: Elementos del grupo principal de los periodos 2 y 3 y sus compuestos
- Page ID
- 71789
a) Boro
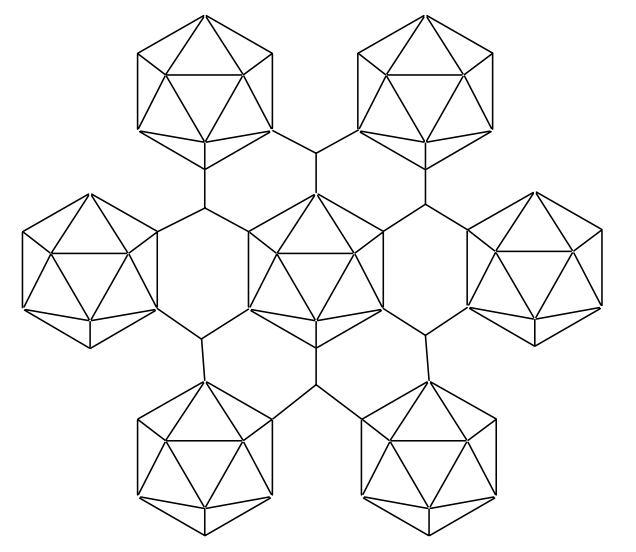
El boro elemental refinado es un sólido negro con un brillo metálico. La celda unitaria de boro cristalino contiene 12, 50 o 105 átomos de boro, y las unidades estructurales icosaédricas B 12 se unen entre sí por 2 enlaces centrales de 2 electrones (2c-2e) y 3 enlaces centrales de 2 electrones (3c-2e) (enlaces deficientes en electrones) entre átomos de boro (Figura\(\PageIndex{1}\)). El boro es muy duro y muestra semiconductividad.
La química de los boranos (hidruros de boro) se inició a partir de la investigación de A. Stock reportada durante el periodo 1912-1936. Aunque el boro es adyacente al carbono en la tabla periódica, sus hidruros tienen propiedades completamente diferentes a las de los hidrocarburos. Las estructuras de los hidruros de boro en particular fueron inesperadas y solo pudieron explicarse por un nuevo concepto en unión química. Por su contribución a la muy extensa nueva química inorgánica de los hidruros de boro, W. N. Lipscomb ganó el premio Nobel en 1976. Otro premio Nobel (1979) fue otorgado a H. C. Brown por el descubrimiento y desarrollo de una reacción muy útil en síntesis orgánica llamada hidroboración.
Debido a las muchas dificultades asociadas con los bajos puntos de ebullición de los boranos, así como su actividad, toxicidad y sensibilidad al aire, Stock tuvo que desarrollar nuevos métodos experimentales para manejar los compuestos al vacío. Mediante estas técnicas, preparó seis boranos B 2 H 6, B 4 H 10, B 5 H 9, B 5 H 11, B 6 H 10 y B 10 H 14 por las reacciones de boruro de magnesio, MgB 2, con ácidos inorgánicos, y determinaron sus composiciones. Sin embargo, fueron necesarias investigaciones adicionales para determinar sus estructuras. En la actualidad, el método sintético original de Stock utilizando MgB 2 como compuesto de partida se utiliza únicamente para la preparación de B 6 H 10. Dado que los reactivos tales como tetrahidroborato de litio, LiBH 4 y tetrahidroborato de sodio, NaBH 4, están ahora fácilmente disponibles, y el diborano, B 2H 6, se prepara de acuerdo con la siguiente ecuación, los boranos superiores se sintetizan mediante la pirólisis de diborano.
\[3 LiBH_{4} + 4 BF_{3} \cdot OEt_{2} \rightarrow 2 B_{2} H_{6} + 3 LiBF_{4} + 4 Et_{2} O\]
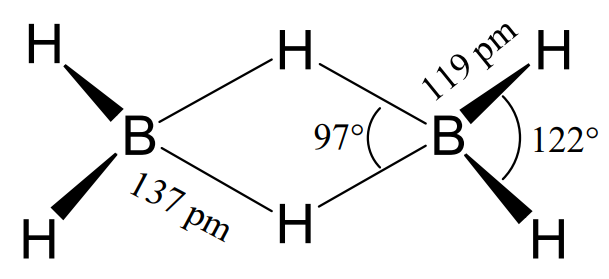
Se introdujo una nueva teoría de la unión química para dar cuenta de la estructura de unión del diborano, B 2 H 6. Aunque en 1912 se propuso una estructura de puente de hidrógeno casi correcta para el diborano, muchos químicos prefirieron una estructura similar al etanol, H 3 B-BH 3, por analogía con los hidrocarburos. Sin embargo, H. C. Longuet-Higgins propuso el concepto del enlace 3-centro 2 electrones deficiente en electrones (enlace 3c-2e) y se comprobó por difracción de electrones en 1951 que la estructura era correcta (Figura\(\PageIndex{2}\)).
Se ha dilucidado por difracción de electrones, análisis de estructura de rayos X monocristalinos, espectroscopía infrarroja, etc. que los boranos contienen enlaces 3-centrales de 2 electrones (enlace 3c-2e) B-H-B y
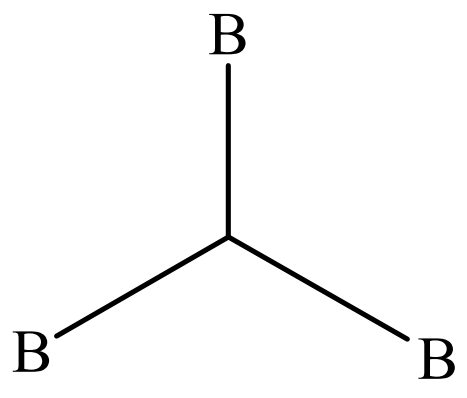
además de los habituales enlaces covalentes de 2 centrales y 2 electrones (enlace 2c-2e) B-H y B-B. Tales estructuras pueden ser tratadas satisfactoriamente por la teoría orbital molecular. Los boranos se clasifican en closo, nido, aracno, etc. según las estructuras esqueléticas de los átomos de boro.
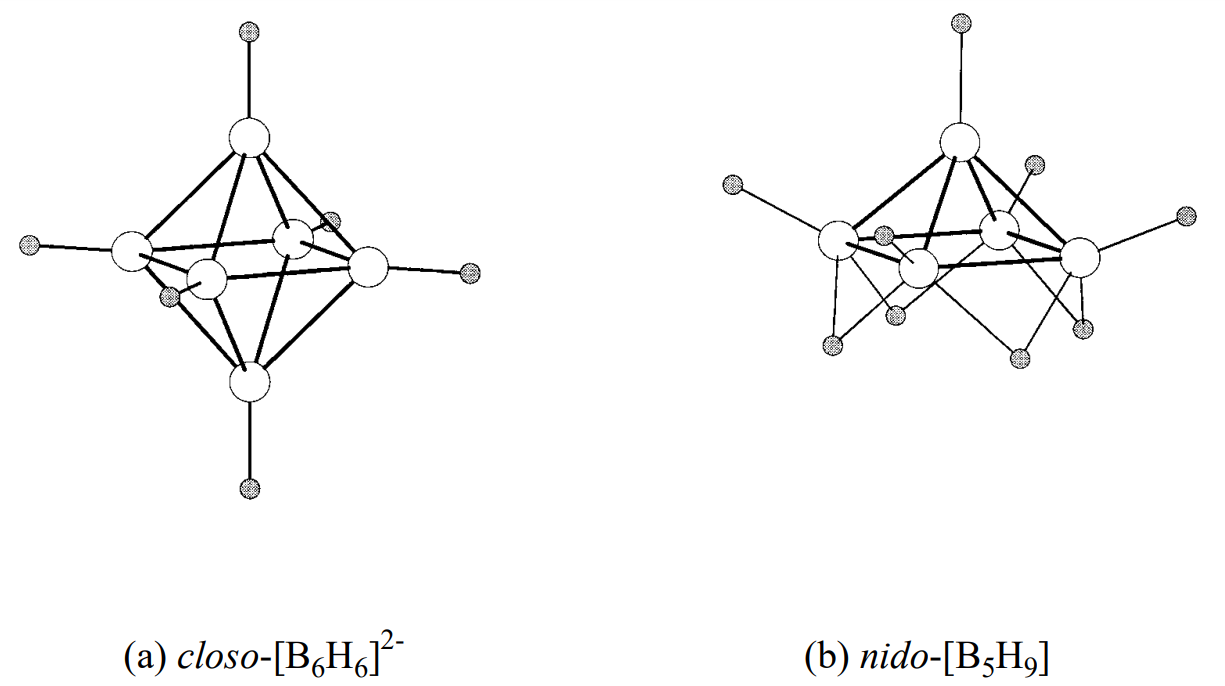
El closo -borano [B n H n] 2- tiene la estructura de un poliedro cerrado de n átomos de boro unidos a n átomos de hidrógeno, como se ve en los ejemplos de un octaedro regular [B 6 H 6] 2- y un icosaedro [B 12 H 12] 2-. Los boranos de esta serie no contienen enlaces B-H-B. Los boranos B n H n +4, como B 5 H 9, forman estructuras con enlaces B-B, B-B-B y B-H-B y carecen del ápice del poliedro de closo boranos, y se denominan boranos tipo nido. Borano B n H n +6, como B 4 H 10, tienen unas estructuras que carecen de dos ápices del tipo closo y son más abiertas. Los esqueletos también son construidos por enlaces B-B, B-B-B y B-H-B, y estos se denominan boranos tipo aracno. Las estructuras de los boranos típicos se muestran en la Figura\(\PageIndex{3}\).
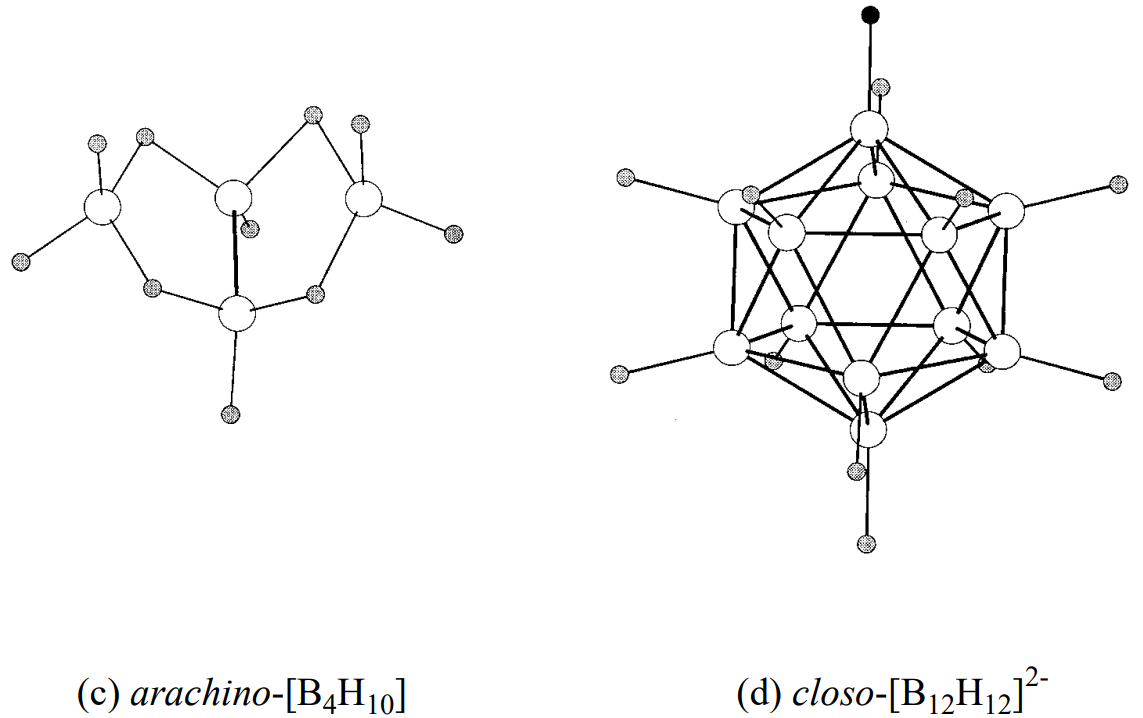
No solo el diborano sino también los boranos superiores son compuestos deficientes en electrones que son difíciles de explicar usando la estructura electrónica de Lewis' basada en simples enlaces covalentes de 2 electrones centrales.
Ejercicio\(\PageIndex{2}\)
¿Por qué el diborano se llama un compuesto deficiente en electrones?
- Contestar
-
Es porque solo hay 12 electrones de valencia de átomos de boro e hidrógeno, aunque son necesarios 16 electrones para asignar dos electrones cada uno a ocho enlaces B-H.
K. Wade resumió la relación entre el número de electrones de valencia utilizados para los enlaces esqueléticos y las estructuras de los boranos y propuso una regla empírica llamada regla de Wade. Según esta regla, cuando el número de átomos de boro es n, los electrones de valencia esquelética son 2 (n+1) para un tipo closo, 2 (n+2) para un tipo nido y 2 (n+3) para un borano de tipo aracno. La relación entre la estructura esquelética de un compuesto de racimo y el número de electrones de valencia también es un problema importante en los compuestos de conglomerados de metales de transición, y la regla de Wade ha jugado un papel importante en la mejora de nuestra comprensión de las estructuras de estos compuestos.
b) Carbono
El grafito, el diamante, el fullereno y el carbono amorfo son alótropos de carbono. Por lo general, un átomo de carbono forma cuatro enlaces usando cuatro electrones de valencia.
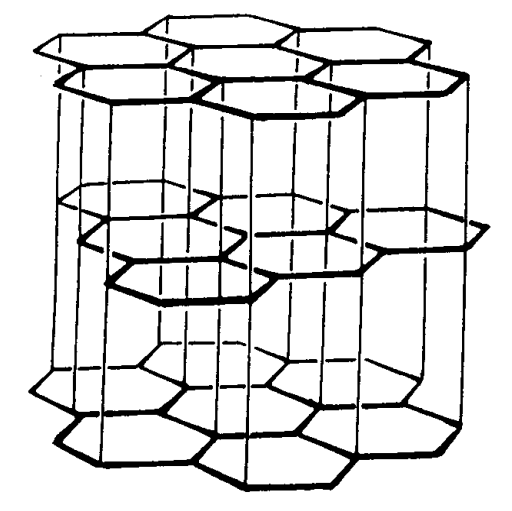
Grafito
El grafito está estructurado como capas de anillos de 6 miembros en forma de panal de átomos de carbono que parecen anillos de benceno condensado sin ningún átomo de hidrógeno (Figura\(\PageIndex{4}\)). La distancia carbono-carbono entre los átomos de carbono en la capa es de 142pm y los enlaces tienen un carácter de doble enlace análogo a los compuestos aromáticos. Dado que la distancia entre capas es de 335pm y las capas se mantienen unidas por fuerzas comparativamente débiles de van der Waals, se deslizan cuando se someten a una fuerza aplicada. Este es el origen de las propiedades lubricantes del grafito. Diversas moléculas, como metales alcalinos, halógenos, haluros metálicos y compuestos orgánicos se intercalan entre las capas y forman compuestos de intercalación. El grafito tiene conductividad eléctrica semimetálica (aproximadamente 10 -3\(\Omega\) cm paralelos a las capas y aproximadamente 100 veces más resistente en la dirección perpendicular).
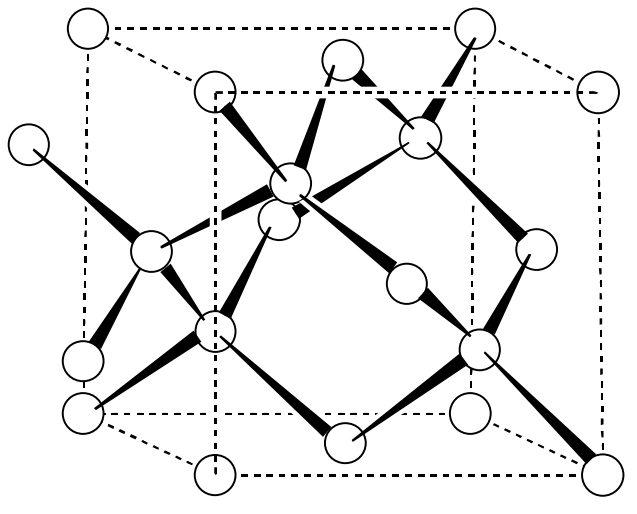
Diamante
Su estructura se llama estructura tipo diamante (Figura\(\PageIndex{5}\)). Una celda unitaria de diamante contiene ocho átomos de carbono y cada átomo de carbono es de 4 coordenadas en un tetraedro regular. El diamante es la sustancia más dura conocida, con una dureza Mohs 10. El diamante tiene una conductividad térmica muy alta aunque es un aislante eléctrico. Aunque anteriormente un mineral precioso solo se formaba de forma natural, los diamantes industriales ahora se preparan comercialmente en grandes cantidades a altas temperaturas (1200 °C o más) y bajo altas presiones (5 GPa o más) a partir de grafito usando catalizadores metálicos. En los últimos años, las películas delgadas de diamante se han realizado a bajas temperaturas (alrededor de 900 ° C) y a bajas presiones (alrededor de 102 Pa) por la pirólisis de hidrocarburos, y se utilizan para fines de recubrimiento, etc.
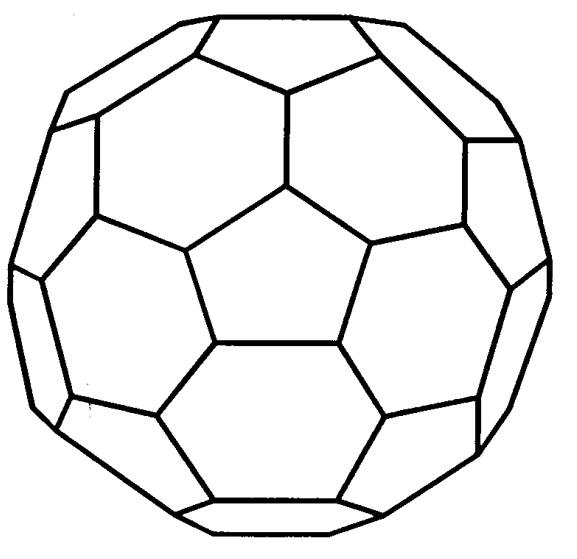
Fullereno
Fullereno es el nombre general del 3er alótropo de carbono, del cual la molécula en forma de bola de fútbol C 60 es un ejemplo típico (Figura 4.6). R. E. Smalley, H. W. Kroto y otros detectaron C 60 en los espectros de masas del producto de calentamiento láser del grafito en 1985, y el aislamiento de fullereno de este llamado “hollín” se reportó en 1991. Tiene la estructura de un icosaedro truncado (corte de esquina) y existe un carácter de doble enlace entre los átomos de carbono. Es soluble en solventes orgánicos, siendo las soluciones de benceno moradas. Por lo general, se aísla y purifica por cromatografía de mezclas de fullereno. La investigación de amplio alcance sobre reactividades químicas y propiedades físicas como la superconductividad, está progresando rápidamente. Además C 60, C 70 y nanotubos de carbono están atrayendo interés.
(c) Silicio
El silicio es el elemento más abundante en la corteza terrestre después del oxígeno. La mayor parte de este silicio existe como componente de rocas de silicato y el elemento no se encuentra como una sustancia simple. Por lo tanto, el silicio es producido por la reducción de cuarzo y arena con carbono de alta calidad utilizando hornos de arco eléctrico. El silicio de grado superior se obtiene por reducción de hidrógeno de SiHCl3, que se produce por la hidrocloración de silicio de baja pureza seguida de rectificación. El silicio utilizado para los dispositivos semiconductores se refina aún más por el cristal Czochralski o métodos de fusión por zona. El cristal (mp 1410 o C) tiene un brillo metálico y la estructura tipo diamante.
Hay tres isótopos de silicio, 28 Si (92.23%), 29 Si (4.67%) y 30 Si (3.10%). Debido a su espín nuclear de I = 1/2, 29 Si se utiliza para estudios de RMN de compuestos orgánicos de silicio o silicatos (RMN en estado sólido).
Los silicatos y compuestos organosilícicos muestran una amplia gama de estructuras en la química del silicio. La sección 4.3 (c) describe las propiedades de los silicatos. La química de organosilicio es el área de investigación más activa en la química inorgánica de elementos del grupo principal distintos del carbono. La química del silicio ha progresado notablemente desde el desarrollo de un proceso industrial para producir compuestos organosilícicos mediante la reacción directa del silicio con cloruro de metilo CH 3 Cl en presencia de un catalizador de cobre. Este proceso histórico fue descubierto por E. G. Rochow en 1945. La resina de silicona, la goma de silicona y el aceite de silicona encuentran una amplia aplicación. En los últimos años, los compuestos de silicio también han sido ampliamente utilizados en síntesis orgánicas selectivas.
Aunque el silicio es un congénere del carbono, sus propiedades químicas difieren considerablemente. Un ejemplo bien conocido es el contraste del dióxido de silicio SiO 2 con su estructura tridimensional, y el dióxido de carbono gaseoso, CO 2. El primer compuesto (Mes) 2 Si=Si (Mes) 2 (Mes es mesitilo C 6 H 2 (CH 3) 3) con un doble enlace silicio-silicio se reportó en 1981, en contraste con los ubicuos enlaces múltiples carbono-carbono. Dichos compuestos se utilizan para estabilizar enlaces inestables con sustituyentes voluminosos (estabilización cinética).
Ejercicio\(\PageIndex{3}\)
¿Por qué son diferentes las propiedades de CO 2 y SiO 2?
- Contestar
-
Sus propiedades son muy diferentes porque el CO 2 es una molécula de tres átomos en forma de cadena y el SiO 2 es un compuesto sólido con los puentes tridimensionales entre los átomos de silicio y oxígeno.
d) Nitrógeno
El nitrógeno es un gas incoloro e inodoro que ocupa 78.1% de la atmósfera (relación de volumen). Se produce en grandes cantidades junto con oxígeno (bp -183.0 °C) licuando aire (bp -194.1 °C) y fraccionando nitrógeno (bp -195.8 °C). El nitrógeno es un gas inerte a temperatura ambiente pero convertido en compuestos nitrogenados por fijación biológica de nitrógeno y síntesis industrial de amoníaco. La causa de su inercia es la gran energía de enlace del triple enlace\(\equiv\) N N.
Los dos isótopos de nitrógeno son 14 N (99.634%) y 15 N (0.366%). Ambos isótopos son nuclidos activos en NMR.
e) Fósforo
El fósforo simple se fabrica mediante la reducción de fosfato de calcio, Ca 3 (PO 4) 2, con roca de cuarzo y coque. Los alótropos incluyen fósforo blanco, fósforo rojo y fósforo negro.
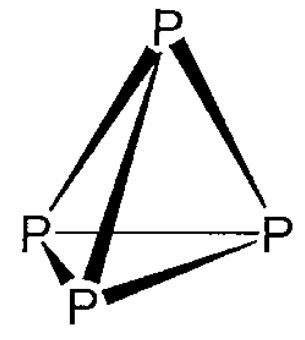
El fósforo blanco es una molécula de composición de P 4 (Figura\(\PageIndex{7}\)). Tiene un bajo punto de fusión (mp 44.1 °C) y es soluble en benceno o disulfuro de carbono. Debido a que es pirofórico y mortal venenoso, debe estar manejando con cuidado.
El fósforo rojo es amorfo y su estructura no está clara. Se supone que el componente principal es una cadena formada por la polimerización de moléculas de P 4 como resultado de la apertura de uno de los enlaces P-P. No es pirofórico ni venenoso, y se utiliza en grandes cantidades para la fabricación de cerillas, etc.
El fósforo negro es el alótropo más estable y se obtiene del fósforo blanco a alta presión (aproximadamente 8 GPa). Es un sólido con un brillo metálico y una estructura laminar. Aunque es un semiconductor bajo presiones normales, muestra conductividad metálica bajo altas presiones (10 GPa).
Compuestos de fósforo como ligandos
Las fosfinas terciarias, PR 3, y los fosfitos, P (OR) 3, son ligandos muy importantes en la química de complejos de metales de transición. Especialmente la trifenilfosfina, P (C 6 H 5) 3, trietil fosfina, P (C 2 H5) 3 y sus derivados son ligandos útiles en muchos complejos, ya que es posible controlar con precisión sus propiedades electrónicas y estéricas modificando sustituyentes ( refiérase a la Sección 6.3 (c)). Aunque son básicamente donantes sigma, pueden exhibir algún carácter aceptor de pi al cambiar los sustituyentes en Ph aceptores de electrones (fenilo), OR, Cl, F, etc. El orden del carácter aceptor de electrones estimado a partir de las vibraciones de estiramiento C-O y 13 desplazamientos químicos de RMN C compuestos carbonílicos metálicos sustituidos con fosfina o fosfito son los siguientes (Ar es un arilo y R es un alquilo).
\[PF_{3} > PCl_{3} > P(OAr)_{3} > P(OR)_{3} > PAr_{3} > PRAr_{2} > PR_{2}Ar > PR_{3}\]
Por otro lado, C. A. Tolman ha propuesto que el ángulo en el vértice de un cono que rodea a los sustituyentes de un ligando de fósforo a la distancia de contacto de van der Waals puede ser un parámetro útil para evaluar el volumen estérico de fosfinas y fosfitos. Este parámetro, llamado el ángulo del cono, es ampliamente utilizado (Figura\(\PageIndex{8}\)). Cuando el ángulo del cono es grande, el número de coordinación disminuye por impedimento estérico, y la constante de equilibrio de disociación y la velocidad de disociación de un ligando de fósforo se vuelven grandes (Tabla\(\PageIndex{2}\)). La expresión numérica del efecto estérico es muy útil, y se han realizado muchos estudios al respecto.
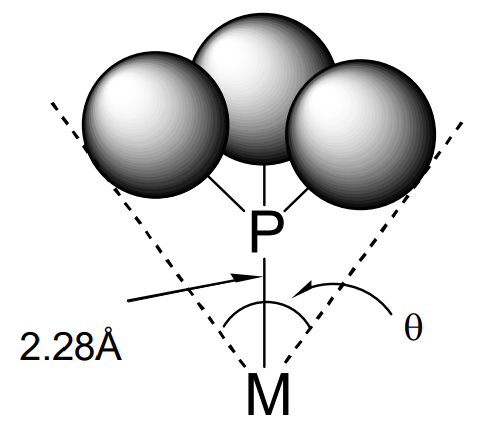
| Ligandos | Ángulos de cono |
|---|---|
| P (OEt) 3 | 109 |
| PMe 3 | 118 |
| P (OPh) 3 | 121 |
| PET 3 | 132 |
| PMe 2 Ph | 136 |
| PPh 3 | 145 |
| P i Pr 3 | 160 |
| P t Bu 3 | 182 |

