4.5: Calcógenos y Calcogenidos
- Page ID
- 71800
a) Sustancias simples
El azufre, el selenio y el teluro se llaman calcógenos. Sustancias simples y compuestos de oxígeno y de los elementos de este grupo en los períodos posteriores tienen propiedades considerablemente diferentes. Como resultado de tener electronegatividades mucho más pequeñas que el oxígeno, muestran una ionicidad disminuida y una mayor covalencia de enlaces, lo que resulta en un menor grado de enlaces de hidrógeno. Debido a que tienen orbitales d disponibles, los calcógenos tienen mayor flexibilidad de valencia y pueden unirse fácilmente a más de otros dos átomos. La catenación es el enlace entre los mismos átomos de calcógeno, y tanto las sustancias simples como los iones de calcógenos toman una variedad de estructuras.
Los principales isótopos de azufre son 32 S (95.02% de abundancia), 33 S (0.75%), 34 S (4.21%) y 36 S (0.02%), y también hay seis isótopos radiactivos. Entre estos, 33 S (I = 3/2) pueden ser utilizados para RMN. Dado que la relación isotópica de los azufres de diferentes ubicaciones difiere, la precisión del peso atómico se limita a 32.07+0.01. Debido a que la electronegatividad del azufre (\(\chi\)= 2.58) es mucho menor que la del oxígeno (\(\chi\)= 3.44) y el azufre es un elemento blando, la ionicidad en los enlaces de los compuestos de azufre es baja y los enlaces de hidrógeno no son importantes. El azufre elemental tiene muchos alótropos, como S 2, S 3, S 6, S 7, S 8, S 9, S 10, S 11, S 12, S 18, S 20 y S \(\alpha\), reflejando el capacidad de catenación de átomos de azufre.
El azufre elemental suele ser un sólido amarillo con un punto de fusión de 112.8 °C llamado azufre ortorrómbico (\(\alpha\)azufre). La transición de fase de este polimorfo produce azufre monoclínico (\(\beta\)azufre) a 95.5 °C; se estableció en 1935 que se trata de moléculas cíclicas tipo corona (Figura\(\PageIndex{18}\)). Al ser moleculares, se disuelven bien en solventes orgánicos, como CS 2. No solo se conocen anillos de 8 miembros sino también anillos S 6-20, y el polímero helicoidal de azufre es un azufre infinitamente anular. El S 2 molecular diatómico y el S 3 molecular triatómico existen en la fase gaseosa. Cuando el azufre se calienta, se licua y se convierte en una macromolécula similar al caucho al enfriarse. La diversidad de estructuras de azufre catenado también se observa en las estructuras de los cationes o aniones poliazufre resultantes de las reacciones redox de las especies catenadas.
Se cree que el selenio tiene seis isótopos. 80 Se (49.7%) es el más abundante y 77 Se, con espín nuclear I = 1/2 es útil en RMN. La precisión del peso atómico del selenio, 78.96+0.03, se limita a dos decimales debido al cambio de composición de sus isótopos. Entre muchos alótropos de selenio, el llamado selenio rojo es una molécula Se 8 con una estructura tipo corona y es soluble en CS 2. El selenio gris metálico es un polímero con una estructura helicoidal. El selenio negro, que es un polímero complicado, también es abundante.
El telurio también tiene ocho isótopos estables y un peso atómico de 127.60+0.03. 130 Te (33.8%) y 128 Te (31.7%) son los isótopos más abundantes, y 125 Te y 123 Te con I = 1/2 pueden usarse en RMN. Solo hay una forma cristalina de teluro, que es un polímero de cadena espiral que muestra conductividad eléctrica.
b) Cationes y aniones calcógenos poliatómicos
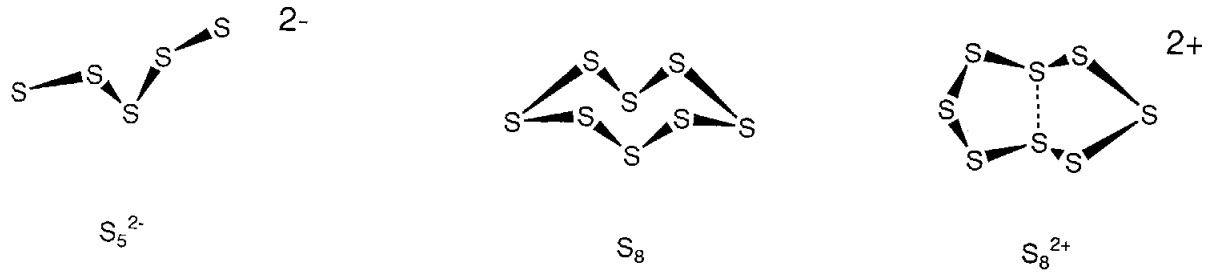
Aunque desde hace tiempo se reconoce que las soluciones de elementos calcógenos en ácido sulfúrico mostraron hermosos colores azul, rojo y amarillo, las especies policatiónicas que dan origen a estos colores, S 4 2+, S 6 2+, S 6 4+, S 8 2+, S 10 2+, S 19 2+, o los de otros átomos de calcógeno, han sido aislados por la reacción con AsF 5, etc. y se han determinado sus estructuras. Por ejemplo, a diferencia del S 8 neutro, el S 8 2+ toma una estructura cíclica que tiene una interacción de acoplamiento débil entre dos átomos de azufre transanulares (Figura\(\PageIndex{18}\)).
Por otro lado, sales de metales alcalinos Na 2 S 2, K 2 S 5, y sal de metal alcalinotérreo BaS 3, una sal de metal de transición [Mo 2 (S 2) 6] 2-, un complejo Cp 2 W (S 4), etc. de aniones polisulfuro S x 2- (x = 1-6), en los que los átomos de azufre están unidos mutuamente han sido sintetizados y se han determinado sus estructuras. Como es evidente por el hecho de que el azufre elemental en sí mismo forma moléculas de S 8, el azufre, a diferencia del oxígeno, tiende a catenar. Por lo tanto, es factible la formación de iones polisulfuro, en los que muchos átomos de azufre están unidos, y en realidad se ha sintetizado una serie de polisulfanos H 2 S x (x = 2-8).
c) Sulfuros metálicos
Los disulfuros estratificados, MS 2, son importantes en los sulfuros de metales de transición. Muestran dos tipos de estructuras. Uno tiene un metal en un ambiente de coordinación prismática triangular, y el otro tiene un metal en un ambiente de coordinación octaédrica.
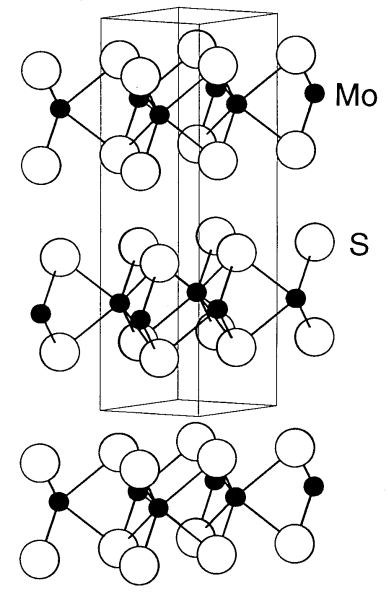
El MoS 2 es el compuesto negro más estable entre los sulfuros de molibdeno. L. Pauling determinó la estructura de MoS 2 en 1923. La estructura se construye laminando dos capas de azufre entre las cuales se intercala una capa de molibdeno (Figura\(\PageIndex{19}\)). Alternativamente, se apilan dos capas de azufre y se inserta una capa de molibdeno entre ellas. Por lo tanto, el ambiente de coordinación de cada molibdeno es un prisma triangular de átomos de azufre. Dado que no hay interacción de unión entre las capas de azufre, pueden deslizarse fácilmente, lo que resulta en una lubricidad similar al grafito. El MoS 2 se utiliza como lubricante sólido agregado a la gasolina, y también como catalizador para reacciones de hidrogenación.
Las ZR 2, TAs 2, etc. toman la estructura tipo CDi 2 que contiene átomos metálicos en un ambiente de coordinación octaédrico construido por átomos de azufre.
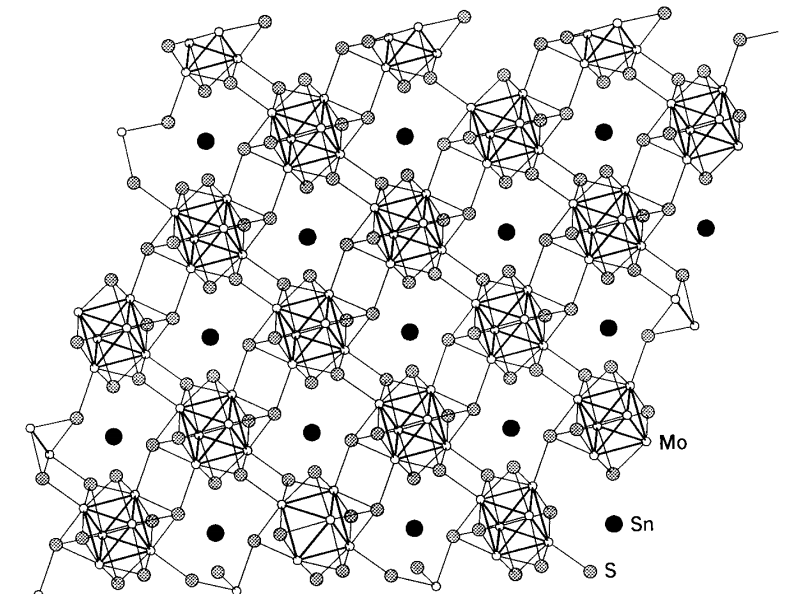
Compuestos de la fase Chevrel
Existen compuestos superconductores llamados fases de Chevrel que son ejemplos importantes de los compuestos calcogenuros de molibdeno. la fórmula general es descrita por M x Mo 6 X 8 (M = Pb, Sn y Cu; X = S, Se y Te), y seis átomos de molibdeno forman un regular cúmulo octaédrico y ocho átomos de calcogenuro coronan las ocho caras triangulares del cúmulo. Las unidades de clúster están conectadas tridimensionalmente (Figura\(\PageIndex{20}\)). Dado que la estructura de conglomerados de los átomos de molibdeno es similar a la del dicloruro de molibdeno, MoCl 2, (= (Mo 6 Cl 8) Cl 2 Cl 4 /2), la química estructural de estos compuestos ha atraído tanto la atención como sus propiedades físicas.